巨噬细胞炎症蛋白-1α通过骨硬化蛋白抑制骨髓瘤骨病患者成骨细胞功能研究
王晓桃,何玉婵,王航飞,阳少芳,张俊艳,高彤彤,吴春叶
(桂林医学院第二附属医院血液内科,广西桂林 541199)
骨髓瘤骨病(myeloma bone disease,MBD)是多发性骨髓瘤(multiple myeloma,MM)患者常见的并发症。MBD以进行性骨质破坏、多发溶骨性病变等为特征,是MM患者致残的主要原因。研究表明,有70%左右的患者因MBD而危及生活质量并增加死亡风险,给家庭及社会造成沉重负担[1]。因此,深入研究MBD发生机制,可为靶向治疗MBD奠定理论基础。
MBD发生的主要机制是在骨髓微环境中,瘤细胞与骨髓基质细胞(bone marrow stromal cells,BMSCs)通过多条信号通路导致破骨细胞(osteoclast,OC)活性增强和成骨细胞(osteoblast,OB)活性减弱,造成溶骨性损害,阻碍新骨生成[2-3]。本课题组的前期研究已证实,巨噬细胞炎症蛋白-1α(macrophage inflammatory protein-1α,MIP-1α)能激活OC,介导瘤细胞生长,并在MBD的发生、发展中发挥重要作用[4]。最新研究发现,MIP-1α有抑制OB的作用[5],但其具体机制不明确。笔者前期研究发现,大部分MM患者骨髓中MIP-1α和骨硬化蛋白(sclerostin,Scl)水平增高,两者呈明显的正相关[6],Scl是Wnt/β-catenin通路的重要抑制剂[7],β-catenin与T细胞因子相互作用,诱导OB碱性磷酸酶(alkaline phosphatase,ALP)的活性,促进前体OB的生长和早期分化、细胞外基质成熟和矿化[8]。因此,本研究拟通过体外实验验证MIP-1α促进瘤细胞表达Scl,从而抑制OB的分化与成熟、细胞外基质成熟和矿化促进OB凋亡,导致MBD的发生、发展。
1 资料与方法
1.1一般资料 选择来自2015年1-12月本科室新确诊的6例MBD患者,其中男4例,女2例,中位年龄64岁(47~73岁)。入选病例均按照国际骨髓瘤工作组的诊断标准确诊为活动性MM,如并发MBD症状的MM患者均需行X线片检查骨盆、颅骨、肱骨、股骨等确诊不同程度的MBD,如无MBD相关症状的MM患者需行全身低剂量CT或胸椎、腰椎MRI以明确有无并发MBD。所有入选患者均签署知情同意书。细胞株:高表达MIP-1α和Scl的人骨髓瘤H929细胞(购自天津血液病研究所[6])及MBD患者BMSCs分化成熟的第3代OB为研究对象。
1.2方法
1.2.1主要试剂和仪器 胎牛血清、小牛血清、DMEM培养基、RPMI-1640干粉均购自杭州四季青公司,淋巴细胞分离液、碱性磷酸酶(Alkaline phosphatase,ALP)测定试剂盒(南京建成生物工程研究所第一分所),Bradford法蛋白定量试剂盒(上海捷瑞生物工程有限公司),二甲基亚砜(DMSO)、地塞米松、β-甘油磷酸钠、维生素C、茜素红染色液(美国Sigma公司)。ALP改良钙钴法染液(南京建成科技有限公司);MIP-1α和Scl ELISA试剂盒(美国Gibco公司);MIP-1α和Scl蛋白,鼠抗人MIP-1α、Scl、IL-6和ALP单克隆抗体,免疫组织化学试剂盒、DAB显色试剂盒,鼠抗人GAPDH单克隆抗体(北京中杉金桥生物技术有限公司);Annexin V FITC细胞凋亡测定试剂盒(美国R&D公司);凝胶电泳仪、酶标仪(美国 Bio-Rad公司),IX73 倒置荧光显微镜(日本Olympus公司)。
1.2.2实验分组 实验分5组:对照组:常规培养基培养;MIP-1α组:培养基加0.2 ng/mL MIP-1α标准品;Scl组:培养基加0.2 ng/mL Scl标准品;MIP-1α单抗(MIP-1α-Ab)组:培养基加0.2 ng/mL MIP-1α单抗;sclerostin 单抗(Scl-Ab)组:培养基加0.2 ng/mL Scl单抗。
1.2.3纯化并原代培养OB并鉴定 从MBD患者髂后上棘处抽取骨髓5~10 mL,肝素抗凝,结合全骨髓培养法,用等量的PBS稀释,按1.0∶1.5比例加入红细胞裂解液,680×g离心20 min,去除上清液,移至无菌培养瓶中,补足完全培养基(15%胎牛血清,1%双抗,DMEM)培养。5 d后首次换液,并在显微镜下观察细胞开始变为梭形、贴壁,后每3天换液1次,待细胞长满视野70%~80%后首次传代,经0.25%胰酶消化,并接种于六孔板,改为OB诱导分化培养基(1×10-8mol/L地塞米松、50 g/mL抗坏血酸及10 mmol/L β-甘油磷酸)。每3天换液1次,并在显微镜下观察细胞形态变化,行茜素红染色,ALP免疫组织化学鉴定为OB后方可进行传代培养并留做后续实验。
1.2.4茜素红染色鉴定并观察钙离子沉积结节 BMSCs分化的OB培养14 d后,换液,种至6孔板,PBS冲洗2次,4%多聚甲醛固定30 min后,再用PBS冲洗3次,用0.1%茜素红-Tris-HCl染色30 min,PBS冲洗,干燥,封固后,倒置相差显微镜下观察钙结节。
1.2.5OB的定性检查 改良Gomori钙钻法ALP染色,倒置相差显微镜观察。ALP阳性细胞表现为细胞质出现棕黑色片状颗粒。
1.2.6H929细胞传代培养 H929细胞在含10%澳洲胎牛血清(美国Gibco公司)、5%小牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPMI-1640培养基中,37 ℃、5% CO2细胞培养箱中悬浮培养。
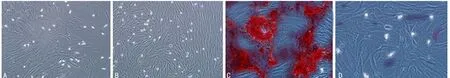
A:BMSCs分离纯化培养10 d;B:BMSCs分离纯化培养14 d;C:茜素红染色BMSCs分离纯化培养14 d的OB;D:ALP染色BMSCs分离纯化培养14 d的OB
图1 BMSCs分离培养纯化OB(×40)
1.2.7ELISA定量检测H929细胞上清液中的MIP-1α和Scl水平 取对数生长的H929细胞,离心弃上清液,用无血清的RPMI-1640培养基重悬调整细胞数为1×105/mL,为防止其他细胞因子的干扰,加入终浓度为1.0 ng/mL的鼠抗人IL-6单克隆抗体,静置4 h,以中和骨髓瘤细胞分泌的主要生长因子IL-6,弃上清液,PBS冲洗3次,按实验分组处理细胞培养24 h后,收集各组的上清液,用MIP-1α、Scl ELISA试剂盒定量检测各组细胞上清液中的MIP-1α、Scl水平,ELISA具体检测方法按试剂盒说明书进行。
1.2.8各组OB活性定量检测 OB按1×105/mL种于六孔板中培养2 d,PBS冲洗2次,根据实验分组予以更换相应的培养液,培养3 d后弃上清液,用0.25%胰酶消化细胞,置于离心管,680×g离心10 min,去上清液,加TritonX-100裂解液1 mL,反复冻融3次(冻约30 min,融约3 min)取出样品,按ALP试剂盒说明书配制测定管、标准管和空白管,每个管混匀后37 ℃水浴10 min,再加上显色剂,立即混匀,用分光光度计在波长520 nm下进行比色,测定各组细胞ALP活性,并用Bradford法进行细胞蛋白标准化(按蛋白检测试剂盒说明操作),最后用ALP/总蛋白的值计数ALP[单位:比活性(U/mg)]。
1.2.9Western blot检测各组细胞中的ALP蛋白的表达 按1.2.3方法鉴定OB后,取对数生长期的第3代OB按1×105/mL加入6孔培养板,按实验分组处理细胞继续培养24 h后,按凯基全蛋白提取试剂盒说明书提取第3代OB的总蛋白,再按BCA蛋白定量试剂盒说明书定量后于-20 ℃保存。取30 μg总蛋白行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),然后转至聚偏氟乙烯(PVDF)膜,5%脱脂奶粉封闭1 h,加入抗ALP(1∶500)一抗、GAPDH(1∶600),冰箱4 ℃孵育过夜,室温培育1 h,TBST溶液清洗3遍,每遍5 min,TBST洗膜后用ECL法显影。条带用Imαge J软件分析,测定灰度值。目的条带与对应的GAPDH条带的灰度比值为目的蛋白相对表达水平。
1.10流式细胞仪(FCM)检测OB凋亡率 将对数生长期的第3代OB置入10%小牛血清培养基中培养过夜,调节细胞密度至1×106/mL,按实验分组再在含10%胎牛血清的RPMI-1640培养基中共同培育24 h后,收集细胞约5×106个进行如下操作:用Binding Buffer洗1次,室温804.96×g离心10 min,收集细胞;洗涤后用100 μL Binding Buffer重悬细胞,加5 μL Annexin V-FITC,避光孵育20 min,再加10 μL碘化丙啶(PI,浓度为1 mg/mL)室温下避光孵育15 min,Binding Buffer洗涤、重悬,立即上FCM检测,每个样品至少检测5×106个细胞。利用Cell Quest功能软件进行参数获取和数据分析。每组样品重复3次。

2 结 果
2.1OB鉴定及传代 原代BMSCs培养5 d换液后,即可观察到贴壁细胞,细胞形态短小,呈长梭型,细胞之间无突起连接,培养至第10天,细胞明显增多、变长、变大,长梭型形态更加明显,见图1。培养至第14天时,细胞基本铺满皿底,细胞排列呈螺旋状,长梭型。经茜素红染色发现培养14 d后的OB能见到少部分钙离子沉淀结节,ALP染色可发现OB细胞细胞质中有棕褐色颗粒或大片状沉淀物体,显示 ALP 染色阳性,符合OB的特征。
2.2H929细胞上清液中MIP-1α和Scl的水平 按实验分组检测各组H929细胞上清液中MIP-1α和Scl蛋白水平,结果显示,MIP-1α组上清液中的MIP-1α和Scl的水平明显高于对照组(t=6.42、3.56,P=0.000、0.012),MIP-1α-Ab组上清液中的MIP-1α、Scl水平明显低于对照组(t=3.42、2.78P,P=0.001、0.012);而Scl及Scl-Ab组中的MIP-1α水平较对照组增减不明显(t=0.618、0.744,P=0.552、0.474)、Scl水平较对照组增减明显(t=6.97、3.17,P=0.000、0.013),见表1。
2.3各组OB的钙离子沉积结节分析 运用茜素红染色钙离子沉积结节以检测OB外基质成熟情况,按实验分组干预后继续培养至第6天,发现MIP-1α、Scl组较对照组钙离子沉积结节减少(P<0.05)。MIP-1α-Ab、Scl-Ab组钙离子沉积结节较对照组明显增多(P<0.05)。但各组形态变化不显著,见表2、图2。

表1 各组细胞上清液中的MIP-1α、Scl水平
a:P<0.05,b:P<0.01,与对照组比较

A:对照组;B:MIP-1α组;C:Scl组;D:MIP-1α-Ab组;E:Scl-Ab组
图2 不同组OB的钙离子沉积结节(×40)
2.4各组OB的ALP活性 MIP-1α-Ab、Scl-Ab组的OB较对照组细胞生长快,细胞呈长梭形更明显,有的呈纤维样生长,细胞体积增大、而MIP-1α-Ab、Scl-Ab组的OB较对照组生长慢,细胞较短小,有的呈多角形,呈树枝状突起。经ALP 活性检测试剂盒检测后,ALP蛋白表达阳性细胞为细胞质和核均出现棕黑色颗粒。定量检测发现MIP-1α-Ab、Scl-Ab组中OB的ALP的活性明显高于对照组(均P<0.01)。而MIP-1α、Scl组中OB的ALP的活性明显低于对照组(均P<0.01),见表2。
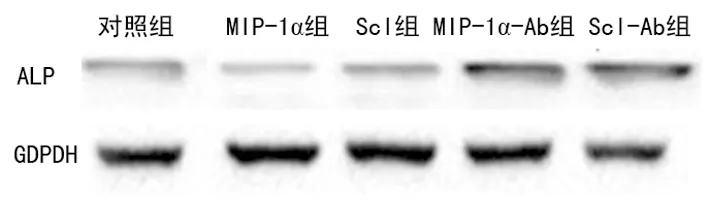
图3 Western blot检测各组OB的ALP蛋白质表达
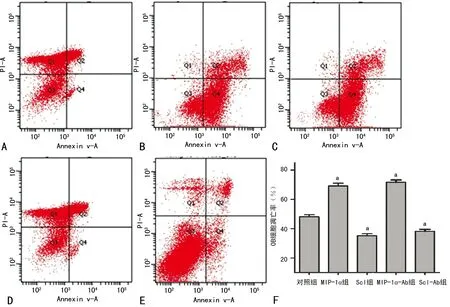
A:对照组;B:MIP-1α组:C Scl组;D:MIP-1α-Ab组;E:Scl-Ab组;F:凋亡率分析;a:P<0.05,与对照组比较
图4 各组OB细胞的凋亡率
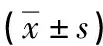
表2 不同组成骨细胞的钙沉积结节
a:P<0.05,b:P<0.01,对照组比较
2.5各组OB的ALP蛋白表达水平 Western blot检测结果进一步发现,培养至第6天发现MIP-1α、Scl组OB中ALP蛋白的灰度值较对照组表达减少,MIP-1α-Ab、Scl-Ab组OB ALP蛋白的灰度值较对照组表达明显增多,见图3。
2.6各组OB的凋亡率 FCM检测显示,MIP-1α、Scl组的OB凋亡率明显高于对照组(t=2.19,P=0.02),MIP-1α-Ab、Scl-Ab组的OB凋亡率明显低于对照组(t=3.12,P<0.01),见图4。
3 讨 论
MBD的发生、发展是多因子、多信号通路相互作用的结果,本团队既往研究发现MIP-1α在MBD的发生、发展中有重要作用,并与Scl具有一定的关联性。但它们之间到底如何影响并不清楚。体外研究发现高表达MIP-1α和Scl的MM细胞株H929,加入MIP-1α试剂后,H929细胞株表达更多的Scl。但当加入Scl后,细胞表达的MIP-1α并不增加,说明MIP-1α可能通过不同方式促进骨髓瘤细胞表达Scl,而Scl并不促进骨髓瘤细胞表达MIP-1α。反之运用同样的方法,在高表达MIP-1α和Scl的H929细胞中加入MIP-1α-Ab中和MIP-1α后,细胞的MIP-1α和Scl水平均下降,而加入Scl-Ab中和Scl后,细胞的MIP-1α水平却并不下降,这说明了抑制MIP-1α表达,也会影响骨髓瘤细胞表达Scl;而抑制骨髓瘤细胞表达Scl,则并不影响骨髓瘤细胞分泌MIP-1α。这也间接说明了骨髓瘤细胞表达Scl可能受MIP-1α调控。
MIP-1α如何促进骨髓瘤细胞分泌Scl,经检索国内外文献均未见明确报到。有研究报道将人骨髓瘤细胞系移植给鼠构建鼠骨髓瘤模型,发现其血浆中鼠源性Scl水平增高,说明Scl可能是由骨髓微环境产生的[9-10]。也可能是在MM患者中,骨髓瘤细胞与局灶的破骨祖细胞直接接触、相互黏附后,通过多种途径促进骨髓瘤细胞表达Scl[11]。也有可能骨髓瘤细胞通过多种途径激活毗邻的破骨祖细胞,局灶增多的破骨细胞(OC)会促进骨细胞分泌Scl增多。还有学者认为Scl是由破骨祖细胞产生的[12],而MIP-1α是一种非常重要的OC激活因子。因而,根据上述实验结果,骨髓瘤细胞通过自分泌或旁分泌途径分泌MIP-1α,当MIP-1α与受体结合后,使核因子κB(NF-κB)受体激动剂配体ligand of receptor activator of nuclear factor kappa B,RANKL)表达增高,增高的RANKL与骨髓巨噬细胞(bone marrow macrophages,BMM)膜上的RANK受体结合,再通过膜内部分特定区域激活下游信号通路,促进BMSCs分化破骨祖细胞增多,导致Scl增多。
Scl是SOST基因精细编码的一种糖蛋白,是骨细胞分泌的重要信号分子,参与骨形成调节,决定骨重建过程中的骨量和结构。在MBD患者BMSCs分化OB的体外实验中,当加入MIP-1α和Scl干预时,OB的凋亡率增加,钙离子沉积及ALP活性均下降;而加入MIP-1α和Scl单抗干预时OB凋亡率则减少,钙离子沉积及ALP的活性则增加,这说明MIP-1α和Scl可能抑制成骨祖细胞向OB分化、增殖,减弱细胞外基质的成熟及矿化作用,促进OB凋亡。结合上述实验可推测MIP-1α抑制OB分化与成熟的机制可能是通过其促进骨髓瘤细胞分泌Scl来实现的。Scl是 Wnt/β-catenin信号通路抑制剂,Scl水平增高可直接减弱骨形态发生蛋白(BMP)的活性,抑制骨细胞的生成[13],Scl还可抑制Fra-1基因表达,抑制转录因子AP-1的活性,从而导致APL、骨钙素(BGP)、Ⅰ型胶原和胶原酶等基因活性下降影响骨基质的形成[14];Scl可直接抑制Wnt/β-catenin及下游的信号通路,导致OB数量下降,骨量降低,细胞外基质成熟障碍、矿化降低。Scl还上调RANKL的表达,增加OC形成,抑制OB的分化成熟。本团队在后续的实验发现,在晚期MBD患者中,骨髓瘤细胞负荷较高时,骨髓瘤细胞分泌的Scl可使RhoA/ROCK1信号途径失活。ROCK1蛋白质序列中含有Erk1/2结合结构域,当Scl抑制ROCK1时,就会暴露Erk1/2,从而启动Bax凋亡通路,促进OC凋亡。从而导致MBD的发生、发展[15]。当加入MIP-1α和Scl单抗时,可能克服骨髓瘤细胞抑制Runx2表达,防止OB和骨细胞凋亡[16];加入单抗后,还可降低骨髓瘤细胞分泌RANKL,直接抑制破骨细胞前体分化,从而潜在地有助于OB的功能恢复[17]。这也间接地说明MIP-1α和Scl可导致MBD的发生发展。
综上所述,MIP-1α可通过促进MM患者的骨髓瘤细胞分泌Scl,Scl通过多种途径抑制MM患者BMSCs向OB的分化、成熟,促进其凋亡,参与MBD的发生发展,MIP-1α和Scl单抗可促进MBD患者OB的功能恢复和数量增加,促进MBD的改善,为MIP-1α和Scl单抗治疗MBD奠定基础,但其详细的作用途径及具体机制有待进一步研究。

