丝素接枝含酪氨酸多肽对其酶促改性的影响
朱雪珂,周步光,王 平,崔 莉,季 吉,王 强,范雪荣
(江南大学 生态纺织教育部重点实验室,江苏 无锡 214122)
京尼平(Genipin,GP)是栀子苷经 β-葡萄糖苷酶水解后的产物,是传统中药杜仲的活性成分之一,是从京尼平苷中分离、提纯而获得的。京尼平属于环烯醚萜类化合物,作为优良的天然交联剂,可以与含游离氨基的高分子(如蛋白质、胶原和壳聚糖等)交联构建生物材料[1-3]。丝素(SF)是一类天然蛋白类高分子,具有良好的机械性能、生物相容性和低免疫原性,在生物医用材料领域得到应用。丝素蛋白由20多种氨基酸组成,尽管其中含酚羟基的酪氨酸残基量接近10%,但由于其包埋在由甘氨酸和丙氨酸组成的疏水链中,在酪氨酸酶催化丝素改性中酪氨酸残基可及度较低,从而影响了丝素酶促改性效率[4-5]。为提高丝素的反应性,可在其表面接枝含酪氨酸的多肽[6-7],其中定制多肽GKGYGGYGK中酪氨酸的含量约为40%,赖氨酸含量约为32%。若借助于生物或化学方法将该多肽接枝到丝素蛋白上,通过提高丝素蛋白上酪氨酸残基的含量,则可提升酪氨酸酶催化丝素接枝伯胺类分子的效率,利于改善丝素蛋白膜的性能。
本文作者借助于生物交联剂京尼平,促使含酪氨酸的多肽在丝素蛋白表面接枝,分析多肽在丝素表面接枝效果及交联机制,探究其对酪氨酸酶催化丝素蛋白接枝聚赖氨酸效果的影响,拓展基于酪氨酸酶法的酶促丝素蛋白改性效果。
1 材料与方法
1.1 实验材料和仪器
桑蚕丝织物(90 g/m2);京尼平(GP,上海宝曼生物技术有限公司);多肽(P,序列为GKGYGGYGK,郑州派和泰德医药科技有限公司);酪氨酸酶(TYR,1070 U/mg, 美 国 Worthington Biochemical Corporation);ε-聚赖氨酸(ε-PL,郑州拜纳福生物工程股份有限公司);无水氯化钙、无水乙醇、冰醋酸、醋酸钠(国药集团化学试剂有限公司)。
UV-1800紫外可见分光光度计(SHIMADZU,日本);高效液相色谱仪(Waters e2695,美国Waters公司);KDII-0.05微机控制万能强力试验机 (深圳市凯强利实验仪器有限公司)。
1.2 实验方法
1.2.1 丝素蛋白溶液的制备将脱胶后桑蚕丝织物以氯化钙-乙醇体系 (摩尔比CaCl2∶CH3CH2OH∶H2O=1∶2∶8)溶解,在 70±2 ℃的水浴锅中搅拌 3 h 后冷却至室温,透析3 d去除盐组分,经离心去除杂质后得到丝素蛋白溶液。
1.2.2 京尼平交联丝素蛋白和多肽以京尼平(4 g/L)在 37℃、pH 6.0条件下处理多肽(1.5 mmol/L)和丝素蛋白溶液(20 g/L),处理时间7 h;对照样不加京尼平或多肽。
1.2.3 丝素蛋白膜的制备将1.2.2节中的反应液倒入聚四氟乙烯模具中,在-20℃下冷冻5 h,再在-50℃的冷冻干燥机中冻干24 h,制得丝素冻干膜;或将反应液在室温条件下风干,制备丝素风干膜。
1.3 测试方法
1.3.1 UV-Vis光谱分析以UV-1800紫外/可见分光光度计测定丝素溶液反应体系的吸光度,记录溶液在400~800 nm范围内溶液吸光度的变化。
1.3.2 SDS-PAGE凝胶电泳取 20 μL样品与 5 μL上样缓冲液(5×)混合均匀,在100℃水浴中沸煮10 min,取5 μL混合液上样到8%~16%梯度胶上,然后在蛋白质凝胶电泳仪上进行实验,浓缩胶阶段电压100 V,分离胶阶段电压为200 V。电泳结束后,以考马斯亮蓝R-250染色,最后进行脱色。
1.3.3 体积排阻色谱(SEC)不同条件下处理样品经离心和过滤后,借助高效液相色谱仪考察其分子量分布变化,实验条件:BioSuite450凝胶色谱柱(7.8 mm ×300 mm,8 μm)、2414 RI Detector、2998 PDA Detector,流量 0.5 mL/min,流动相为 PBS(0.05 mol/L pH=7 磷酸盐缓冲溶液,0.3 mol/L NaCl)。
1.3.4 红外分析采用FTIR光谱仪的ATR模式,在波长范围为4 000~650 cm-1内对不同的冷冻干燥膜样品进行红外光谱分析。扫描次数32次,分辨率4 cm-1。
1.3.5 热重法-微商热重法 (TG-DTG)使用热重分析仪分别测定处理后的丝素膜的TG-DTG。条件为:样品量约为2 mg,升温速度:10℃/min,升温范围:30~500 ℃,N2气氛(高纯 N2,流量为 40 mL/min)。
1.3.6 机械性能的测定使用万能材料试验机对丝素风干膜进行机械性能测试,拉伸速度为40 mm/min,夹距为40mm。测试前样品裁剪成80 mm×5 mm样条,并放在恒温恒湿箱(20℃,RH=65%)中平衡24 h,实验中每个样品进行10次重复试验,样品断裂强度和断裂伸长率分别如下。


1.3.7 丝素膜表面ε-PL接枝率测定溶液中ε-PL浓度测定采用Itzhaki比色法[8]。实验中制作ε-PL与甲基橙吸光度的相关性标准曲线,其中当ε-PL的质量浓度在0~0.1g/L时,其浓度与吸光度A465具有良好的线性关系为

式中:C为ε-PLL的浓度;A为溶液在465 nm处的吸光值。
酶促丝素膜表面接枝ε-PL中,通过分光法测定吸光度,借助于标准曲线计算ε-PL的接枝率。
2 结果与讨论
2.1 京尼平对丝素/多肽体系吸光度的影响
含酪氨酸的多肽分子链上含3个游离氨基,丝素蛋白分子端基及赖氨酸残基中也含有一定量的氨基,GP可与多肽和丝素蛋白分子中的氨基反应,从而形成栀子蓝色素,使反应体系呈蓝色,借助于分光法可了解丝素蛋白的交联效果[9-10]。
利用紫外可见光光谱扫描,检测SF/GP/P体系溶液吸收光谱变化,其中京尼平和氨基酸反应后生成的栀子蓝色素的特征吸收峰在600 nm附近。图1中对照样1、2、3和4溶液均无色,而样品5和6呈蓝色;图2中在600 nm附近出现新的特征吸收峰,与溶液中呈现蓝色相吻合,表明GP的交联作用使得SF+GP和SF+GP+P中均有栀子蓝色素出现。

图1 京尼平反应后丝素/多肽体系溶液的色外观Fig.1 Appearances of fibroin/polypeptide solutions after treated by GP
2.2 京尼平对丝素/多肽体系分子量分布的影响
京尼平可与氨基化合物上的游离氨基反应,或经过自身聚合后再与外源氨基化合物反应,形成分子内或分子间的共价键[11-12]。实验中借助于SDSPAGE、HPLC[13-14]评价京尼平对丝素蛋白分子量的影响,结果如图3和4所示。
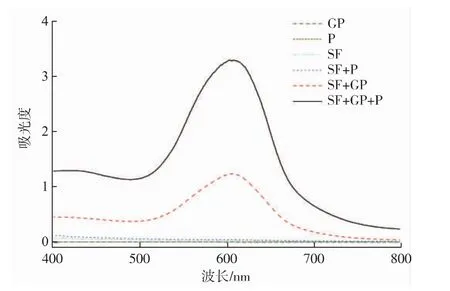
图2 京尼平处理丝素/多肽体系的紫外可见吸收光谱Fig.2 Absorbancesofsilk fibroin and polypeptide solution after GP treatment

图3 京尼平交联后丝素溶液SDS-PAGEFig.3 SDS-PAGEs of fibroin and polypeptide after crosslinking with GP
GP和P的分子量较小(分别为226和885),图3中对应的泳道1和2没有明显谱带;丝素蛋白分子量在几万到几十万的范围内,泳道3没有明显的分子量集中分布谱带;泳道4和泳道3的颜色深浅差别不大,说明在仅丝素蛋白和P存在时,两者间未发生交联反应;泳道5比泳道3的颜色要深一些,说明在GP作用下,丝素蛋白发生了自交联;泳道6比泳道3和5的谱带颜色都深,表明丝素蛋白在GP的作用下除了发生自交联作用外,还存在P接枝到丝素蛋白上,同时P还可能作为桥梁连接丝素蛋白分子,使得溶液中蛋白分子量整体增加。为进一步验证GP促进P接枝丝素蛋白的效果,采用尺寸排阻色谱(Size Exclusion Chromatography,SEC)凝胶柱检测丝素蛋白分子量变化,结果见图4。

图4 京尼平交联丝素蛋白的体积排阻色谱Fig.4 SEC chromatograms of fibroin and polypeptide after incubating with GP
图4 中可以看出,GP(曲线1)和丝素SF(曲线3)最高峰值相应的保留时间分别为24.8 min和27.9 min,P(曲线2)最高峰对应的保留时间约为27 min;GP+SF(曲线 4)比 SF(曲线 3)的出峰时间略有缩短,这是由于GP使SF分子间发生了交联;GP+SF+P(曲线5)的出峰时间比GP+SF(曲线4)有所提前,是因为更多丝素分子间通过P发生交联。图3和图4结果表明,GP可引发丝素蛋白和多肽发生分子内或分子间交联,导致丝素分子量整体增加,这与图1溶液色外观变化、图2的吸光度结果一致。
2.3 京尼平对丝素/多肽结构及结晶度的影响
交联丝素蛋白和多肽的之后,京尼平分子中六元环上的氧原子会被伯氨基的N取代,形成含叔胺N的杂环[1],因此可以通过进行红外光谱分析考察其结构的变化,结果见图4和5。
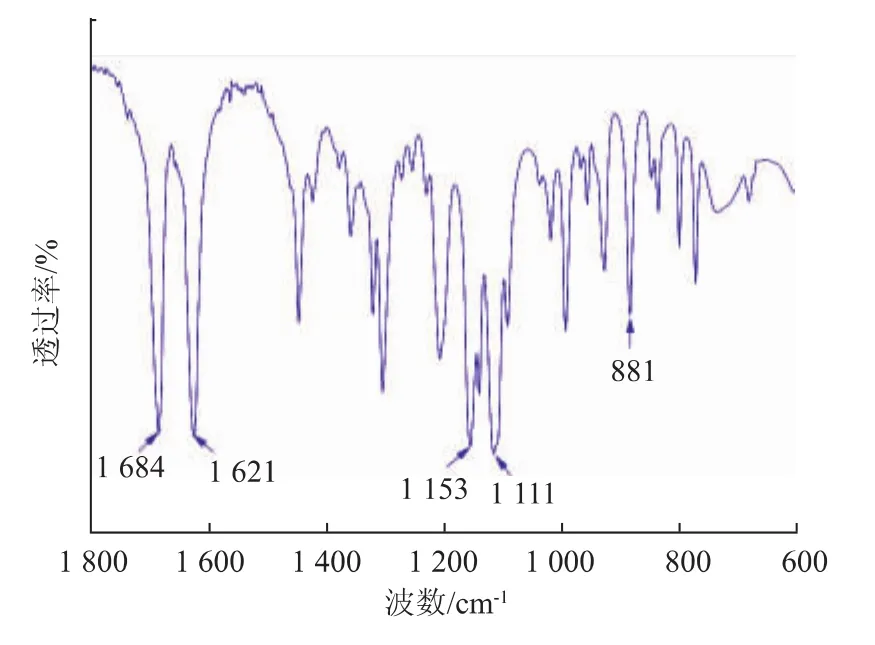
图5 京尼平红外吸收光谱Fig.5 FTIR spectra of GP
由图5可得,京尼平有一些明显特征峰。1 684 cm-1附近的吸收峰为C=O的伸缩振动;1 621 cm-1强吸收峰为烯环上C=C的伸缩振动;1 153 cm-1和1 111 cm-1处的吸收峰是C-O的伸缩振动;881 cm-1附近的吸收峰,被认为是杂环上的C-H的伸缩振动区。京尼平为杂环化合物,含有多个活性基团,可与氨基反应生成深蓝色素,从而起到交联效果[1]。
图6中丝素蛋白在酰胺 I、酰胺 II、酰胺III的峰分别出现在1 641、1 520、1 234 cm-1附近。在1 108 cm-1与887 cm-1波长处出现了新的吸收峰,其中1 108 cm-1代表了C-N伸缩振动,且此N原子是与氨基反应后形成的叔胺N原子,887 cm-1处的特征峰为杂环上C-H伸缩振动,证明了京尼平和丝素或多肽中的-NH2发生了交联作用。曲线d中1 108 cm-1与887 cm-1波长处出现的峰的强度均比曲线c中的高,说明SF+GP+P样品中有更多C-N和C-H,验证了丝素蛋白和多肽间发生交联。考察丝素蛋白接枝多肽膜材料的热学性能,结果见图7。
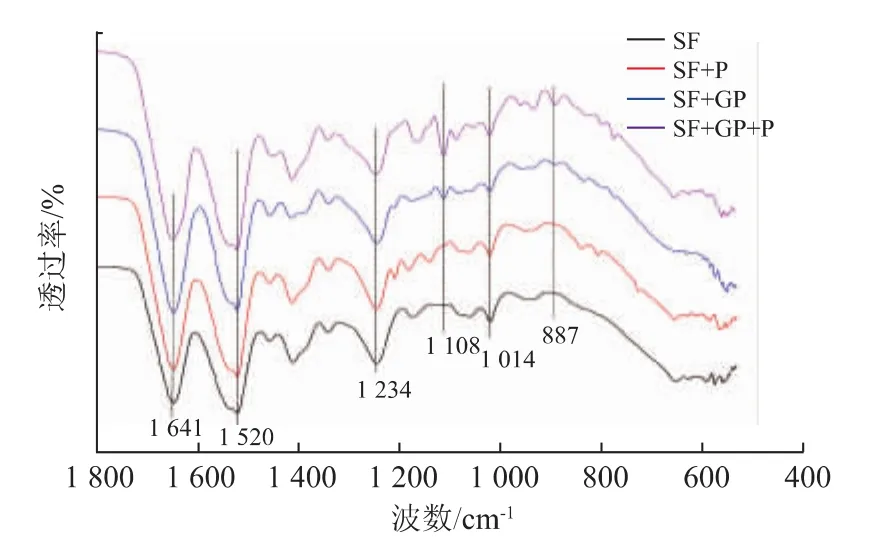
图6 丝素/多肽冻干膜的ATR-FTIR光谱图Fig.6 FTIR spectras of the freeze-dried membranes of fibroin/polypeptide
图7 中改性丝素和空白样的曲线变化情况基本一致,均有两阶段的质量损失。其中,第1阶段的质量损失出现在30~200℃范围内,是因为丝素膜表面或内部自由水蒸发引起;第2阶段在200~500℃,最大分解速率在290℃附近,主要是由大分子熔融降解引起的。SF和SF+P样品的失重温度分别为291.52℃和294.52℃,经GP交联之后,SF+GP和SF+GP+P样品的失重温度有所上升,分别是303.14℃和299.28℃,表明交联后的丝素样品热稳定性提高。加入交联剂后,交联剂分子在相邻大分子间有结合力,结合力使大分子相互靠拢,分子链间作用力增加,排列规整化,使得丝素膜结晶度有所增加,其稳定性也相应增加[13]。SF+GP+P样品失重温度比SF+GP略低,可能是由于部分丝素分子和多肽发生交联,使丝素蛋白自身间交联有所减少所致。
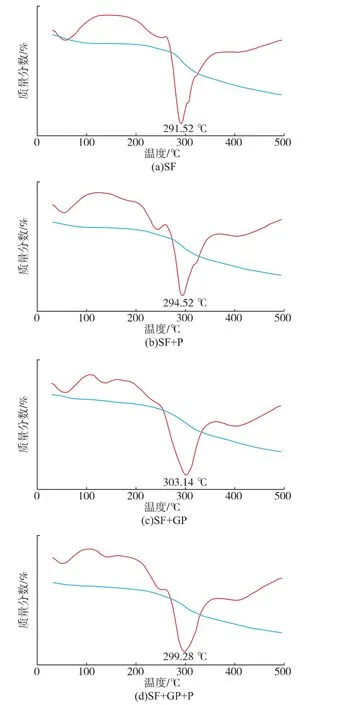
图7 丝素/多肽冻干膜TG/DTG曲线Fig.7 TGA and DTG curves of the freeze-dried membranes of fibroin/polypeptide
2.4 京尼平对丝素/多肽风干膜机械性能的影响
考察京尼平对丝素/多肽膜结构的影响,对比加入0.1%(w/v)甘油条件下丝素/多肽风干膜的断裂强力和断裂伸长率,结果见图8。
从图8中可以看出,京尼平处理后丝素膜材料的拉伸强度略有增加,这是由于丝素蛋白和多肽经京尼平交联后发生分子内或分子间交联,其分子间作用力加强,拉伸强度增加。在受到外力拉伸时,SF+P和SF+GP+P膜中大分子链段间的滑动能力降低,膜材料断裂伸长率略有下降。
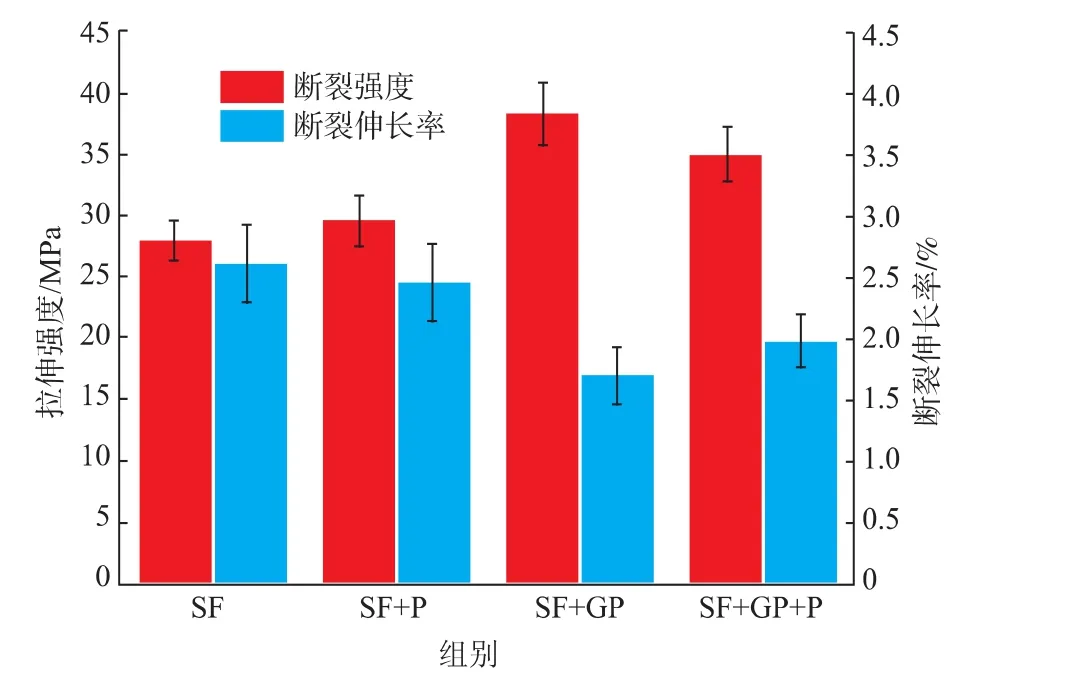
图8 丝素/多肽风干膜的机械性能Fig.8 Mechanical properties of the air-dried fibroin/polypeptide membranes
2.5 丝素接枝多肽对酪氨酸酶催化接枝ε-PL的影响
丝素蛋白接枝含酪氨酸多肽后,其酪氨酸含量增加,有利于提高酪氨酸酶催化氧化丝素产生更多醌类活性基[14-16]。可进一步实现酶促丝素中醌类基团与外源功能性氨基化合物(如壳聚糖等)反应,改善丝素蛋白材料的应用性能[17]。实验中以ε-PL氨基化合物模型物,考察经京尼平改性后丝素膜在酪氨酸酶催化下接枝ε-PL的效果,见图9。

图9 酪氨酸酶催化聚赖氨酸接枝多肽改性丝素膜Fig.9 Tyrosinase-catalysed grafting ε-Poly-L-Lysine on silk fibroin treated by polypeptide
由图 9可知,SF/ε-PL样品的吸附/接枝率为9.54%,其原因是ε-PL含有较多氨基,ε-PL等电点pI在9左右,而丝素蛋白pI为4.2~4.5,两者可依靠库仑力、范德华力或氢键结合,吸附在丝素膜表面。SF/TYR+ε-PL样品中 ε-PL的吸附/接枝率为19.99%,高于SF/ε-PL,表明酪氨酸酶可催化ε-PL接枝丝素。SF+GP+P/TYR+ε-PL上ε-PL的吸附/接枝率为37.43%,高于其他样品,表明丝素接枝含酪氨酸多肽后其反应性增强,酪氨酸酶催化丝素氧化的反应位点增多,因此ε-PL在丝素膜表面的接枝效率提高。
3 结 语
1)京尼平能促进丝素蛋白与含酪氨酸多肽中伯胺基之间反应,引发生成栀子蓝色素;京尼平处理后丝素/多肽体系的蛋白分子量增加,实现了多肽在丝素蛋白表面的接枝。
2)含酪氨酸多肽和丝素交联后,不仅使丝素膜材料的热稳定性提高,也在一定程度上增加了丝素蛋白膜材料的机械性能。
3)多肽在丝素蛋白分子表面接枝后,使得丝素蛋白中酪氨酸含量增加,提高了酪氨酸酶催化ε-PL在丝素表面的接枝效果,验证了通过接枝含酪氨酸多肽可提高丝素的酶促反应性。

