不同粒径大小的甘露糖修饰聚合物胶束制备及其靶向药物输送应用
汪家伟 ,张 权 ,2,叶 舟 ,崔晨宇 ,尹 健 *,2
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡214122)
癌症是目前人类面临的最大健康难题,据世界卫生组织(WHO)预计,2030年全世界将会有约1 200万人死于癌症。在近五十年的癌症治疗史上,化疗已然成为最有效的手段之一,在临床研究中涌现出了500多种抗癌药物,但是癌症的死亡率仍然高达20.2%。其中,主要原因在于抗癌药物的毒副作用以及癌细胞的多药耐药性[1-2]。因此,如何提高药物的疗效并减少毒副作用,以及克服癌细胞的耐药性一直是研究者亟需解决的问题。近年来,科研人员将飞速发展的纳米技术与传统化疗创造性的结合,设计出了新型的靶向给药系统,为癌症的治愈带来了光明的前景。目前,用于新型靶向给药输送的纳米载体种类繁多,应用较为广泛的主要有聚合物胶束[3-4]、脂质体[5]、树枝状大分子[6]和介孔硅纳米粒子[7-8]等。
利用聚合物胶束为药物载体输送抗癌药物,以提高药物的靶向性和克服癌细胞的耐药性已经引起了广大科研工作者的关注[9-10]。聚合物胶束主要通过两亲性分子的自组装而得到,形成亲水外壳和疏水空腔的结构,其疏水空腔为难溶性药物提供了一个良好的载药环境。在体内,聚合物胶束具有良好的稳定性和生物相容性,并能通过增强渗透与滞留(EPR)效应实现肿瘤的被动靶向,提高疏水药物的生物利用度。载药聚合物胶束通过EPR效应到达肿瘤区域的过程中,为了不被体内的免疫系统所识别而被快速清除,延长载药胶束在血液中的长时间循环,其中,胶束尺寸至关重要。一般肿瘤血管的孔洞直径小于400 nm,体内的肾脏会清除10 nm以下及肝脏会清除100 nm以上的纳米颗粒,所以制备聚合物胶束直径的合适尺寸为10~100 nm。另外,针对不同肿瘤,不同尺寸的载药胶束穿透能力差别很大,从而对治疗效果造成很大影响[11]。因此,制备粒径可调控的聚合物胶束有助于最大限度地发挥纳米载体的EPR效应,从而提高药物载体对肿瘤组织的被动靶向功能。
在聚合物胶束表面引入对癌细胞具有特异性识别作用的功能配体,如叶酸[12]、促黄体生成素释放激素[13]、多肽[14]、抗体[15]等,通过配体-受体介导的内吞作用可以有效提高癌细胞对于载药胶束的摄取。近年来,利用某些肿瘤细胞表面存在着高表达的甘露糖受体,在纳米载体表面修饰上甘露糖分子,通过受体与甘露糖分子的特异性识别,以实现抗癌药物的靶向输送,已经得到证明[16-17]。但是,在两亲性聚合物胶束上引入甘露糖分子,以实现癌细胞的靶向药物输送的研究却鲜有报道。
本文作者通过原子转移自由基聚合(ATRP)以及"click"反应合成了具有不同嵌段比的甘露糖修饰的两亲性聚合物,采用核磁共振氢谱(1H-NMR)、透射电镜(TEM)、动态光散射(DLS)等表征手段,确认分子结构并考察不同嵌段比聚合物形成胶束的形貌和粒径变化情况。同时,以阿霉素为模型药物,通过细胞实验研究甘露糖修饰的载药胶束对人乳腺癌细胞MDA-MB-231的抑制作用,并考察其对正常细胞HEK293的毒性。
1 材料与方法
1.1 主要试剂
丙烯酸(分析纯)、2,2-二甲基-1,3-二氧戊烷-4-甲醇(Solketal,99%)、1,1,4,7,7-五甲基-二乙烯基三胺 (PMDETA,99%)、甲基丙烯酸缩水甘油酯(GMA,97%)、 三氟甲磺酸三甲基硅酯(TMSOTf,99%)、2,2'-联吡啶 (Bpy,99%)、 苯甲酰氯 (分析纯)、(+)-L-抗坏血酸钠(99%)、五水硫酸铜(98%)、2-溴丙酸甲酯(MBrP,99%)均于百灵威科技有限公司购买;D-甘露糖(D-Mannose,分析纯)、盐酸阿霉素(DOX·HCl,99%)分别购于国药集团化学试剂有限公司与北京华奉联博科技有限公司。
1.2 主要仪器
AVANCE 400M型核磁共振仪,德国Bruker公司;Nexus 470红外光谱仪,美国Nicolet公司;Nano ZS动态光散射仪(DLS),英国 Malvern公司;JEM-2 100透射电子显微镜(TEM),日本电子株式会社;激光共聚焦显微镜(CLSM),日本尼康株式会社。
1.3 PSA-b-PGMA-Mannose聚合物胶束的制备合成
1.3.1 炔丙基-α-D-吡喃甘露糖的合成按照文献[18]制备炔丙基-α-D-吡喃甘露糖。
1.3.2 单体甲基丙烯酸丙酮缩甘油酯(SA)的合成按照文献 [19]制备单体甲基丙烯酸丙酮缩甘油酯(SA)。
1.3.3 PSA-b-PGMA-Mannose的合成 将3.4 g单体SA溶解于1.7 mL的环己酮中,通入氩气15 min,以保证瓶内的无氧环境,依次加入130.4 mg CuBr、189.6 μL PMDETA,密封烧瓶,在氩气的保护下,向瓶中注入101.2 μL的引发剂MBrP,在90℃油浴下反应13 h。反应结束后,向瓶中加入THF10 mL以终止反应,并置于空气中搅拌1 h。将瓶内混合液通过中性氧化铝柱,收集所得浅色液体,旋转蒸发除去溶剂,将瓶内粘稠液体逐滴加于正己烷中沉淀,反复三次,将所得沉淀干燥即可得聚甲基丙烯酸缩丙酮甘油酯(PSA)。
将2 g的PSA溶解于1.4 mL的二甲亚砜中,通入氩气15 min,以保证瓶内的无氧环境,依次加入56.4 mg CuBr,2.8 g GMA 和 83 μL PMDETA, 密封烧瓶,在氩气的保护下,40℃油浴下反应3 h。反应结束后,向瓶中加入THF 10 mL以终止反应,并置于空气中搅拌1 h。将瓶内混合液通过中性氧化铝柱,收集所得液体,旋转蒸发除去溶剂,将瓶内粘稠液体逐滴加于正己烷中沉淀,反复三次,将所得沉淀干燥即可得产物PSA-b-PGMA。保持PSA当量不变,调节反应中单体GMA的当量,即n(PSA)∶n(GMA)=1∶50,1∶90,1∶120,1∶150 合成具有不同嵌段比的聚合物。
将200 mg PSA-b-PGMA溶解于4.5 mL N,N’-二甲基甲酰胺中,依次加入46.8 mg叠氮化钠和38 mg氯化铵,在50℃油浴下反应12 h。反应结束,将瓶内溶液过滤,旋转蒸发除去溶剂,将瓶内粘稠液体加入水中沉淀,反复三次,将所得沉淀干燥即得产物PSA-b-PGMA-N3。
取烧瓶1,称取50 mg PSA-b-PGMA-N3加入其中,再加入2 mL DMF进行溶解,通入15 min氩气。另取烧瓶2,依次将44 mg炔丙基-α-D-吡喃甘露糖、50 mg五水硫酸铜晶体以及86 mg(+)-L-抗坏血酸钠加入其中,用1.5 mL蒸馏水进行溶解,向瓶内通入15 min氩气。充分溶解后,将烧瓶2内水溶液缓慢滴加到烧瓶1中,搅拌,继续通入氩气10 min,密封烧瓶,在油浴70℃反应2 d。过滤反应液,在透析袋(MW10000)中透析3 d,每4 h换一次水,冷冻干燥透析袋内溶液,得到目标产物PSA-b-PGMA-Mannose。
1.4 载药聚合物胶束的制备
将50 mg盐酸阿霉素和3当量的三乙胺溶解在10 mL蒸馏水中,室温下搅拌4 h,期间严格避光,用二氯甲烷进行萃取(20mL×3),旋转蒸发除去溶剂,真空干燥12 h后即得脱盐后的阿霉素(DOX)。取4 mg脱盐DOX溶解在4 mL DMSO中,静置后经0.45 μm滤膜过滤待用。另将PSA-b-PGMA-Mannose溶解在5 mL DMSO中,并用0.45 μm滤膜过滤待用。
分别取适量上述待用溶液混合搅拌,并逐滴加入磷酸盐缓冲液(PBS,pH 7.4)8 mL,搅拌 1 h。 随后将混合液移至透析袋(MW10000)中,在同样的PBS体系中透析3 d,每隔4 h换一次水,最后将透析袋内溶液冷冻干燥3 d,即得到负载阿霉素的聚合物胶束(DOX@PSA-b-PGMA-Mannose)。
1.5 载药胶束的细胞内吞
将对数期生长的MDA-MB-231和HEK293两种细胞分别在培养皿中接种,贴壁后,加入40 μg/mL的DOX@PSA-b-PGMA-Mannose溶液再培养,一天后,移去培养液,并用PBS溶液清洗2次。然后,进行细胞的固定染色,具体操作:用1 mL 4.0%甲醛溶液固定细胞20 min。再用染料DAPI染色细胞核20 min[20]。在激光共聚焦显微镜下观察DOX@PSA-b-PGMAMannose载药胶束在两种细胞内部的分布情况,设置405/561为激发波长,发射波长则设置为417-477/570-1 000。
对MDA-MB-231的甘露糖封堵试验,即提前将5 mg/mL浓度的甘露糖水溶液与细胞共同培养4 h,然后再加入载药胶束共同培养,接下来的操作与上述一样。
1.6 细胞毒性评价
采用MTT法考察DOX@PSA-b-PGMAMannose载药胶束对的MDA-MB-231和HEK293两种细胞的细胞毒性[21]。将两种细胞以10000/孔接种在96孔板中,培养一段时间后,将载药胶束DOX@PSA-b-PGMA-Mannose或原药DOX的血清培养基加入孔板中共培养,两天后,移去孔中培养液,并以PBS清洗2次,然后,将100 μL MTT溶液(1 mg/mL)更换为 100 μL DMSO,摇床震荡 15 min。在酶标仪上测定波长490 nm处的吸光度值(OD)。
2 结果与分析
2.1 两亲性嵌段聚合物PSA-b-PGMA-Mannose的合成
两亲性嵌段聚合物PSA-b-PGMA-Mannose的合成示意图,如图1所示。以MBrP引发SA聚合,得到聚合物PSA;再以聚合物PSA引发不同反应当量的GMA聚合,得到不同嵌段比例的聚合物PSA-b-PGMA,通过核磁氢谱计算得到的聚合物分别为PSA30-b-PGMA23,PSA30-b-PGMA45,PSA30-b-PGMA90,PSA30-b-PGMA115,其中 PSA30-b-PGMA45核磁氢谱见图2(a)。合成的PSA-b-PGMA中存在的环氧基团易和叠氮化钠进行开环反应,从而在聚合物上引入叠氮基团,得到PSA-b-PGMA-N3。利用“click”反应,在叠氮基修饰的两嵌段聚合物上成功引入甘露糖分子,即得到PSA-b-PGMA-Mannose,核磁结果如图2(b),其中,在8.17 ppm处出现了三氮唑氢的特征峰,标志着“click”反应的成功。

图1 两亲性嵌段聚合物PSA-b-PGMA-Mannose的合成示意图Fig.1 Synthetic route of the PSA-b-PGMA-Mannose
2.2 嵌段聚合物的红外光谱分析
依次分别将聚合物PSA30-b-PGMA23、PSA30-b-PGMA23-N3以及PSA30-b-PGMA23-Mannose干燥粉末1 mg和无水溴化钾100 mg混合,充分研磨后压片,在4 000~400 cm-1进行扫描[22],结果如图3所示。可以看到在1 720 cm-1处PSA30-b-PGMA23光谱有较强的C=O峰;当引入叠氮基团后,图3中B曲线中,在2 106 cm-1处出现了叠氮基团特征峰;而当PSA30-b-PGMA23-N3与炔丙基-α-D-吡喃甘露糖反应后,叠氮基团特征峰的消失,验证了“click”反应的发生以及甘露糖的成功修饰(图3中C曲线)。
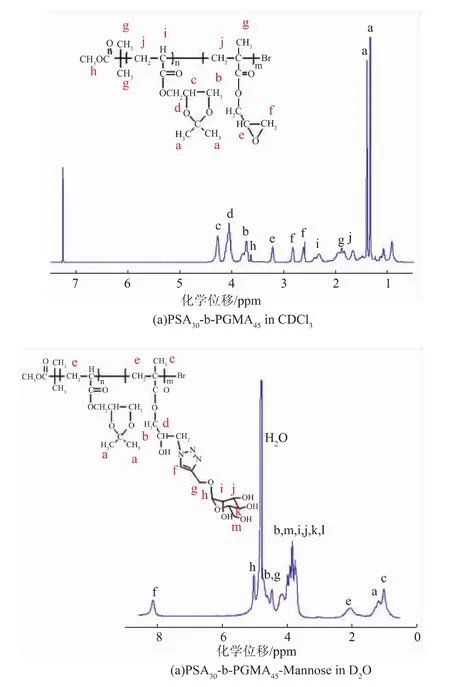
图2 嵌段聚合物的核磁共振1HNMR谱图Fig.2 1HNMR spectra of the polymers
2.3 不同嵌段聚合物胶束的TEM与DLS表征
通过DLS测定不同嵌段比例胶束的流体力学直径,并且观察它们粒径之间的变化趋势,结果见图4。实验结果发现,4种不同嵌段比的胶束平均粒径分别为255,105,78,24 nm。可以发现随着亲水嵌段的比例增大,胶束的粒径减小。选取空白胶束PSA30-b-PGAM115-Mannose,当其负载DOX后,平均流体力学直径由24 nm增大为97 nm(图5)。

图3 嵌段聚合物的红外光谱Fig.3 FT-IR spectra of the polymers
通过TEM观察不同嵌段比例胶束的形貌,结果见图6,实验结果表明胶束呈球形,粒径分散均匀,分散性较好,而且和DLS测定的结果相似,随着亲水嵌段比例的增大,电镜图中的胶束粒径越来越小。根据文献[11],通常聚合物胶束粒径在50~100 nm之间时,其在体内具有显著的EPR效应,有利于在肿瘤部位的富集。故接下来的体外药物释放和细胞水平实验,选取平均粒径为78 nm的PSA30-b-PGMA90-Mannose作为药物载体进行评价。

图4 空白胶束在水溶液中的流体力学直径分布Fig.4 Diameter and distribution of the blank micelles
2.4 体外药物释放研究
通过分光光度计法可测得,载药胶束DOX@PSA30-b-PGMA90-Mannose的载药量为11%,包封率为22%。根据文献报道,肿瘤组织微环境的pH值比正常组织低,当载药胶束在血液(pH 7.4)循环时释放药物量较低,而在肿瘤处快速释放大量药物,可以使药物选择性地在肿瘤组织发挥药效,并减轻对正常组织的毒副作用。因此,本文选择了pH 7.4和pH 3.5两种释放介质以探究我们设计的聚合物胶束是否具有pH敏感性和缓释性能。取载药胶束DOX@PSA30-b-PGMA90-Mannose 1 mL,转移至透析管中,在 37℃,25 mL的pH 7.4和pH 3.5缓冲液中分别测定DOX的药物体外释放,实验全程避光。将烧杯置于恒温震荡培养箱中,设置恒定温度为37℃,振荡频率为100 r/min。每隔一段时间吸取1 mL释放介质,平行实验3次,计算累积药物释放率,同时补加相同体积的介质。实验结果如图7所示,在pH 3.5的介质中,药物释放速度以及累计释放率均高于在pH 7.4介质中的释放。在pH 3.5的介质中,48 h累积释放率可达到74.6%。实验结果说明,作者设计的聚合物胶束显示出了较好的pH敏感性和药物缓释性能,能够很好地响应肿瘤组织的微环境而释放药物,从而减少对正常组织的毒副作用并增强治疗效果。
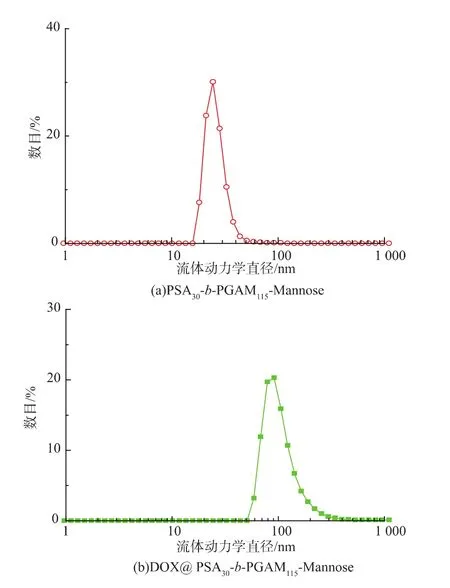
图5 空白胶束PSA30-b-PGAM115-Mannose载药前后在水溶液中的流体力学直径分布Fig.5 Diameter and distribution of the micelles

图6 空白胶束的透射电镜照片Fig.6 TEM images of the blank micelles
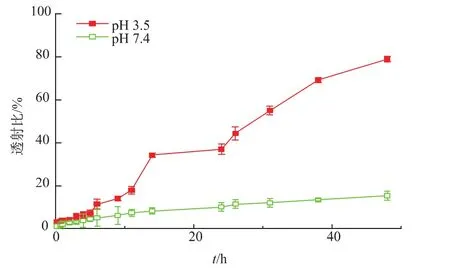
图7 负载阿霉素的载药胶束分别在pH 7.4和pH 3.5条件下的药物释放情况Fig.7 DOX release profile from DOX@PSA30-b-PGMA90-Mannose at pH 7.4 and pH 3.5,respectively
2.5 载药聚合物胶束细胞内吞及摄取研究
选取载药胶束DOX@PSA30-b-PGMA90-Mannose,通过激光共聚焦显微镜考察甘露糖受体介导的细胞内吞作用,其结果见图8。分别以MDAMB-231癌细胞和HEK293正常细胞为细胞模型,其中仅癌细胞表面具有高表达的甘露糖受体,将载药胶束DOX@PSA30-b-PGMA90-Mannose与细胞分别进行培养;另外,将MDA-MB-231癌细胞提前进行甘露糖封堵,再与载药胶束DOX@PSA30-b-PGMA90-Mannose进行培养。在图8(a)中可以看到,在癌细胞MDA-MB-231内出现较高强度的由DOX发出的红色荧光,该现象可以说明载药胶束DOX@PSA30-b-PGMA90-Mannose已被癌细胞大量摄取。而由图8(b)可知,经过甘露糖封堵的MDA-MB-231癌细胞,由于MDA-MB-231细胞表面的甘露糖受体提前与甘露糖结合,所以再跟载药胶束进行培养的时候,癌细胞表面几乎没有未被甘露糖封堵的甘露糖受体,所以摄取载药胶束的能力极差,和未封堵的癌细胞有非常明显的差异。由图8(c)对于甘露糖受体低表达的HEK293细胞,细胞内红色荧光强度同样很低,说明几乎没有载药胶束被摄入HEK293细胞内。上述实验结果说明,我们所制备的甘露糖修饰的胶束具有良好的靶向性,可以被癌细胞表面的甘露糖受体特异性识别,通过内吞进入癌细胞内,然后药物释放发挥药效,抑制癌细胞的生长;同时减少了载药胶束被正常细胞识别内吞,从而降低抗癌药物的毒副作用。
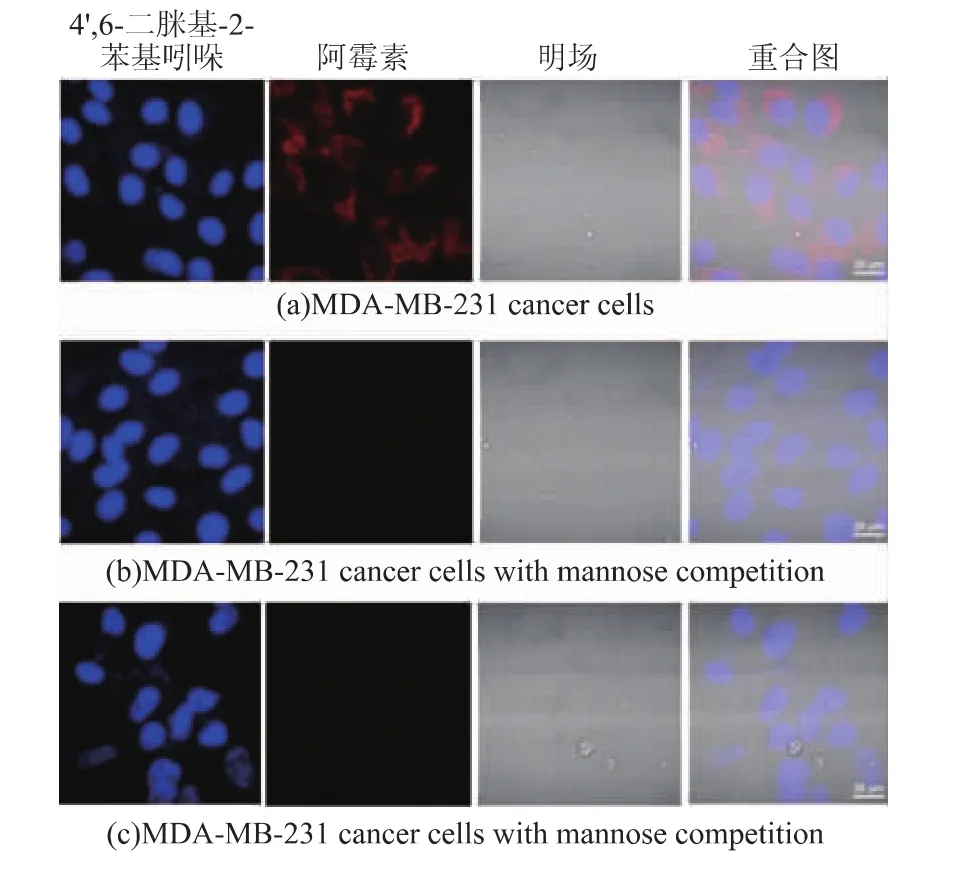
图8 MDA-MB-231细胞,甘露糖封堵的MDA-MB-231细胞和HEK-293细胞分别对DOX@PSA30-b-PGMA90-Mannose的摄取情况Fig.8 Celluar uptake of DOX@PSA30-b-PGMA90-Mannose
2.6 空白胶束和载药胶束的细胞毒性评价
选取空白胶束 PSA30-b-PGMA90-Mannose,实验采用MTT法考察其对两种细胞的毒性。配制5种浓度的空白胶束:0,25,50,100,200,500 μg/mL,分别与两种细胞培养两天,统计细胞存活率,结果如图9所示。实验结果表明,当空白胶束浓度增加到500 μg/mL时,两种细胞存活率依然高达80%~90%,证明该空白胶束具有较好的生物相容性。
同样采用MTT法评价载药胶束DOX@PSA30-b-PGMA90-Mannose对两种细胞的细胞毒性情况,并以等量的DOX作为对比,结果如图10。由图10(a)所示,对于癌细胞,载药胶束DOX@PSA30-b-PGMA90-Mannose具有比DOX更强的细胞毒性;而由图10(b)可知,对于正常细胞,载药胶束具有比DOX较低的细胞毒性。这是因为甘露糖修饰的载药胶束能够特异性识别癌细胞表面高表达的甘露糖受体,并被内吞进入癌细胞;而低表达甘露糖受体的HEK293细胞无法识别甘露糖修饰的载药胶束,所以内吞摄取载药胶束的能力很低。

图9 空白胶束对MDA-MB-231以及HEK293的细胞毒性Fig.9 Cytotoxicity of PSA30-b-PGMA90-Mannose against MDA-MB-231and HEK-293 cells

图10 载药胶束对MDA-MB-231和HEK-293的细胞毒性Fig.10 Cytotoxicity of DOX@PSA30-b-PGMA90-Mannose against MDA-MB-231 and HEK-293cells
3 结 语
本论文合成了不同亲疏水嵌段比例的聚合物PSA-b-PGMA-Mannose,并利用这些嵌段聚合物制备胶束,研究胶束的形貌及粒径变化情况,发现随着亲水嵌段的比例增加,胶束的流体力学直径变小。选取胶束PSA30-b-PGMA90-Mannose,以阿霉素DOX作为疏水药物,利用嵌段聚合物的疏水链段所形成的空腔包裹药物DOX制备了载药聚合物胶束DOX@PSA30-b-PGMA90-Mannose。研究其体外药物释放情况,并考察其对乳腺癌细胞MDA-MB-231的抑制效果。结果显示,载药胶束能够被甘露糖受体特异性识别而内吞进入细胞内,并释放药物。本文制备的载药胶束对癌细胞,具有比原药DOX更高的细胞毒性,而毒副作用较低。因此,我们制备的聚合物胶束作为一种新型药物载体有望应用于靶向治疗癌症。

