石榴皮多酚对胆固醇流出及相关蛋白表达的影响
赵胜娟 向进乐 陈树兴费 鹏 徐云凤 李建科
(1. 陕西师范大学食品工程与营养科学学院,陕西 西安 710119;2. 河南科技大学食品与生物工程学院,河南 洛阳 471023)
胆固醇代谢有着严格的调控机制,在正常情况下,细胞内的胆固醇代谢保持着动态平衡,该平衡一旦打破会导致机体病变,因此维持机体细胞内胆固醇的动态平衡至关重要[1-2]。当机体内皮细胞受到外界刺激发生损伤时,巨噬细胞对胆固醇的摄入不受细胞内胆固醇含量负反馈机制的调节,进而会打破巨噬细胞内胆固醇的平衡,在细胞内形成大量脂滴,直至巨噬细胞发生泡沫化,导致动脉粥样硬化(atherosclerosis,AS)的发生,严重地危害人们的健康[3-4]。
石榴皮多酚(pomegranate peel polyphenols,PPPs)是石榴中重要的活性成分,具有抗氧化、抗癌、抗菌、降血脂等多种生物学功能[5]。研究[6-7]表明PPPs可以降低巨噬细胞胆固醇和氧化脂质的积累,以抑制泡沫细胞的形成,从而减少AS及心血管疾病的发生,然而,石榴多酚抑制泡沫细胞形成的机制尚不完全清楚。促进巨噬细胞胆固醇流出对减少细胞内脂滴形成、防止巨噬细胞泡沫化和AS发生具有重要意义,已经成为了研究减缓或防止AS发生的一个新靶点[8]。现有研究[9-11]表明,清道夫受体 B1(Scavenger receptor B1,SR-B1)、酰基辅酶A:胆固醇酰基转移酶(acyl-coenzyme A1: cholesterol acyltransferase,ACAT1)和胆固醇酯水解酶(cholesteryl ester hydrolase,nCEH)与机体胆固醇的流出密切相关。SR-B1是重要的抗AS受体,参与胆固醇酯的逆转运,能够有效地促进胆固醇的流出[12]。ACAT1和nCEH是调节机体内胆固醇平衡代谢的关键蛋白[10],能够维持细胞中游离胆固醇(free cholesterol,FC)的浓度,促进胆固醇的流出。因此,分析PPPs对SR-B1、ACAT1和nCEH蛋白表达调控作用对解释该物质促进胆固醇流出的作用机制至关重要。
本试验拟以PPPs为研究对象,构建Raw264.7巨噬细胞源性泡沫细胞模型,探索PPPs对SR-B1及胆固醇平衡代谢关键蛋白酶(SR-B1、ACAT1和nCEH)表达的影响,分析在PPPs作用下ACAT1和nCEH酶活性的变化,为揭示PPPs促进胆固醇流出及抑制泡沫细胞形成的机制提供理论依据。
1 材料与方法
1.1 材料
PPPs:紫外检测多酚含量为60%,主要成分为鞣花酸、没食子酸和安石榴苷,在浓度为0~50 μg/mL时对巨噬细胞无毒性[13],陕西天地源生物科技有限公司;
Raw264.7小鼠巨噬细胞:陕西师范大学食品营养与安全实验室保存;
胆固醇测定试剂盒:北京普利来基因技术有限公司;
ox-LDL、高密度脂蛋白(High density lipoprotein,HDL):广州奕源生物公司;
DMEM无酚红基础培养基:美国Hyclone公司;
胎牛血清:Gibco 10099-141,美国Gibco| Life Technologies公司;
ACAT1(BS8471):美国Bioworld Technology公司;
nCEH(ab111544)抗体、SR-B1抗体(ab52629):英国Abcam公司;
ACAT1、nCEH的ELISA试剂盒:上海酶联生物技术有限公司。
1.2 仪器
普通倒置显微镜:OLYMPUS CKX41型,日本OLYMPUS公司;
全波长酶标仪:Multiskan GO型,美国热电公司;
生物柜:ESCO AC2-4S1型,新加坡 ESCO有限公司;
脱色摇床:WD-9405A型,北京六一仪器厂;
暗匣:AX-Ⅱ型,广东粤华医疗器械厂有限公司;
电泳仪:DYY-6C型,北京六一仪器厂。
1.3 方法
1.3.1 Raw264.7巨噬细胞源性泡沫细胞模型的建立
收集对数生长期的小鼠巨噬细胞Raw264.7,调整到适宜浓度,接种于12孔板,正常培养24 h后,更换无血清培养基继续培养12 h,使细胞同步化,然后分为正常对照组,泡沫细胞模型组(Ox-LDL)组,正常对照组更换新鲜培养基,泡沫细胞组加入含60 μg/mL Ox-LDL的培养基。继续培养24 h,弃培养基用PBS清洗2次,然后对细胞进行油红O染色,测定其游离胆固醇和总胆固醇[14]。
1.3.2 石榴皮多酚对HDL介导的巨噬细胞胆固醇流出的影响 收集对数生长期的小鼠巨噬细胞Raw264.7,调整到适宜浓度,接种于96孔板,正常培养24 h后,细胞用PBS清洗2次,更换无血清培养基,并分成4组(对照和药物处理组),具体分组情况见表1,药物组加入各浓度PPPs对细胞进行预处理,1 h后加入ox-LDL(终浓度为60 μg/mL),再继续培养24 h,之后更换含HDL(50 μg/mL)的无血清无酚红培养基继续培养,24 h后收集细胞液,4 ℃、10 000 r/min离心5 min,然后用胆固醇测定试剂盒测定上清胆固醇含量。

表1 细胞处理分组
1.3.3 Western blotting法检测SR-B1、ACAT1和nCEH的蛋白表达 不同浓度PPPs预处理Raw264.7细胞1 h后,加入Ox-LDL共同作用泡沫细胞24 h后,收集细胞,确定蛋白浓度,然后将相同量的各蛋白样品加入准备好的各电泳孔中进行10% SDS-PAGE电泳,然后将胶片转膜至PVDF膜,用5%脱脂乳进行封闭,再用滤纸吸干封闭液,加入稀释好的一抗(ACAT1抗体,nCEH抗体,SR-B1抗体)孵育过夜,然后与二抗孵育,结束后进行ECL显色,并用Quantity-one软件处理[15]。
1.3.4 细胞ACAT1和nCEH酶活性的检测 不同浓度PPPs预处理Raw264.7细胞1 h后,加入Ox-LDL共同作用泡沫细胞24 h后,收集细胞,然后采用 ELISA试剂盒检测ACAT1和nCEH的酶活力。
1.4 数据处理
所得数据采用均数±标准差表示,用 SPSS13.0软件分析,差异显著性检验采用单因素方差分析,并用 Duncan 法进行多重比较,P<0.05 为差异显著,P<0.01差异极显著,表示差异具有统计学意义。
2 结果与分析
2.1 Raw264.7巨噬细胞源性泡沫细胞模型的建立
由表2和图1可知,总胆固醇、游离胆固醇和胆固醇酯含量均明显增加,总胆固醇增加了近2倍,细胞内胆固醇酯占总胆固醇的比例(CE/TC)>50%,表示泡沫细胞模型建立成功[16]。油红O染色结果显示,巨噬细胞内无明显红色脂滴,而泡沫细胞内有大量红色脂滴存在,进一步显示泡沫细胞模型构建成功。
2.2 石榴皮多酚对HDL介导的巨噬细胞胆固醇流出的影响
图2显示,随着PPPs浓度的增加,HDL介导的总胆固醇流出量也呈递增趋势,呈现一定的剂量效应关系,但5,25 μg/mL 剂量均未能达到差异显著性,50 μg/mL剂量则极显著增加了胆固醇流出量,增加量达50%以上。
2.3 石榴皮多酚对Raw264.7细胞SR-B1蛋白表达的影响
由图3可知,Raw264.7细胞SR-B1蛋白的表达受到了PPPs影响,且当PPPs浓度为25 μg/mL时调控作用最显著。利用Quantity-one软件对SDS-PAGE图谱进行量化,如图4所示,当PPPs的剂量为25,50 μg/mL时,SR-B1蛋白的表达量显著上调(P<0.01),且以25 μg/mL剂量对SR-B1的上调作用最强。但PPPs对SR-B1蛋白表达的影响并未呈现良好的剂量关系。

表2 细胞泡沫化程度
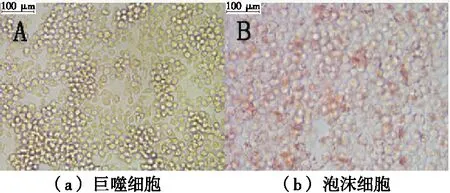
图1 巨噬细胞和泡沫细胞油红O染色图Figure 1 Macrophage and foam cell oil red O
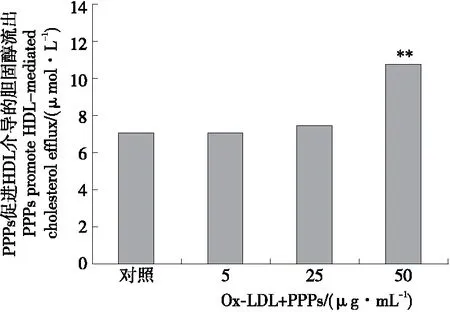
**表示与对照相比差异极显著(P<0.01)
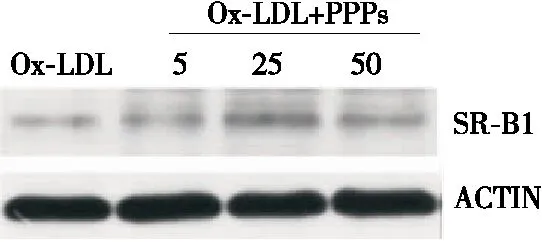
图3 不同浓度PPPs作用下SR-B1受体表达图谱
Figure 3 The expression pattern of SR-B1 receptor after treatments with different concentrations of PPPs
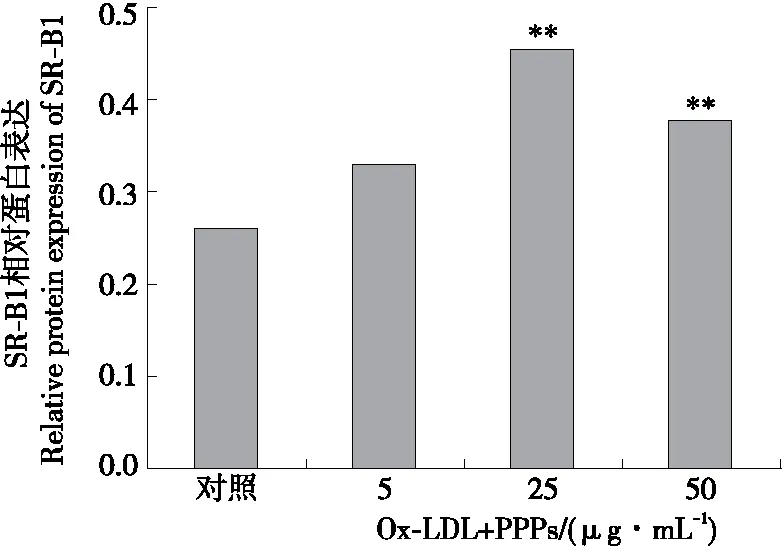
**表示与对照相比差异极显著(P<0.01)
Figure 4 Effect of PPPS on the protein expression of SR-B1 in Raw264.7 Macrophages (n=3)
2.4 石榴皮多酚对Raw264.7细胞ACAT1和nCEH蛋白表达的影响
由图5可知,PPPs处理组对Raw264.7细胞ACAT1和nCEH蛋白的表达无显著影响。利用Quantity-one软件量化后的结果(图6),表明PPPs对Raw264.7细胞ACAT1和nCEH蛋白表达的作用不显著(P>0.05)。
2.5 石榴皮多酚对Raw264.7细胞ACAT1和nCEH活性的影响
PPPs对Raw264.7细胞ACAT1和nCEH活性的影响见表3。在不同剂量PPPs受试物处理下,PPPs各剂量组显著降低了ACAT1活性(P<0.01),而显著升高了nCEH活性(P<0.01)。说明PPPs可以减少胆固醇酯化,减少泡沫细胞内的脂滴。同时PPPs可以促进胆固醇酯水解,使胆固醇变为游离胆固醇,对促进胆固醇的流出具有积极意义。
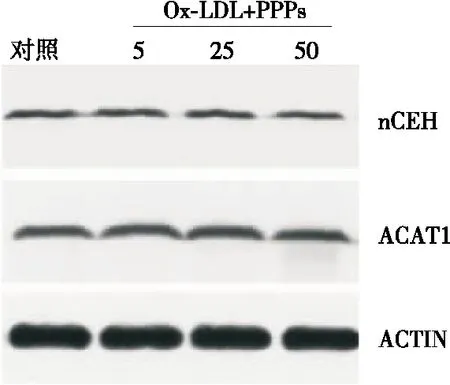
图5 不同浓度PPPs作用下ACAT1和nCEH
Figure 5 The proteins expression pattern of ACAT1 and nCEH after treatments with different concentrations of PPPs
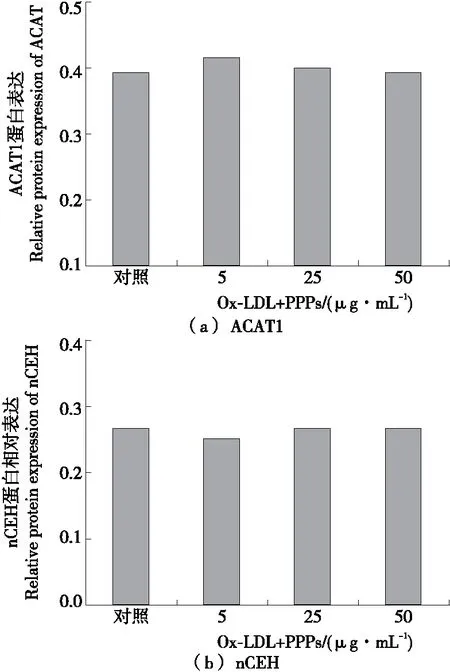
图6 石榴皮多酚对Raw264.7细胞ACAT1和nCEH
Figure 6 Effect of PPPs on ACAT1 and nCEH protein expression in Raw264.7 macrophages (n=3)

表3 石榴皮多酚对Raw264.7细胞ACAT1和nCEH活性的影响†
† **表示与对照相比差异极显著(P<0.01)。
3 结论
本试验研究了PPPs对HDL介导的胆固醇流出及相关蛋白SR-B1的调控作用,并揭示了PPPs对胆固醇在细胞内转化的2个关键酶ACAT1和nCEH的影响。结果表明PPPs可以通过上调SR-B1蛋白促进胆固醇流出,同时,PPPs虽然未能显著影响nCEH和ACAT1蛋白的表达,但是降低了ACAT1的活性,提高了nCEH的活性,有助于减少巨噬细胞内脂滴的蓄积,催化泡沫细胞脂滴中的胆固醇酯水解成游离胆固醇,并通过细胞膜上胆固醇运载体ABCA1、SR-B1将游离胆固醇转运到外源性受体。本研究的结果完善了PPPs促进Raw264.7巨噬细胞胆固醇流出的机理,解释了泡沫细胞被PPPs抑制的机制,为利用PPPs防治动脉粥样硬化等心血管疾病提供了理论依据。
此外,本研究并未揭示PPPs对胆固醇流出关键酶ACAT1和nCEH酶活作用的机理,需要进一步深入探索PPPs对ACAT1、nCEH酶活影响的途径,从而更加全面地解释PPPs促进胆固醇流出的机制。

