多重实时荧光定量PCR对下呼吸道感染病原体检测分析
刘馨玉 李 萌 石璞玉 陈明伟
下呼吸道感染是呼吸科最常见的疾病,在发展中国家发病率及死亡率居高不下。细菌、真菌是其常见的病原,随着研究的深入,非典型病原体及病毒在下呼吸道感染中的作用逐渐被人所认识[1-3]。目前临床普遍采用直接免疫荧光法检测抗原或间接免疫荧光法检测抗体,但灵敏度和特异度不理想。近年来,在普通PCR技术上发展起来的多重PCR技术可以同时检测多种病原体,实现高通量,高灵敏度,高特异度检测,成为呼吸道病原体诊断的新方向[4-6]。本文应用多重荧光定量PCR技术检测痰或支气管灌洗液标本,筛查甲型流感病毒(FluA)、乙型流感病毒(FluB)、腺病毒(adenovirus, ADV)、呼吸道合胞病毒(respiratory syncytial virus pneumonia, RSV)、副流感病毒(parainfluenza virus, PIV)、肺炎支原体(Mycoplasma pneumonia, MP)、肺炎衣原体(Chlamydia pneumoniae, CP)、肺炎军团菌(Legionella pneumoniae, LP)8种呼吸道常见病原体核酸,同时采用间接免疫荧光法检测患者血清中这8种病原体IgM抗体,旨在探讨多重荧光定量PCR方法的优势及临床应用价值。
材料与方法
一、研究对象及标本采集
选取2014年1月至2017年12月收治在西安交通大学第一附属医院呼吸内科的210例患者,其中男性121例,女性89例,年龄18~92岁。入选标准:①符合CAP诊断标准,参照中华医学会呼吸病学分会2006年制定的社区获得性肺炎(communityacquiredpneumonia, CAP)诊断和治疗指南[7];②年龄>18岁。排除标准:①妊娠期或哺乳期妇女;②活动性肺结核患者;③吸入性肺炎或阻塞性肺炎;④发病前2周有住院治疗史,本次感染不能除外医院获得性感染者;⑤人类免疫缺陷病毒阳性患者。所有患者的痰或支气管灌洗液细菌或真菌培养均为阴性。
二、检测试剂
多重实时荧光定量PCR:核酸提取:采用NucliSens easy MAGTM (生物梅里埃,法国)自动化核酸提取设备。核酸提取试剂为仪器配套试剂。Bio-Rad荧光定量PCR仪,型号CFX96。核酸检测:呼吸道病原检测试剂盒(Fast-track diagnostics Respiratory pathogens 33,Junglinster,卢森堡)。8种呼吸道感染病原体IgM抗体检测试剂盒(国食药监械(进)字2010第3400365号)西班牙VIRCELL公司生产。
三、实验方法
1. MRT-PCR法: ①标本的收集:患者入院24 h内采集痰或支气管灌洗液标本,其中深部痰165例,支气管灌洗液45例。痰为晨起漱口深咳后留取;支气管灌洗液为支气管镜吸取的支气管分泌物。4 h内在生物安全屋中将标本中加入1 ml病毒冻存液,分装成3份于冻存管中,-80 ℃保存;②取200 μl加入2 ml裂解液,按照设备使用要求运行提取程序,设置提取对照和内对照,核酸融于110 μl洗脱液,-80 ℃储存备用;③取10 μl样本核酸进行检测,设置检测过程的阴性对照,用荧光定量PCR仪分析;④扩增温度条件:42 ℃,15 min/94 ℃,3 min。40 cycles of:94 ℃,8 sec/60 ℃,34 sec;⑤结果判读:阳性结果判读标准为具有典型“S”型扩增曲线且CT<35。阴性对照无扩增。
2. IFA法: ①标本收集:患者入院24 h内,静脉穿刺采集血液2~3 ml,离心后取血清;②取15 μl样本,按照试剂说明书进行操作;③结果判读:阳性结果可观察到不同检测孔中抗原与抗体结合后细胞质、细胞核或细胞膜出现苹果绿色荧光。阴性的细胞呈红色[8]。
3. 测序: 210例标本参考有关文献进行PCR扩增及测序验证,操作由中国医学科学院病原生物研究所完成。
四、统计学方法
使用Epidata3.1录入数据,数据核实后转换为SPSS 18.0或Excel进行统计分析,计算检出率、灵敏度、特异度、阳性预测值及阴性预测值,差异比较采用χ2检验,P<0.05为差异有统计学意义。
结 果
一、MRT-PCR检测结果
对210例住院患者进行非典型病原体及病毒检测,结果显示123份标本为阳性,阳性率为58.57%,其中单一感染阳性率为50.95%(107/210),混合感染阳性率为7.62%。混合感染的样本为MP+FluA 7例,RSV+FluA 4例,MP+FluB 2例,RSV+FluB 2例,PIV+LP 1例。
二、IFA检测结果
对210例住院患者应用间接免疫荧光法检测血清IgM抗体,结果显示80份标本为阳性,阳性率38.10%,其中单一感染阳性率为33.33%(70/210),混合感染率为4.76%。混合感染的样本为MP+FluA 6例,MP+FluB 1例,FluA+RSV 1例,LP+PIV 1例。
三、MRT-PCR法与IFA法比较
对210例标本全部进行PCR及测序验证,两种方法结果一致为108例,其中阳性45例,阴性63例,一致率为51.43%。在一致的108例标本中,98例与测序结果一致,10例与测序结果不同。分析对不同病原体的特异性和敏感性,发现MRT-PCR方法对8种常见呼吸道病原体的灵敏度和特异度均在80%以上,其中RSV和CP的灵敏度和特异度均为100%;IFA法检测CP灵敏度、特异度高,但对大部分病原体灵敏度较低,特异度较好,见表1。在两种方法不一致的标本中,测序结果与MRT-PCR一致的有91例,67例阳性,24例阴性;测序结果与IFA一致的有7例,全部为阴性,见表2。总体而言,MRT-PCR法和IFA法检测的灵敏度分别为94.74%和35.96%,特异性分别为84.38%和59.38%,阳性预测值为87.80%和51.25%,阴性预测值为93.10%和43.85%。灵敏度和特异度差异有统计学意义(χ2分别为65.01和22.04,P<0.05)。
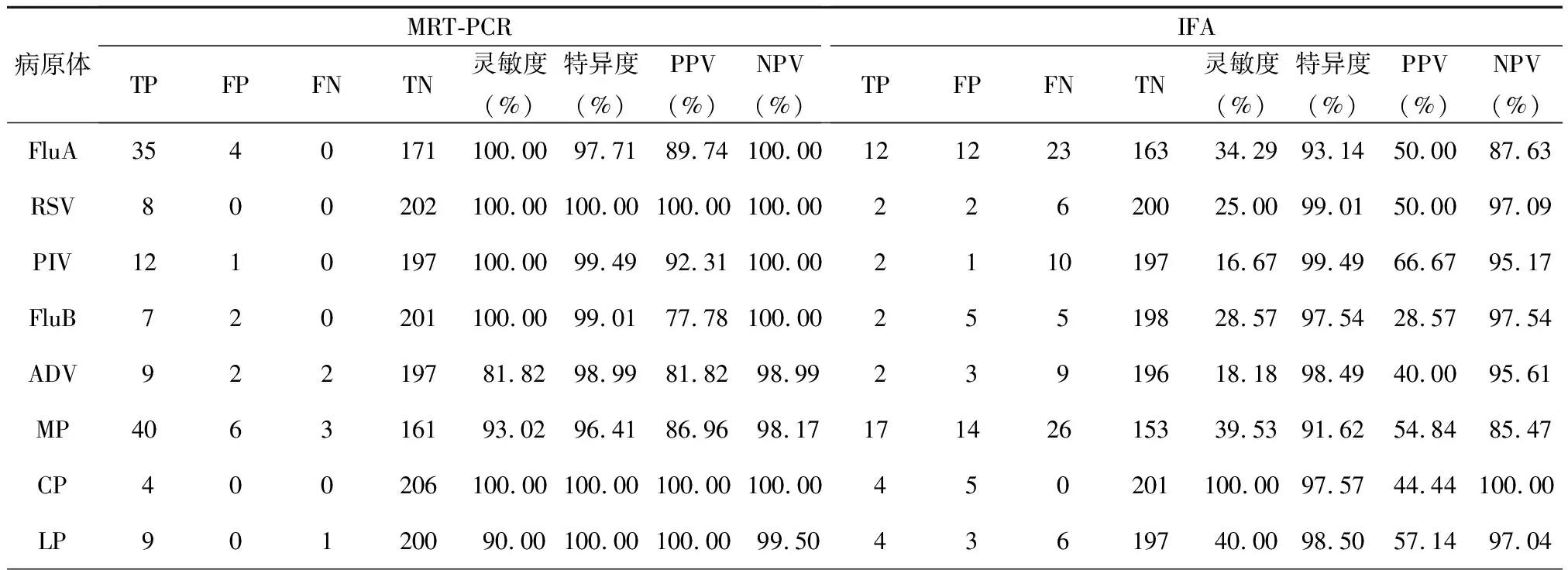
表1 MRT-PCR法与IFA法检测结果比较
注:TP,真阳性;FP,假阳性;FN,假阴性;TN,真阴性;PPV,阳性预测值;NPV,阴性预测值
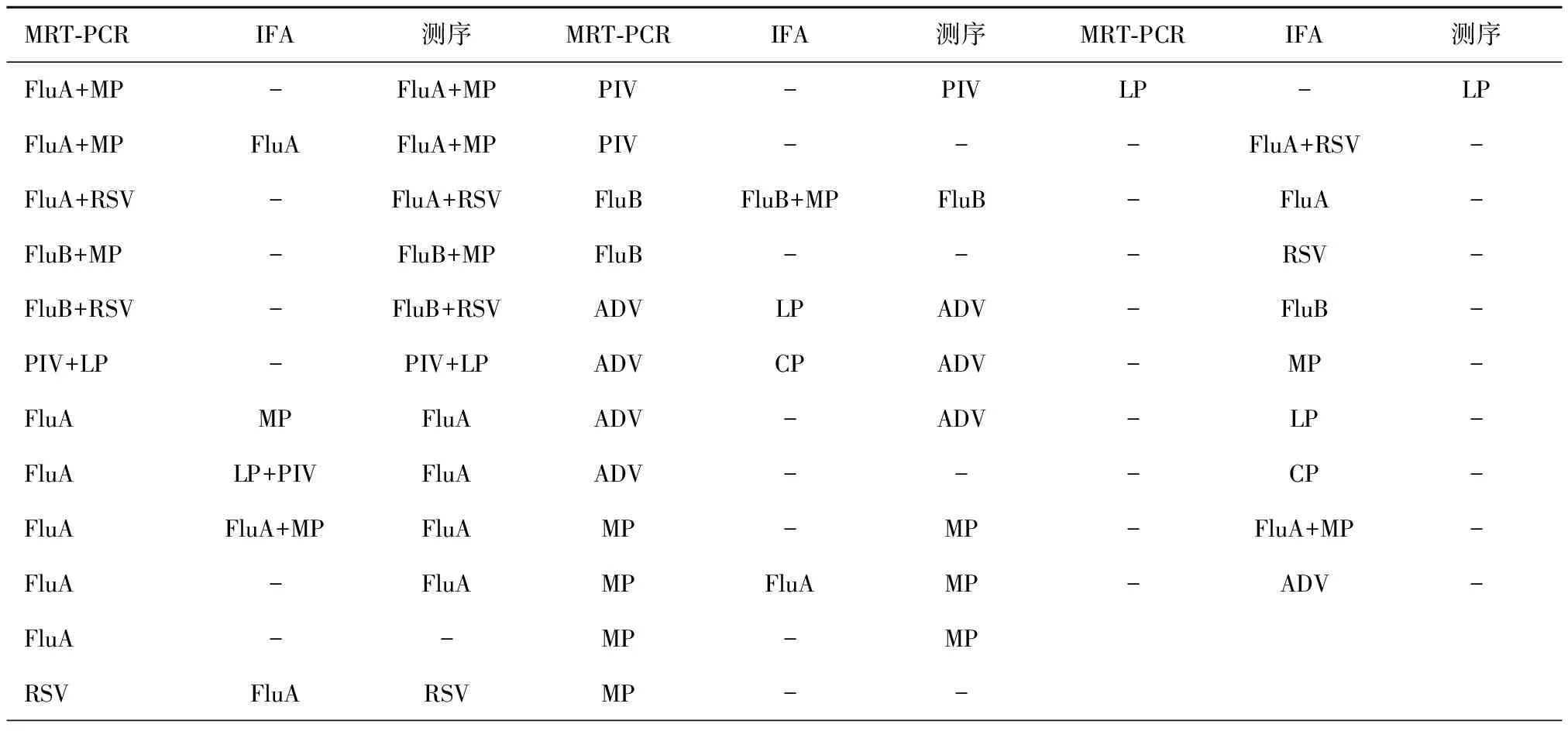
表2 两种方法不一致标本测序结果
注:“-”为未检测到阳性结果
讨 论
MRT-PCR和IFA法均是针对呼吸道病原菌的检验方法,MRT-PCR主要在大型实验室开展应用,但本实验中应用的MRT-PCR快速检测试剂盒已在美国和欧洲用于体外诊断。IFA检测目前已在临床上大量应用,已有的研究多用病毒标准品或儿童上呼吸道标本对其与胶体金免疫层析法比较,对成人下呼吸道标本检测较少,对与MRT-PCR比较研究更少[9-15]。本文中,比较了两种方法的检测性能,发现MRT-PCR法阳性率58.57%,与其他研究相接近[16-17],IFA法的阳性率33.33%,略高于国外学者的研究[16-17],MRT-PCR法检测混合感染率为7.62%,与Beckmann等[18]的8%的混合感染率接近。两种方法检测的灵敏度、特异度有统计学差异,IFA法的灵敏度明显低于MRT-PCR法,可能与下列因素有关:①机体感染后免疫系统产生抗体存在窗口期;②部分免疫缺陷或低下患者不产生抗体[19];③部分成年人再次感染MP后检测不到抗体[20]。在MRT-PCR检测中,出现一些假阳性样本,可能与结果的判读方法有关,由于该方法是人工根据扩增曲线判读结果,实验中会产生一些非典型的扩增曲线,出现误判,导致假阳性结果。而IFA法出现大量假阳性结果不能排除一些患者存在长期携带IgM抗体的现象,据相关报道,部分呼吸道感染患者产生的IgM抗体可持续存在1年或更长时间[21-25]。
与传统实验方法相比,MRT-PCR方法不但可以检测呼吸道病毒、非典型病原体,还可以检测细菌、真菌,病原谱覆盖更广且检测性能方面优于IFA方法。由于目前MRT-PCR价格较高,可以与IFA联合用于临床诊断。血清学方法阴性而MRT-PCR阳性,可能为检查时间较早,未产生抗体,或部分患者不产生抗体;血清学方法阳性而MRT-PCR阴性,应考虑既往感染,血清学存在假阳性可能。总之,在诊断病毒或非典型病原体感染时,以MRT-PCR方法作为补充,并结合临床症状及治疗效果,可较早的明确诊断。

