过表达 CKLF1 基因对强直性脊柱炎滑膜成纤维细胞增殖及成骨转化影响的实验研究
李虎 李儒军 陶可 赵丹 张立毅 高嘉翔 柯岩 林剑浩
作者单位:100044 北京大学人民医院骨关节科、关节炎诊疗中心(李虎、李儒军、陶可、张立毅、高嘉翔、柯岩、林剑 浩);100871 北京大学工学院生物医学工程系(赵丹)
强直性脊柱炎(ankylosingspondyliti,AS)是一种以骶髂关节炎、肌腱端炎和脊柱炎为特点的慢性进行性全身结缔组织疾病,是其它脊柱关节病(spondyloarthritis,SpA)的原型。AS 好发于青壮年男性,国内 AS 发病率为 0.23%。由于本病病因尚未完全明确,起病隐匿,病程迁延,早期临床症状及实验室检查缺乏特异性,晚期病情严重时出现脊柱强直、关节畸形后,病情不能扭转,可导致功能丧失,是青壮年致残的主要原因。以往研究证实肌腱附着点异常骨化是其病变基础,而成纤维细胞在致炎性因子作用下的成骨转化在 AS 病理性骨化钙化发病、进展过程中起重要作用[1-6]。
趋化素样因子 1(chemokine-like factor1,CKLF1)是北京大学人类基因研究中心利用差异性递减杂交技术(suppression subtractive hybridization,SSH),在国际上克隆 U937 细胞中被植物血凝素(phytohaemagglutinin,PHA)刺激并被白细胞介素(IL)-10 抑制的 cDNA 中,首次发现的细胞因子,具有 CC 家族趋化因子的结构特征和功能特征[7]。体内外的研究均证实,CKLF1 可以明显激活并趋化中性粒细胞、淋巴细胞和单核细胞[7]。本课题组的前期研究发现[8],类风湿关节炎(rheumatic arthritis,RA)滑膜中 CKLF1 表达水平明显高于骨关节炎(osteoarthritis,OA)和半月板损伤的 CKLF1 水平,提示其在 RA 发病中可能起到重要作用。进一步研究还发现[9],AS 患者髋关节囊滑膜组织中 CKLF1 及其受体 CCR4 表达明显升高,且与体内 C 反应蛋白、血沉和 D-二聚体等水平存在一定正相关性,表明 CKLF1 在 AS 病变中可能也发挥重要作用。最新研究还发现[10],CKLF1 基因过表达能促进 AS 髋关节囊周围滑膜成纤维细胞的增殖和致炎性细胞因子分泌,并增强成骨转化相关靶基因的转录,推测 CKLF1 可能在 AS 关节病理性骨化过程中发挥重要作用。本研究旨在探讨 CKLF1 对 AS 髋关节囊另一种参与病理性骨性强直的重要的细胞成分即滑膜成纤维细胞的增殖和向成骨细胞转化的影响,以明确其在 AS 发病过程中的可能作用机制并为探寻 AS 新的治疗靶点提供理论依据。
材料与方法
一、主要试剂和仪器
DMEM 培养液、Opti-MEMTM、胎牛血清、0.25% 胰蛋白酶+0.02% EDTA、磷酸盐缓冲液(PBS)等试剂均购于 Gibco 公司,pCDI-CKLF1 和兔抗人 CKLF1 多克隆抗体(北京大学人类疾病基因研究中心韩文玲、陈英玉和马大龙教授馈赠),人胚胎肾 293T 细胞、AAV-2 质粒(pACP)、Ad5 和 Ad8 腺病毒等为本实验室保存,II 型胶原酶、HEPES(Sigma 公司),限制性内切酶 Xbal、BamHl、EcoRI 和 T4 DNA 连接酶等(Rothe 公司),WST-1 细胞增殖检测试剂盒(Rothe 公司),白细胞介素(IL)-6 和肿瘤坏死因子(TNF)-α 酶联免疫吸附试验(ELISA)试剂盒(RD 公司),一抗(除 CKLF1 外)均来自于 Abcam 公司,H & E 染液(Rothe 公司),Trizol 细胞裂解液(Invitrogen 公司),荧光定量 RT-PCR(fluorescence quantitative RT-PCR,FQ-PCR)试剂盒(Invitrogen 公司),Rhodamine 标记的羊抗兔荧光二抗(Sigma 公司),酶标仪(Bio-Rad 公司),FQ-PCR 反应仪(ABI 公司),激光共聚焦显微镜(Confocal,Olympus 公司)。
二、伦理审批
本研究经北京大学人民医院伦理委员会递交伦理审查批准所有参与的患者均签署知情同意书。整个实验过程中均严格遵从赫尔辛基宣言等,保护受试者权益;实验后,严格遵循实验室生化试剂使用后的无害化处理原则及按照医院医疗废物处理规章制度处理实验用标本。
三、髋关节滑膜组织的获取
本实验所需正常和 AS 人髋关节滑膜组织分别取自于我科 4 例临床诊断为股骨颈骨折 [排除 OA、RA 和 AS 等疾病,平均年龄:( 63.75±3.49)岁,男] 和 3 例重度 AS(髋关节强直)[11][排除 OA、RA 等疾病,平均年龄:( 46.00±2.94)岁,男] 拟行髋关节置换的患者,两组患者人口学资料相比差异无统计学意义。
四、髋关节滑膜成纤维细胞的培养与鉴定
滑膜成纤维细胞的分离与培养参考已建立的方法[9-10]。具体如下:无菌操作条件下,取新鲜获取的髋关节囊周围滑膜组织,PBS 冲洗至液体无色透明,眼科剪剔除周围脂肪组织,剪碎后用 1 mg / ml II 型胶原酶消化过夜,离心去上清,加入 10% 胎牛血清 DMEM 培养基(含青霉素和链霉素)重悬单细胞,台盼蓝染色计数细胞及存活率(>95%),分装于 75 cm2培养瓶培养后 24 h 首次更换培养基并去除未贴壁的细胞,以后每隔 3 天换液 1 次。采用倒置相差显微镜每天对细胞进行形态学观察。实验用第 3~5 代细胞[12]。取上述第 3 代细胞,以 1×105/ 每孔接种于预置有盖玻片(24 mm × 24 mm,经多聚赖氨酸 / 甘油处理)的 6 孔板中,置于 37 ℃,5% CO2培养箱内培养 24 h。4% 的多聚甲醛固定后,依次经过 0.25% Triton X-100 通透化、3% 的 BSA 封闭、抗 vimentin 抗体 4 ℃ 过夜和 Rhodamine 标记的荧光二抗孵育后,将玻片置于 Confocal 显微镜下观察、拍照分析。
五、髋关节滑膜组织原位和成纤维细胞体外培养模型的构建
首先,髋关节滑膜组织原位培养:按照已报道的髋关节滑膜组织原位培养模型[10]并借鉴 Riera 等[13]报道的人半月板原位培养模型进行髋关节滑膜组织取材。具体方法为:采用直径 2 mm 特制取材器对新鲜髋关节囊内滑膜组织进行打孔取材,后将圆柱状标本(长 4 mm,直径 2 mm)置入 24 孔板中并加入 10% 胎牛血清培养基培养。其次,建立滑膜成纤维细胞体外(in vitro)2D 培养模型[9-10]:将上述经鉴定的滑膜成纤维细胞经台盼蓝染色、计数后分别接种于 96 孔板(1×104/ 每孔)、预置有盖玻片的 6 孔板和 75 cm2培养瓶中进行 2D 平面培养。每 3 天更换 1 次组织和细胞的培养基。
六、重组腺相关病毒(rAAV)-hCKLF1 载体的包装与鉴定 [7,10,14-17]
首先,RT-PCR 获取和扩增人 CKLF1 cDNA;同时,pCDI-CKLF1 扩增后进行过夜(18 h)酶切(EcoRI 限制性内切酶)和 0.5% 琼脂糖凝胶电泳检查酶切情况。利用 DNA 凝胶回收试剂盒进行纯化回收,检测分光光度值(OD 值)标记浓度,比较两种方法所得 CKLF1 基因一致性。其次,使用 T4 DNA 连接酶,将 CKLF1 基因插入表达载体 pACP(来源于 pSSV9,是 AAV-2 基因克隆之一)[14-16],具体为:4 μl 纯化 CKLF1 基因产物,1.6 μl 已酶切暴露黏性末端的表达载体 pACP,0.5 μl T4 DNA 连接酶,1.9 μl 10×ligation buffer,终体积 8 μl。16 ℃ 水浴过夜链接,70 ℃ 5 min 终止链接反应,备用。再次,取 2 μl 上述反应产物进行转化感受态大肠杆菌,最后涂在含有 100 mg / ml 青霉素的 LB 平板上进行筛选,平板置于 37 ℃ 孵箱过夜,观察阳性克隆。无菌条件下,挑取单个阳性克隆菌落加入含 100 mg / ml 青霉素的 LB 培养基 5 ml 中,30 ℃、水平转速为 150 rpm 的恒温摇床过夜,收集细菌并进行质粒提取(Rothe 质粒提取试剂盒,并严格按照说明书进行操作),单、双酶切法再次鉴定构建的质粒,并送公司测序。随后,按照 Cucchiarini 等[16]已报道的方法,进行重组腺相关病毒(rAAV)载体在 293T 细胞中的包装和扩增,具体为:在腺病毒 Ad5 和 Ad8 的辅助下,向 70%~80% 生长融合的 293T 细胞加入上述经鉴定的 pACP 质粒进行转染,24 h 后更换一次含谷氨酰胺的胎牛血清培养基,24 h 后收集含 rAAV 载体的病毒粗提液。以 -80 ℃、37 ℃ 各 1 min 反复冻融 4 次,10000 rpm 超高速离心得病毒上清液,置于 -80 ℃,备用。同样的方法构建、包装与鉴定 rAAV-lacZ 载体。最后,半数组织培养感染剂量法(TCID 50)测定病毒滴度:在 96 孔板中分 8 个病毒稀释梯度 [10-3,10-4,-10-10,每个梯度 12 孔(一排),其中前 2 孔为阴性对照],加入到 2.5% 胎牛血清培养基培养的 293T 细胞中,37 ℃ 培养箱培养 10 天。10 天后倒置显微镜下观察,计算每一排中出现细胞病变效应(CPE)的孔数,根据 TCID 50= 101+d (S-0.5)(d 为 log10稀释倍数,S 为阳性孔比率总和),最后将 TCID 50 转换为空斑形成单位(PFU)/ ml,即:PFUs=0.7×TCID 50 的滴度。
七、rAAV-hCKLF1 转染与实验分组 [9-10,12]
将上述纯化的含 rAAV-lacZ、rAAV-hCKLF1 病毒液分别加入上述髋关节滑膜组织(15 μl / 组织样 本)和细胞模型(3 μl / 孔),静止 1 min,后加入无血清 DMEM 培养基,轻轻振荡使病毒与组织块或细胞充分接触,1.5 h 后加入含 10 ng / ml BMP-2,10 mmol / L β-甘油磷酸钠,50 mg / L 维生素 C, 100 mmol / L 地塞米松和 10% 胎牛血清的成骨诱导培养液继续培养至 21 天。本实验中 rAAV 病毒载体转染效率的测定分别采用 X-gal 活组织染色和 Western blot 法检测四种模型中 rAAV 病毒载体转染效率。首先,X-gal 染色定性检测 rAAV-lacZ 转染结果,具体为:将上述模型中经 rAAV-lacZ 转染的细胞标本用 2% 甲醛溶液固定后,加入新鲜配置的 X-gal 染液,于 30 min,1 h,2 h,光镜下观察并拍照,以随机 10 个高倍镜下的阳性细胞数(深蓝色染色)/ 总细胞数× 100% 为阳性率,也即转染效率。以上各组实验均重复 3 次。以上两样本实验均分为三组:无病毒转染组(no vector)、rAAV-lacZ 转染组(lacZ)和 rAAV-hCKLF1 转染组(CKLF1)。
八、rAAV-hCKLF1 转染后的细胞增殖能力检测
rAAV-hCKLF1 转染 21 天后,分别收集组织和细胞标本,进行如下操作:对组织切片行 HE 染色并计数单位面积下的细胞数[10,16]、水溶性四氮唑法(WST-1)检测细胞增殖能力[9-10]和 Hoechst 33258 检测细胞 DNA 含量[10,16]。
九、rAAV-hCKLF1 转染后的致炎性细胞因子分泌
rAAV-hCKLF1 转染第 20 天时,更换无血清 DMEM 培养基 100 μl / 孔,24 h 后收集培养体系中的上清液,移入无菌 Eppendorf 管中,置入 -80 ℃,备测。使用 IL-6 和 TNF-α ELISA 试剂盒分别检测样本中 IL-6 或 TNF-α 的相应浓度[10,18],进而判断 CKLF1 过表达对两者分泌的影响。以上步骤重复 3 次,结果取平均值。
十、Confocal 扫描 rAAV-hCKLF1 转染后对特异性成骨细胞外基质蛋白表达的影响 [10]
骨钙蛋白(OCN)和骨桥蛋白(OPN)是重要的特异性骨细胞外基质蛋白,采用与上述判断 vimentin 蛋白表达水平一样的方法对样本 OCN 和 OPN 进行检测。
十一、FQ-PCR 检测成骨关键靶基因、CKLF1 及其受体 CCR4 的表达
使用荧光定量 RT-PCR(FQ-PCR)对 CKLF1 基因转染后样本的成骨关键靶基因以及 CKLF1 与其受体 CCR4 的表达进行了定量分析(引物序列见表1)[10]。
由获取的循环阈值(Ct)值,根据 2-△△Ct法(目的基因 mRNA 表达量=2-△△Ct,△Ct=△E-△C,△E=Ct样本-Ctβ-actin,△C=Ct对照组-Ctβ-actin)分别计算目的基因 CKLF1、CCR4、ALP、Runx2、OPN、OCN和 Col1α2 在不同实验分组中的表达量[9-10,18]。

表1 目的基因序列及扩增产物、退火温度、循环次数Tab.1 Target gene sequence and amplification products, annealing temperature, number of cycles
十二、统计学处理
实验结果采用 SPSS 23.0 软件进行统计学分析,计量资料以±s表示,各组间数据用单因素方差(one way ANOVA)分析(LSD 法),两组间比较采用 Studentt检验,P≤ 0.050 为差异有统计学意义。
结 果
一、正常和 AS 滑膜成纤维细胞形态学观察及抗 vimentin 蛋白鉴定
正常和 AS 髋关节长梭形成纤维细胞样细胞胞质抗 vimentin 抗体呈明显红色荧光,胞核亦有少量红色荧光,呈阳性反应,而细胞核 DNA 与 DAPI 结合呈现蓝色荧光。证实分离的细胞为滑膜成纤维细胞(bar=60 μm)(图 1)。此外,还可见相同单位面积下,AS 中抗 vimentin 抗体阳性细胞百分率与正常组的相近似,差异无统计学意义(P=0.27)。
二、rAAV 病毒载体转染效率的测定
采用 TCID 50 测定病毒滴度,最终得到的 rAAV-lacZ 滴度为 1×1011病毒颗粒 / ml;使用 OD 260 法进行病毒感染效力(MOI)测定,为 10±2。随后,将 rAAV-lacZ 和 rAAV-CKLF1 分别转染上述滑膜组织和第 3 代滑膜成纤维细胞后 3 天,X-gal 染色发现 rAAV 载体能有效转染正常和 AS 滑膜成纤维细胞,效率高达 97.50% 以上,与无病毒转染组、lacZ 组相比,差异均有统计学意义(P=0.0003),且至少持续 21 天。rAAV-lacZ、rAAV-CKLF1 转染后 21 天,收集标本分别进行 X-gal 染色,rAAV 病毒载体携带报告基因 lacZ 能有效转染正常和 AS 髋关节滑膜组织,即 lacZ 组可见明显的深蓝色阳性染色,转染效率分别为 98.0% 和 97.5%,明显高于无病毒转染组(15.0% 和 11.5%)、CKLF1 组(14.5% 和 17.0%),分别是无病毒转染组、lacZ 组的 6.53 和 6.76 倍以及 8.48 和 5.74 倍(图 2a,d);同时,rAAV-lacZ 能有效转染正常和 AS 髋关节滑膜成纤维细胞,转染效率分别为 97.5% 和 99.0%,明显高于无病毒转染组(15.0% 和 17.0%)、CKLF1 组(18.5% 和 21.0%),分别是无病毒转染组、lacZ 组的 6.50 和 5.27 倍以及 5.82 和 4.71 倍(图 2b,e);Western blot 检测发现 rAAV-CKLF1 基因转染能有效转染正常和 AS 髋关节滑膜成纤维细胞,分别是无病毒转染组的 4.56 和 3.82 倍(图 2c,f),以上差异均有统计学意义(P=0.0012 和P=0.0001)。
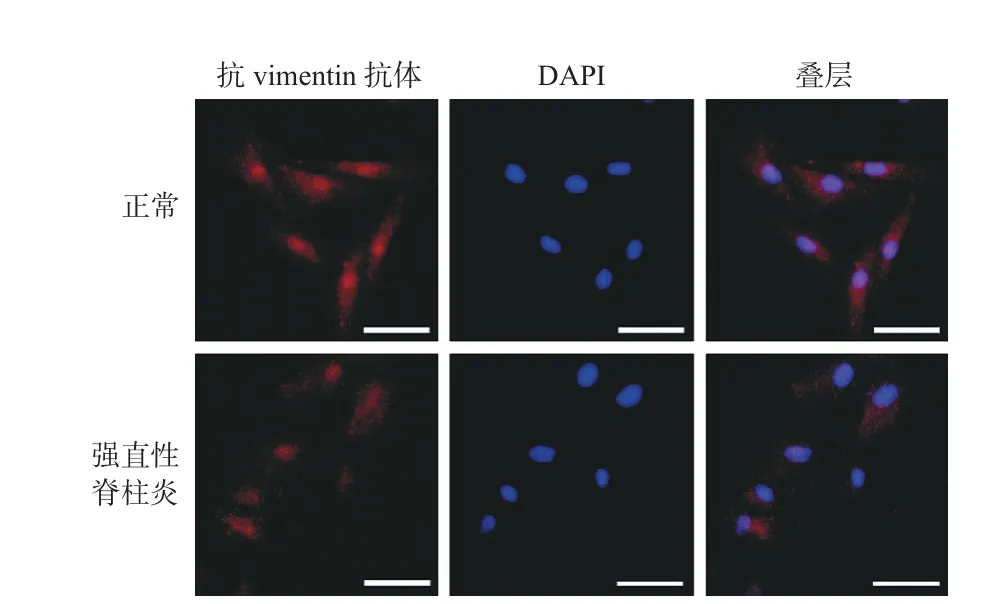
图1 正常和 AS 滑膜细胞抗 vimentin 蛋白免疫荧光检测 (× 10)Fig.1 Anti-vimentin immunofluorescence assay of normal and AS synovial cells (× 10)
三、rAAV-CKLF1 转染对细胞增殖的影响
rAAV-CKLF1 转染能有效促进原位培养的正常和 AS 髋关节滑膜组织中的细胞增殖(其中,AS 髋关节滑膜组织 rAAV-CKLF1 转染组的单位面积下细胞总数为 409.0 个 / mm2,是无病毒转染组、lacZ 组的 2.00 和 2.09 倍,P=0.0000)(图 3a),进一步的 DNA 含量检测得到了类似的结果(分别是无病毒转染组、lacZ 组的 1.44 和 1.55 倍以及 1.51 和 1.45 倍,P=0.0260,P=0.0020)(图 3b,d);同样地,rAAV-CKLF1 转染能有效促进成纤维细胞增殖(明显高于无病毒转染组和 lacZ 组,P=0.0120,P=0.0040)(图 3c)。

图2 X-gal 染色和 Western blot 检测 rAAV 载体转染效率 a:正常和 AS 髋关节滑膜组织 X-gal 染色;b:正常和 AS 髋关节滑膜成纤维细胞 X-gal 染色;c、f:正常和 AS 髋关节滑膜成纤维细胞 Western blot 检测;d:正常和 AS 髋关节滑膜组织 X-gal 染色阳性率;e:正常和 AS 髋关节滑膜成纤维细胞 X-gal 染色阳性率Fig.2 X-gal staining and Western blot detection of rAAV vector transfection efficiency a: X-gal staining of the normal and AS hip synovial tissue; b: X-gal staining of the normal and AS hip synovial fibroblasts; c, f: Western blot analysis of the normal and AS hip synovial fibroblasts; d: X-gal positive staining of the normal and AS hip synovial tissue; e: X-gal positive staining of the normal and AS hip synovial fibroblasts
四、rAAV-CKLF1 转染对致炎性细胞因子表达的影响
正常和 AS 髋关节滑膜组织及成纤维细胞进行 rAAV-CKLF1 转染后 21 天,检测培养体系上清液中 TNF-α 和 IL-6 表达水平,结果表明 rAAV-CKLF1 转染显著促进正常和 AS 髋关节滑膜组织及成纤维细胞的致炎性细胞因子分泌(明显高于无病毒转染组、lacZ 组,P=0.0060、P=0.0020)(图 4)。
五、CKLF1 基因过表达对 OCN 和 OPN 表达影响
正常和 AS 髋关节滑膜成纤维细胞转染 rAAV-hCKLF1 后 21 天,CKLF1 基因过表达能明显促进 AS 成纤维细胞表达成骨相关靶基因(OCN 和 OPN)(图 5)。
六、CKLF1 基因过表达对成骨关键靶基因的表达影响
各组 OD 值均在 1.7~2.0;1.0% 琼脂糖凝胶电泳结果显示,电泳图条带清晰,RNA 完整性好,无 DNA 和蛋白质污染经熔解曲线测定,得到单峰扩增产物,无明显非特异性扩增产物,特异性好。rAAV-hCKLF1 转染能促进正常和 AS 髋关节滑膜成纤维细胞表达 CKLF1(分别是无病毒转染组、lacZ 组的 18.25、20.03 倍和 16.31、19.14 倍,差异均有统计学意义(P=0.0056);相似的结果也分别在 ALP、Runx2、OPN、OCN 和 Col1α2 的基因表达被发现(分别是无病毒转染组、lacZ 组的 3.16、3.56、3.02、3.29 倍;2.48、3.93、2.54、1.47 倍;1.74、1.94、2.82、2.65 倍;1.76、1.86、1.59、1.73 倍;1.81、2.07、2.77、2.97 倍,差异均有统计学意义,*P=0.0410,#P=0.0027);值得注意的是,CKLF1 基因过表达对正常滑膜成纤维细胞上 CCR4 表达无明显影响(P=0.1209),但能促进 AS 滑膜成纤维细胞 CCR4 的表达(P=0.0381)(图 6)。

图3 CKLF1 基因有效促进髋关节滑膜组织及成纤维细胞的增殖 a:正常和 AS 髋关节滑膜组织单位面积下细胞总数;b~c:正常和 AS 髋关节滑膜组织 DNA 含量检测细胞增殖活性;d:WST-1 定量检测成纤维细胞增殖情况Fig.3 CKLF1 gene promoted proliferation of hip synovial tissue and fibroblasts a: The total number of cells per unit area of the normal and ASA synovial tissue; b - c: DNA content detection of the normal and ASA synovial tissue; d: WST-1 quantitative detection of fibroblast proliferation ability
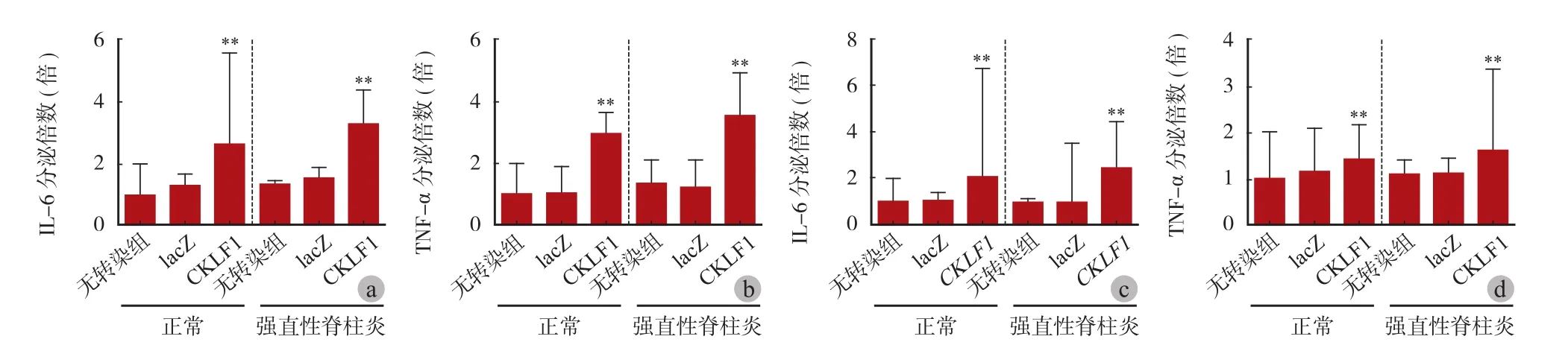
图4 CKLF1 过表达促进致炎性细胞因子分泌 a:rAAV-CKLF1 转染能促进正常和 AS 髋关节滑膜成纤维细胞分泌 IL-6,设定无病毒转染组的 IL-6 表达量为 1.0,正常和 AS 髋关节滑膜成纤维细胞转染 rAAV-CKLF1 后,分别是其 2.62 和 3.30 倍 (P = 0.0020);b:rAAVCKLF1 转染成纤维细胞后,TNF-α 分别升高 2.97 和 3.57 倍 (P = 0.0060);c:正常髋关节滑膜组织进行 rAAV-CKLF1 转染后 21 天,IL-6 表达量明显增加 (P = 0.0020);d:滑膜组织的 TNF-α 表达水平分别升高 1.42 和 1.63 倍 (P = 0.0060)Fig.4 Overexpression of CKLF1 promoted secretion of inflammatory cytokines a: rAAV-CKLF1 transfection promoted the secretion of IL-6 by normal and AS hip synovial fibroblasts (the IL-6 expression level of the virus-free transfection group was 1.0, normal and AS hip synovial fibroblast transfection)After rAAV-CKLF1, they were 2.62 and 3.30 times, respectively (P = 0.0020); b: TNF-α increased by 2.97 and 3.57 times after transfection of rAAV-CKLF1 into fibroblasts respectively (P = 0.0060); c: IL-6 in normal hip synovial tissue expression increased after transfection with rAAV-CKLF1 for 21 days (2.05 and 2.45 times, respectively, in the virus-free transfection group, P = 0.0020); d: TNF-α expression levels of synovial tissue increased by 1.42 and 1.63 fold, respectively (P = 0.0060)
讨 论
趋化因子家族是一类由免疫或非免疫细胞分泌的一级结构相似的小分子蛋白,与七次跨膜的 G 蛋白偶联受体特异结合,通过 G 蛋白转导信号至细胞内,发挥其生物学活性,在机体的免疫调节、过敏反应、炎症反应、细胞增殖分化等过程中发挥重要作用[2,7-8]。作为趋化因子家族新成员的 CKLF1 被证实主要有两方面生物学功能:广谱的趋化活性以及较强的促增殖与分化能力。在体外,Han 等[7]用真核表达载体 pcDI-CKLF1 转染 COS-7 细胞,发现 CKLF1 具有明显趋化中性粒细胞、淋巴细胞和单核细胞的活性。同时将 pcDI-CKLF1 裸质粒注射到 BALB / c 小鼠肌肉中,注射质粒 10 天后,pcDICKLF1 组小鼠肌肉切片中炎性细胞浸润明显增多。Tan 等[19]将 pcDI-CKLF1 经电脉冲肌肉注射导入至小鼠体内,CKLF1 基因在肺内获得了高表达,可逆的引起细支气管上皮细胞脱落、间质充血水肿,进而导致因间质炎性细胞浸润、胶原沉积引起的肺泡壁增厚,可致肺纤维化作用。在哮喘患者的肺组织和外周血白细胞中,内源性 CKLF1 的表达明显上调,提示 CKLF1 在呼吸系统炎症性疾病的发病过程中起到重要的作用。我们的前期研究结果提示 AS 患者髋关节囊滑膜组织 CKLF1 及其受体 CCR4 表达明显升高,且与体内 C 反应蛋白、血沉和 D-二聚体等的炎性状态存在正相关[8]。而 Bal 等[20]通过检测血清中可溶性白细胞介素-2 受体(sIL-2R)、IL-6 和 TNF-α 的水平后,认为 IL-6 和 TNF-α 在 AS 的发病机制中发挥重要作用,且其水平可作为疾病活动度和诊断的评估工具。Gratacós 等[21]的研究发现 AS 患者致炎性因子(IL-6 和 TNF-α)水平明显升高,且 IL-6 与 AS 疾病活动密切相关。本研究结果显示,正常和 AS 髋关节滑膜组织及成纤维细胞过表达 CKLF1 基因后,培养体系中的致炎性细胞因子 IL-6 和 TNF-α 呈高水平表达,且上述促炎性作用至少持续 21 天。IL-6 和 TNF-α 的持续高表达将会趋化更多的致炎性细胞(如巨噬细胞、淋巴细胞)向炎症部位迁移,进而引起致炎性因子“瀑布样”增加,导致炎症反应加重[19-21]。
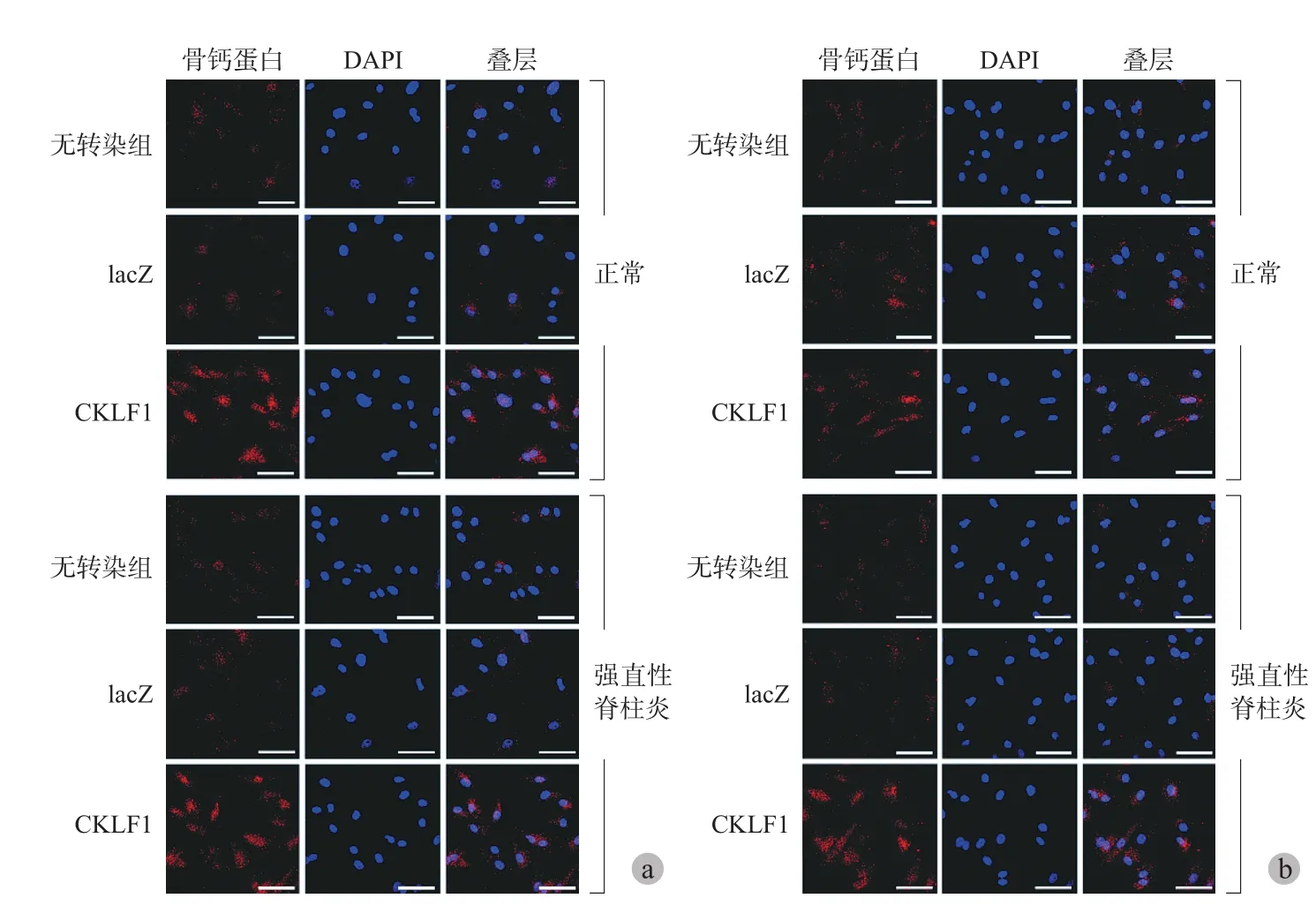
图5 CKLF1 促进骨细胞外基质蛋白 OCN 和 OPN 表达 (bar = 60 μm) a:OCN 染色检测成骨细胞和成骨前体细胞;b:OPN 染色检测成骨细胞和成骨前体细胞Fig.5 CKLF1 gene transfer promoted expression of extracellular matrix proteins OCN and OPN (bar = 60 μm) a: OCN staining of the osteoblast and osteogenic precursor cell; b: OPN staining of the osteoblast and osteogenic precursor cell
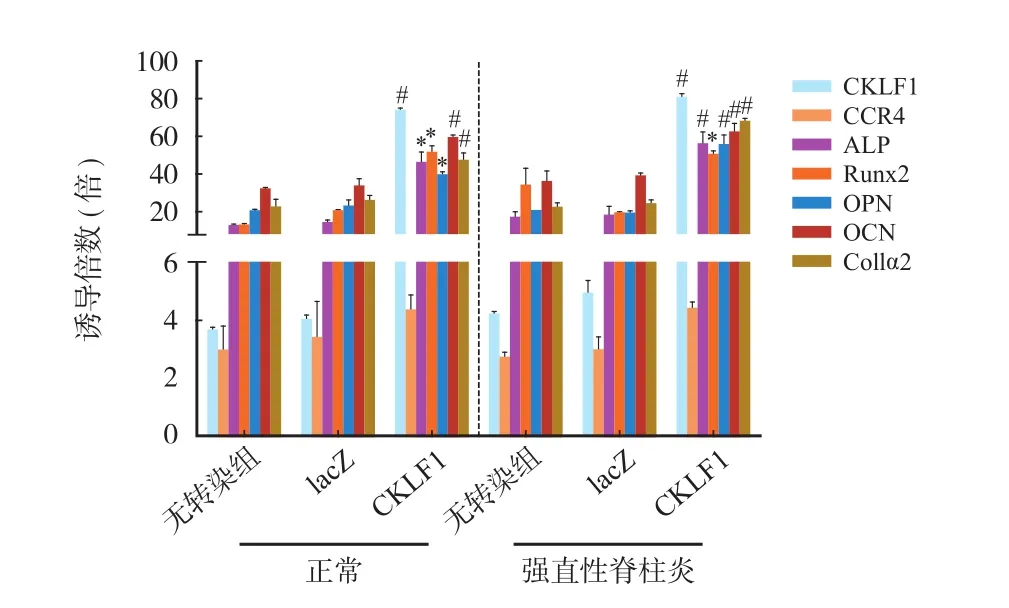
图6 CKLF1 对其自身信号转导及成骨分化相关靶基因表达的 影响Fig.6 Effects of CKLF1 on its own signal transduction and expression of target genes related to osteogenic differentiation
Ke 等[22]利用 CKLF1 真核细胞表达载体转染人和小鼠骨髓干细胞,结果发现 CKLF1 能促进人和小鼠骨髓造血干 / 祖细胞的增殖和分化,且与 GM-CSF 有协同刺激作用。Han 等[7]发现,CKLF1 在小鼠骨骼肌中的过表达可以促进细胞增殖分化加速,增加生肌素的表达水平及一些生长因子的活性,促进骨骼肌细胞的增殖。最近,有学者通过观察 CKLF1 对体外培养的人动脉平滑肌细胞的增殖作用,首次确定 CKLF1 对体外培养的人动脉平滑肌细胞具有促增殖作用,提示 CKLF1 可能参与动脉粥样硬化血管内膜增厚的过程[23]。本研究通过对 rAAV-CKLF1 转染后的正常和 AS 髋关节滑膜组织切片后,进行 HE 染色并计数单位面积下细胞总数,结果发现 CKLF1 基因过表达能促进原位培养的正常和 AS 髋关节滑膜组织中的细胞增殖,此外,还发现 CKLF1 基因转染能有效促进体外单层培养的正常和 AS 滑膜成纤维细胞增殖。本研究对 CKLF1 基因过表达的正常和 AS 髋关节滑膜组织和成纤维细胞进行 DNA 含量检测,也发现 CKLF1 能促进两种体系中的细胞 DNA 含量增加。表明 CKLF1 基因能通过增强 AS 髋关节滑膜成纤维细胞的 DNA 转录合成和增加细胞数目而促进其增殖。
Dalby 等[24]认为 OCN 和 OPN 可作为检测成骨细胞和成骨前体细胞的特异性标记物。笔者对正常和 AS 髋关节滑膜成纤维细胞 CKLF1 基因过表达对其成骨关键靶基因表达可能的影响研究中,发现 rAAV-hCKLF1 转染能促进正常和 AS 髋关节滑膜成纤维细胞表达 ALP、Runx2、OPN、OCN 和 Col1α2。而在 CKLF1 转染正常和 AS 髋关节滑膜成纤维细胞后的 OPN 和 OCN 免疫荧光检测中也有相类似的发现。值得注意的是,CKLF1 基因过表达对正常滑膜成纤维细胞上 CCR4 表达无明显影响,但能促进 AS 滑膜成纤维细胞 CCR4 的表达,这也可能部分解释 CKLF1 在促进正常和 AS 滑膜成纤维细胞增殖方面的作用相似,但能促进 AS 滑膜成纤维细胞分泌更多的致炎性细胞因子表达。以上结果还表明,CKLF1 基因一方面可能通过增强成纤维细胞中的成骨关键转录因子的表达,促进其向成骨细胞及其前体细胞转化;还可能通过增加成骨细胞外基质的合成代谢与沉积,进而诱导钙、磷聚集和基质矿物质化,促进成纤维细胞向成骨转化,进而成为成骨细胞和发挥成骨功能。上述研究发现也与笔者的实验结果基本一致[10],即 CKLF1 能促进 AS 髋关节囊两种组织细胞(韧带和滑膜)的成骨转化,因而有理由推测 CKLF1 可能在 AS 关节病理性骨化过程中发挥重要作用。
综合以上研究结果表明,CKLF1 能促进 AS 髋关节滑膜成纤维细胞增殖和致炎性细胞因子分泌,增强其成骨转化相关靶基因的转录,推测 CKLF1 在 AS 关节周围成纤维细胞成骨转化至病理性骨化过程中可能发挥重要作用。因而,继续深入研究 CKLF1 和成骨相关信号通路之间的相互作用关系及其在关节病理性骨化动物模型中的作用及机制,为靶向 CKLF1 信号防治 AS 关节病理性骨化与强直提供新的理论基础。

