甘草次酸保肝功效的通路作用机制
杨晓宇,苏秀兰
(内蒙古医科大学附属医院临床医学研究中心,呼和浩特 010050)
甘草(Glycyrrhiza uralensis Fisch)属多年生草本,是一种广受欢迎的中草药,其根和根茎具有多种药用价值,是近2000年来广泛使用的传统药物之一[1,2]。由于甘草在调节草药性质和促进排毒方面具有一定作用,因此,在具有一定毒性作用药物的应用中常将甘草加入减毒。
甘草次酸[3](glycyrrhetinic acid,GA)是甘草的主要成分,由甘草酸水解脱去糖酸链而形成。GA具有抗过敏,抗病毒和抗炎活性;可以调节胰岛素分泌并改善葡萄糖耐量;GA还可抑制原癌细胞的信息传递和基因表达。甘草次酸对多种致癌物诱导的实验动物恶性肿瘤均有抑制作用。甘草次酸还具有抗病毒感染的作用,对致癌性的病毒如肝炎病毒,EB病毒及艾滋病毒的感染均有抑制作用。
以往的研究表明,GA在几种肝损伤模型中具有肝保护作用[4],如游离脂肪酸诱导的肝脏脂毒性,四氯化碳诱导的肝损伤和胆汁酸引起的肝毒性[5,6]。然而,目前还没有关于GA在不同信号通路中发挥保肝作用可能机制的报道。
肝炎是全球死亡的主要原因之一,其由各种肝毒性物质引起。 它可导致肝纤维化,肝硬化并增加肝细胞癌的发生率。目前对肝炎的药物治疗常常受到有效性和安全性的限制。因此,尤其是从天然产物中发现副作用小的制剂是全世界范围的焦点。几项临床研究报道,GA可有效治疗各种类型的炎症(主要在肝),还包括肺、肾、肠和脊髓。 GA最常见的用途是治疗肝病,包括GA可显著降低肝细胞脂肪变性和坏死,抑制间质炎症和肝纤维化,促进细胞再生。GA具有很少的副作用,因此被认为是值得关注和治疗肝病的药物[7]。
爆发性肝损伤(fulminant hepatic failure,FHF),又称爆发性肝衰竭,是一种危及生命的临床综合征,伴随着与肝酶升高、肝性脑病、凝血病和多器官功能衰竭相关的肝细胞功能急剧下降。急诊肝移植可以有效治疗FHF,但移植后的结果与受者年龄、移植前疾病的严重程度以及所用移植物的性质有关。因此找到有效的治疗方法来稳定和延缓FHF的发展至关重要。GA的作用已经日益引起研究人员及临床工作者的关注。
1 GA通过NF-κB和p-38 MAPK信号通路发挥保护作用
普遍认为NF-κB信号通路的激活在急性肝损伤过程中起着至关重要的作用。对利用D-Gal / LPS(D-半乳糖/脂多糖)建立的急性肝炎模型组织病理学分析发现NF-κB可增强与DNA结合活性。NF-κB在调节全身性炎症中发挥重要作用,其活化受核因子κB抑制蛋白(nuclear factor-kappa B,IkB)激酶(IKK)复合物控制。在炎症过程中,IkB磷酸化的诱导通过泛素-蛋白酶体系统导致IkB降解,游离的NF-κB然后转位至细胞核并与其靶基因的结合位点结合,如iNOS和TNF-a,从而促进基因表达和许多炎症介质的释放[8]。其中,促炎细胞因子TNF-α、iNOS和环氧化酶-2(COX-2)释放级联在肝损伤的发病和发展过程中起着关键作用[9]。
NF-κB是炎症过程中的关键信号分子,导致一系列炎症反应和许多促炎性细胞因子释放,从而扩大炎症级联并导致FHF损伤。目前的研究结果表明,在异甘草酸镁(magnesium Isoglycyrrhizinate,MgIG)与D-Gal/LPS诱导的肝脏炎症中,NF-κBp65蛋白水平降低,而GA可以显著改善肝脏炎性环境,表明NF-κB活化的抑制至少部分与GA的抗炎活动相关。p38-MAPK可以激活多种炎症反应的转录因子和信号转导蛋白[10],如NF-κB,可能在调节炎症信号转导中发挥关键作用[11]。例如,p38-MAPK可通过控制NF-κB活化来调节D-GalN/ LPS诱导的炎症过程。细胞外信号调节激酶,c-Jun N-末端激酶(JNK)和p38-MAPK构成MAPK家族[12]。MAPKs特别是p38-MAPK的持续激活可能在调节炎症信号转导尤其是NF-κB信号通路中发挥重要作用[13]。在D-Gal / LPS诱导急性肝脏炎症的研究中,GA可以激活p38-MAPK激酶减弱D-Gal / LPS诱导的炎性反应从而启动 NF-κB 信号通路来表现出抗炎作用。
AP-1和NF-κB是调节细胞因子如TNF-α,IL-6和IL-8表达的关键转录因子,TNF-α反过来促进AP-1和NF-κB的活化,从而使信号通路有可能扩增。AP-1在MAPK信号传导的下游[14],其包括细胞外受体激活的激酶(ERK),c-jun N端激酶(JNK)和p38。然而,p38是涉及LPS信号传导的主要MAPK家族成员,并负责调节炎性细胞浸润,细胞凋亡和坏死。重要的是,巨噬细胞中TNF-α[15]的表达需要p38 MAPK的表达,GA可以抑制巨噬细胞中AP-1和NF-κB的LPS诱导的启动子活性。另外,GA预处理显著抑制了肝组织中p-p38 MAPK和p-IκB的升高。由此表明,GA可以有效抑制LPS激活的p38 MAPK和NF-κB信号通路[16]。
2 GA通过HMGB1-TLR4信号通路发挥保护作用
TLR4 / MD2复合物识别LPS是LPS / D-GalN诱导的FHF的起始事件。TLR4是一种跨膜受体蛋白,主要位于肝脏中巨噬细胞和枯否细胞的表面,已知它是分泌TNF-α并驱动FHF的关键细胞。 由IRAK-1、IRAK-2、IRAK-4和IRAK-M组成的IRAK家族在TLR4介导的信号传导中起关键作用。在这些分子中,IRAK-1和IRAK-4两种被磷酸化激活的活化激酶可引起NF-κB和MAPKs信号通路的激活。IRAK-1或4缺陷小鼠对内毒素的致死作用具有抗性,IRAK-1或缺陷型巨噬细胞对LPS不敏感,TNF-α产生减少[17]。在TLR4触发后,TLR4开始将IRAK-4募集到MyD88,随后它们被招募到复合物中,然后引起IRAK-4自磷酸化和IRAK-1和IRAK-2的磷酸化。此外,一旦磷酸化,IRAK-1与TRAF6相互作用,将MyD88解离,转移到细胞质以激活下游信号通路[16]。因此,有人假设GA的保护作用会影响IRAK-1的活性。GA抑制IRAK-1和TRAF6之间的LPS诱导的相互作用,但不影响IRAK-1的表达,表明GA的分子靶标可能涉及IRAK。事实上,除了两种活性激酶之外,IRAK-2也是控制TLRs信号通路的重要激酶,但其作用仍有争议。众所周知,白细胞介素1受体相关蛋白激酶M抗原(interleukin 1 receptor associated protein kinase M antigen, IRAKM)是发挥TLR4信号传导负调控因子的关键失活激酶。IRAK-M可抑制IRAK4从MyD88的解离并阻止IRAK-1 / TRAF复合物的形成。IRAK-M的上调与内毒素耐受性密切相关,内毒素耐受是抵抗细菌感染的关键保护机制,IRAK-M敲除小鼠更容易受到细菌感染。研究发现GA在体内和体外均可上调IRAK-M的表达。然而,IRAK-M的表达也可以被一些炎症刺激因子如LPS,TNF-α上调。有研究显示沉默巨噬细胞中的IRAK-M基因表达,GA预处理未能抑制IRAK-M缺陷型巨噬细胞中LPS诱导的信号传导,表明GA对抗LPS / D-GalN诱导的FHF的潜在保护机制与IRAK-M的上调相关。这一作用也可以解释为什么TLR4和IRAK-1表达水平不受GA影响。
此外,在人和小鼠FHF中,浸润的单核细胞,特别是巨噬细胞,是TNF-α的主要来源。用抗TNF-α抗体治疗阻止LPS / D-GalN诱导的小鼠死亡,TNF-α敲除显著减弱LPS / D-GalN诱导的炎症反应和细胞凋亡,GA通过抑制促炎细胞因子如TNF-α,IFN-α和MIP-1α来缓解痤疮丙酸杆菌和LPS诱导的急性肝损伤。这些研究结果均提示IRAK-M可能是GA保肝作用的关键分子靶点。同时,作为重要的内源性损伤相关分子模式(damage associated molecular patterns,DAMPs),高迁移率族蛋白1(high mobility group box-1 protein,HMGB1)由坏死和凋亡的肝细胞释放,并激活先天免疫TLR4信号通路[18]。坏死肝细胞释放的细胞因子和DNA,可与相应的模式识别受体结合,激活初始免疫系统并释放过量炎症介质,最后导致严重肝损伤,GA可以与HMGB1受体竞争性结合从而使HMGB1-TLR4失活达到保肝功效。
3 GA通过Nrf2 / ARE信号通路发挥保护作用
在药物引起的肝毒性中,氧化应激伴随着氧化还原敏感的转录因子核E2相关因子2(Nrf2)的抑制。已报道GA通过激活Nrf2途径来防止大鼠中的环磷酰胺诱导的肝毒性。正常情况下,Nrf2锚定在细胞质中。氧化应激导致Nrf2从细胞质转移到细胞核,激活多个细胞保护基因[19]。Nrf2通路现在被认为是一种重要的抗氧化信号通路[20],它也参与减轻炎症反应,如下调NF-κB通路和炎性细胞因子包括TNF-α,IL-1β和IL-6[21]。有研究表明GA可以通过Nrf2途径保护HepG2细胞免于TP诱导的氧化应激,是由于GA可以通过特异性抑制还原型辅酶 II (nicotinamide Adenine Dinucleotide Phosphate, NADPH) 氧化酶的活性减少ROS类物质释放,以及调节 PI3K/AKT信号通路,最终降低凋亡细胞比例[22]。
活性氧(ROS)诱导的细胞损伤是肝损伤的重要机制。ROS是含氧的高反应性分子,可以修饰DNA和蛋白质。在正常条件下,ROS通过抗氧化防御系统平衡,包括SOD和谷胱甘肽过氧化物酶(GSHPX)。当氧化剂和抗氧化剂之间发生不平衡时,就会达到氧化应激。Nrf2是一种重要的转录因子,通过肝脏中的抗氧化反应元件(ARE)调节一系列解毒和抗氧化防御基因表达[23]。Nrf2控制数百个ARE依赖基因的基础和诱导表达,以调节氧化剂暴露的生理和病理生理学结果。 许多研究证明,Nrf2可阻止肝脏中的各种肝脏毒性物质,Nrf2信号通路是保护肝脏免受乙醇等物质诱导的损伤的重要靶点[24]。例如,在细胞受到有害物质刺激后, Nrf2会特异性转运至细胞核,然后上调血红素加氧酶1(hemeoxygenase-1,HO-1)、谷氨酸-半胱氨酸连接酶催化(GCLC)、谷氨酸半胱氨酸连接酶修饰物(GCLM)和醌氧化还原酶(NQO1),从而达到保护细胞的作用[25];当细胞被ROS或其他亲核试剂刺激时,Nrf2与Keap1解偶联,活化的Nrf2被转运到细胞核中,激活靶基因的表达,调节II期代谢酶,抗氧化酶的转录活性或药物转运蛋白,从而发挥抗氧化损伤[26]。
Nrf2 / ARE信号通路在肝病理生理学中的作用以及Nrf2作为治疗靶点治疗病毒性肝炎、酒精性和非酒精性肝病以及纤维化的潜在应用已有详细报道。几种天然抗氧化剂不仅通过清除自由基,而且通过Nrf2信号通路增强细胞保护性和/或抗氧化基因的表达来发挥保肝作用。通常,Nrf2通过Kelth样ECH相关蛋白1(Keap1)被束缚在细胞质中,用于随后的蛋白酶体降解。在诱导物刺激下,Nrf2从Keap1解离并转移到核中,在核中它结合编码许多抗氧化酶和II期解毒酶的靶基因的ARE[27]。这将导致激活II期解毒酶,如谷胱甘肽-S-转移酶(GST)[28]、NQO1、HO-1,可有效保护哺乳动物细胞免受各种毒物的伤害。
4 结语
已有大量研究表明,GA可以通过调节肝脏疾病的各种分子途径来发挥其保护肝脏的功能。本文总结了GA通过不同信号通路发挥保肝作用的机制(图1),预计未来的多学科联合研究将有助于确定肝损伤的各种分子机制和靶点。目前,用GA进行多中心、大样本、随机、双盲的临床试验数量非常有限,仍然需要广泛的临床研究来评估GA单独使用或联合配伍使用的安全性和化学预防功效。
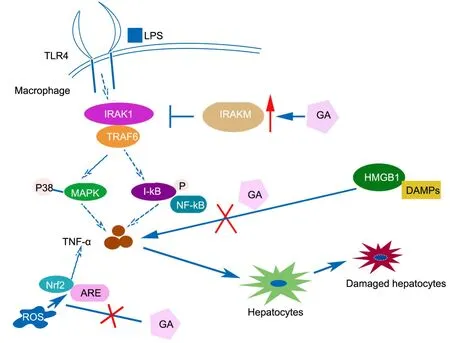
图1 GA在不同信号通路中的作用示意图Fig. 1 Diagram showing the role of GA in different signaling pathways

