ERK1/2信号通路活化对Tamoxifen所致胶质瘤细胞凋亡的影响
田 芬,武慧姣,谢富康*,李朝红*
(1.中南大学湘雅医院生殖医学中心,中国湖南长沙410008;2.中山大学中山医学院组织学与胚胎学教研室,中国广东广州510080)
促分裂原活化的蛋白激酶(mitogen-activated protein kinases,MAPKs)信号通路是哺乳动物细胞内广泛存在的一类丝/苏氨酸蛋白激酶。该信号通路有3个主要的家族成员,分别为细胞外信号调节激酶(extracellular signal-regulated kinase,ER-K1/2)、c-Jun N端激酶(c-Jun N-terminal kinase,JNK)和p38。MAPKs信号通路能够参与调控多种癌细胞增殖、分化及凋亡等重要的生物学反应[1~2]。其中,ERK1/2信号通路能够介导不同胞外刺激调控癌细胞凋亡[2~5],然而其具体作用机制仍有待进一步研究。
胶质瘤是中枢神经系统最常见的致死性肿瘤,约占所有颅内肿瘤的40%[6]。胶质瘤多呈弥漫性和侵润性生长,与正常脑组织边缘分不清,具有高发病率、高死亡率、高复发率和低治愈率等特点。虽然目前临床仍以手术方法为主治疗胶质瘤,但是由于脑功能的特殊性,化疗在胶质瘤治疗中起着越来越重要的作用。现已证实术后化疗能延长患者的生存时间和提高患者的生存率[7~8]。他莫昔芬(tamoxifen,TAM)即三苯氧胺,为非固醇类三苯乙烯衍生物,是强有力的雌激素受体(estrogen receptor,ER)拮抗剂,广泛应用于ER阳性的乳腺癌、子宫内膜癌等的治疗。近年来研究发现,TAM也能用于ER阴性的肿瘤化疗,其中包括神经胶质瘤[9~10]。越来越多的研究表明TAM能抑制胶质瘤细胞增殖和诱导凋亡[11~12],然而其具体的分子作用机制尚不明确。
本研究以C6和U87MG胶质瘤细胞为研究对象,观察MAPKs信号通路活化对TAM所致C6和U87MG胶质瘤细胞凋亡的作用,初步探讨TAM诱导C6和U87MG胶质瘤细胞凋亡的信号转导机制,为TAM作为胶质瘤的辅助性化疗用药提供理论依据。
1 材料与方法
1.1 材料与试剂
C6和U87MG胶质瘤细胞由中山大学附属肿瘤医院黄文林教授惠赠;TAM、MTT、DAPI、PD9-8059和琼脂糖购自美国Sigma-Aldrich公司;胎牛血清、RPMI-1640培养基和胰酶购自美国Gibco公司;RIPA裂解液、蛋白酶磷酸酶抑制剂混合物和Annexin V-FITC细胞凋亡试剂盒购自碧云天生物科技有限公司;BCA法蛋白质含量测定试剂盒和ECL化学发光液购自美国Millipore公司;DNA抽提试剂盒购置北京天根生化科技有限公司;兔抗p-ERK1/2、兔抗ERK1/2和兔抗β-actin购自Cell Signaling Technology公司;辣根过氧化物酶标记的山羊抗兔购自美国Santa Cruz Biotechnology公司。
1.2 MTT检测
将复苏后的C6和U87MG胶质瘤细胞用含10%胎牛血清的RPMI-1640培养液培养至生长对数期,胰酶消化并制备细胞悬液;将200 μL C6和U87MG胶质瘤细胞悬液(含2×103个细胞)加入96孔板中,培养24 h后进行以下分组处理。实验组:用细胞培养基稀释4 000 μmol/L TAM母液至终浓度为 1 μmol/L、10 μmol/L、20 μmol/L、30 μmol/L、40 μmol/L的TAM工作液;阴性对照组(NC组):细胞培养基中加入等体积的二甲基亚砜(dimethyl sulfoxide,DMSO)。将分组细胞放入37℃、5%CO2培养箱中分别培养12 h、24 h和48 h,随后每孔加入20 μL MTT溶液,混匀后继续培养4 h;吸去带MTT溶液的培养基后加入150 μL DMSO,摇床轻微振荡10 min,于酶标仪490 nm处测定其吸光度值(OD值)。根据以下公式计算细胞存活率:细胞存活率(%)=(实验组OD值/对照组OD值)×100%。
1.3 DAPI染色检测细胞核形态
取处于对数生长期的C6和U87MG胶质瘤细胞接种于6孔培养板(内含爬片)中,常规培养24 h后进行以下分组处理。实验组:用细胞培养基稀释4 000 μmol/L TAM母液至终浓度为1 μmol/L、10 μmol/L、20 μmol/L、30 μmol/L 的 TAM 工作液;阴性对照组(NC组):细胞培养基中加入等体积的DMSO。将分组细胞放入37℃、5%CO2培养箱中培养24 h后取出爬片,PBS缓冲液洗两遍;4%多聚甲醛固定10 min,吸去固定液,PBS缓冲液洗两遍;加入DAPI染色液室温避光孵育10 min,PBS缓冲液洗两遍,随后加甘油封闭并置于荧光显微镜下观察C6和U87MG胶质瘤细胞核的形态。
1.4 流式细胞术检测细胞凋亡
C6和U87MG胶质瘤细胞经1μmol/L、10μmol/L、20 μmol/L、30 μmol/L TAM 溶液处理 24 h 或经PD98059预处理15 min再用30 μmol/L TAM溶液作用24 h后,收集细胞,用预冷的PBS缓冲液重悬细胞并计数。吸取1 mL细胞悬液(约1×105个细胞),离心去上清液,先加入195 μL Annexin VFITC结合液重悬细胞,随后再加入5 μL Annexin V-FITC,轻轻混匀;加入10 μL碘化丙啶(propidium iodide,PI),轻轻混匀,室温避光孵育20 min后于流式细胞仪上检测细胞凋亡。每个样品重复3次。
1.5 Western-blot检测ERK1/2的活化
C6和U87MG胶质瘤细胞经30 μmol/L TAM作用 5 min、15 min、30 min、60 min,或经 PD98059预处理15 min再用30 μmol/L TAM作用24 h,随后收集细胞。用含有蛋白酶磷酸酶抑制剂的RIPA裂解液裂解细胞,收集细胞总蛋白质,然后采用BCA法进行蛋白质定量。蛋白质样本变性处理后,以每孔40 μg上样,进行聚丙烯酰胺凝胶电泳。将电泳条带转移到PVDF膜上,用5%脱脂牛奶室温封闭60 min,随后加入相应一抗,4℃孵育过夜;次日,用TBST漂洗3次,每次10 min,然后用辣根过氧化物酶标记的二抗室温孵育2 h,漂洗后ECL化学发光法显影,暗室曝光到X光胶片上。采用凝胶成像系统拍摄,并使用Gene Genius Bioimaging System对所存图像进行定量分析。
1.6 统计学方法
采用SPSS 16.0进行统计分析,实验数据以均值±标准差(±s)表示,多样本间比较采用单因素方差分析(one-way ANOVA),以P<0.05表示差异具有统计学意义。
2 结果
2.1 TAM能抑制胶质瘤细胞活性
不同浓度TAM处理C6和U87MG胶质瘤细胞12 h、24 h和48 h后,采用MTT法检测其细胞活性。结果显示,随着TAM浓度增加和作用时间延长,细胞活性逐渐被抑制,并呈浓度和时间依赖性。1~40 μmol/L TAM处理C6和U87MG胶质瘤细胞12 h、24 h和48 h后,C6胶质瘤细胞的半抑制浓度(half maximal inhibitory concentration,IC50)值分别是 39.78 μmol/L、29.48 μmol/L、16.05 μmol/L,U87MG胶质瘤细胞的IC50值分别是45.45 μmol/L、30.72 μmol/L、21.41 μmol/L(图 1A)。另外,随着30 μmol/L TAM处理时间的延长,细胞逐渐变圆、皱缩,细胞贴壁特性也逐渐丧失,并出现细胞漂浮现象(图 1B)。
2.2 TAM能诱导胶质瘤细胞凋亡
我们通过DAPI染色法和Annexin V-FITC/PI染色法来确定TAM是否能够诱导胶质瘤细胞发生凋亡。DAPI染色实验结果显示,对照组细胞核完整并被染成均一的淡蓝色;不同浓度的TAM处理C6和U87MG胶质瘤细胞24 h后,细胞核呈现不同程度的凋亡形态特征,表现为核大小不一、固缩、碎裂、染色增强,且其凋亡呈浓度依赖性(图 2)。
Annexin V-FITC/PI染色法实验的结果也表明,与对照组相比,20~30 μmol/L TAM处理C6和U87MG胶质瘤细胞24 h后其凋亡率明显增高并呈浓度依赖性,而10 μmol/L TAM组的凋亡率未见明显增高(图3)。以上结果提示TAM能够明显地诱导胶质瘤细胞凋亡。
2.3 TAM能增加ERK1/2磷酸化水平
我们采用 Western-blot检测经 30 μmol/L TAM处理不同时间后C6和U87MG胶质瘤细胞中的ERK1/2磷酸化水平。实验结果表明,TAM处理15 min时,ERK1/2磷酸化水平显著增高(P<0.05),但在接下来的15 min内,其磷酸化水平迅速下降,然后随着TAM处理时间延长,其磷酸化水平又略有上升趋势(图4)。此结果表明TAM在短时间内能够激活ERK1/2信号通路。
2.4 ERK1/2抑制剂能降低TAM所致ERK磷酸化水平增高
我们采用ERK1/2抑制剂(PD98059)预处理C6和U87MG胶质瘤细胞15 min,随后加入30 μmol/L TAM处理24 h,然后采用Western-blot检测ERK1/2磷酸化水平。实验结果发现,与对照组相比,PD9-8059单独处理组中的ERK1/2磷酸化水平明显下调(P<0.05),而TAM单独处理组中的ERK1/2磷酸化水平明显升高(P<0.05);PD98059+TAM组与TAM单独处理组相比,ERK1/2磷酸化水平显著降低(P<0.05,图5)。以上结果提示,PD98059对TAM所致的ERK1/2磷酸化水平增高有明显的抑制作用。
2.5 抑制ERK1/2信号通路能增加TAM诱导的细胞凋亡
为了探讨ERK1/2信号通路在TAM所致C6和U87MG胶质瘤细胞凋亡中的作用,我们采用PD98059预处理细胞15 min,随后加入30 μmol/L TAM处理24 h,然后用Annexin V-FITC/PI染色法检测其细胞凋亡。实验结果显示,与对照组相比,PD98059单独处理组的细胞凋亡率未见明显变化,而TAM单独处理组的细胞凋亡率明显增高(P<0.05);PD98059与TAM联合处理比TAM单独处理的细胞凋亡率更高(P<0.05,图6)。由此说明ERK1/2信号通路参与介导TAM诱导的胶质瘤细胞凋亡。

图1 TAM对胶质瘤细胞活性的影响(A)C6和U87MG胶质瘤细胞经不同浓度TAM作用12 h、24 h和48 h后,细胞存活率的统计分析;(B)C6和U87MG胶质瘤细胞经30 μmol/L TAM作用12 h、24 h和48 h后,细胞形态学观察结果。*表示与NC组相比,P<0.05。Fig.1 Effect of TAM on glioma cell viability(±s,n=3)(A)Statistical analysis of survival rates of C6 and U87MG glioma cells treated with various concentrations of TAM for 12 h,24 h and 48 h;(B)The morphological observation of C6 and U87MG glioma cells treated with 30 μmol/L TAM for 12 h,24 h and 48 h.*Compared with NC group,P<0.05.
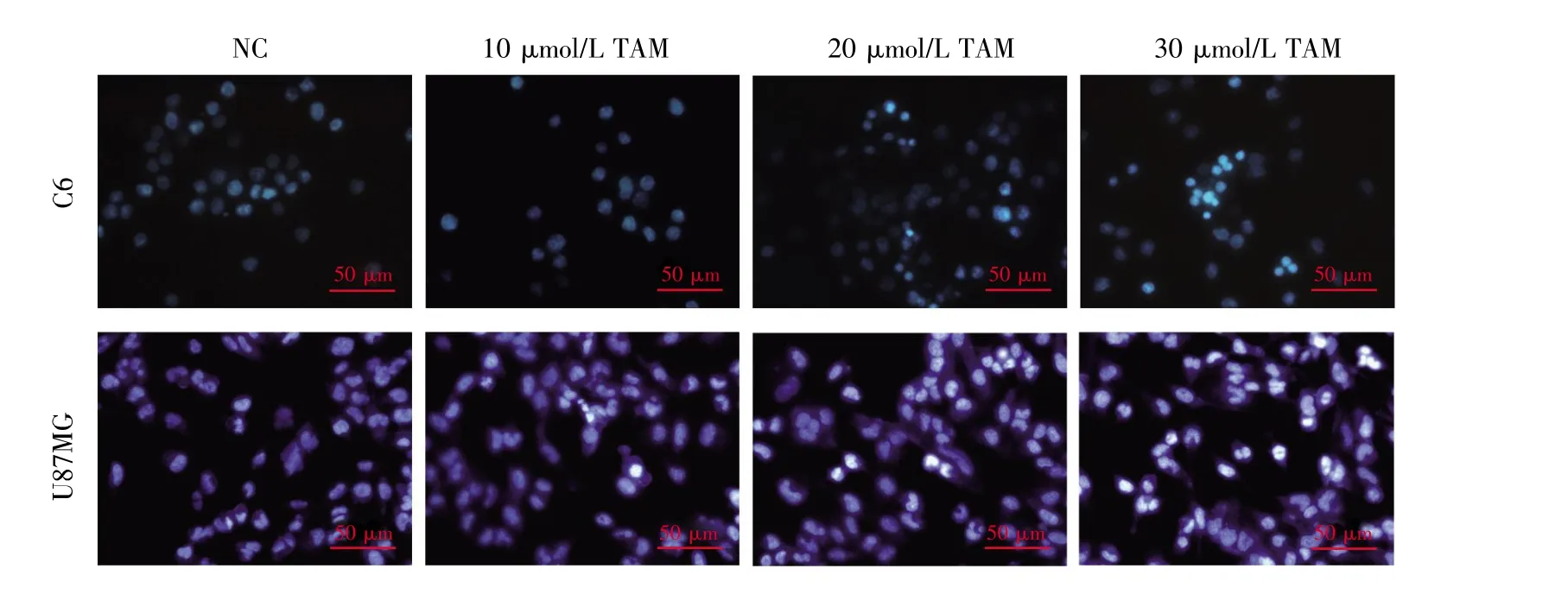
图2 不同浓度TAM处理C6和U87MG胶质瘤细胞24 h后细胞核形态学的观察结果Fig.2 The morphological observation of nuclei of C6 and U87MG glioma cells treated with various concentrations of TAM for 24 h
3 讨论
越来越多的研究表明,多种信号通路参与调控TAM诱导的细胞凋亡和耐药性[13~14]。本研究表明,TAM能够诱导胶质瘤细胞凋亡和激活ERK1/2信号通路;ERK抑制剂能与TAM共同作用,促进TAM诱导的细胞凋亡。

图3 不同浓度TAM处理C6和U87MG胶质瘤细胞24 h对其凋亡水平的影响*与 NC 组相比,P<0.05。Fig.3 Effects of various concentrations of TAM on the apoptosis of C6 and U87MG glioma cells after treatment for 24 h(±s,n=3)*Compared with NC group,P<0.05.
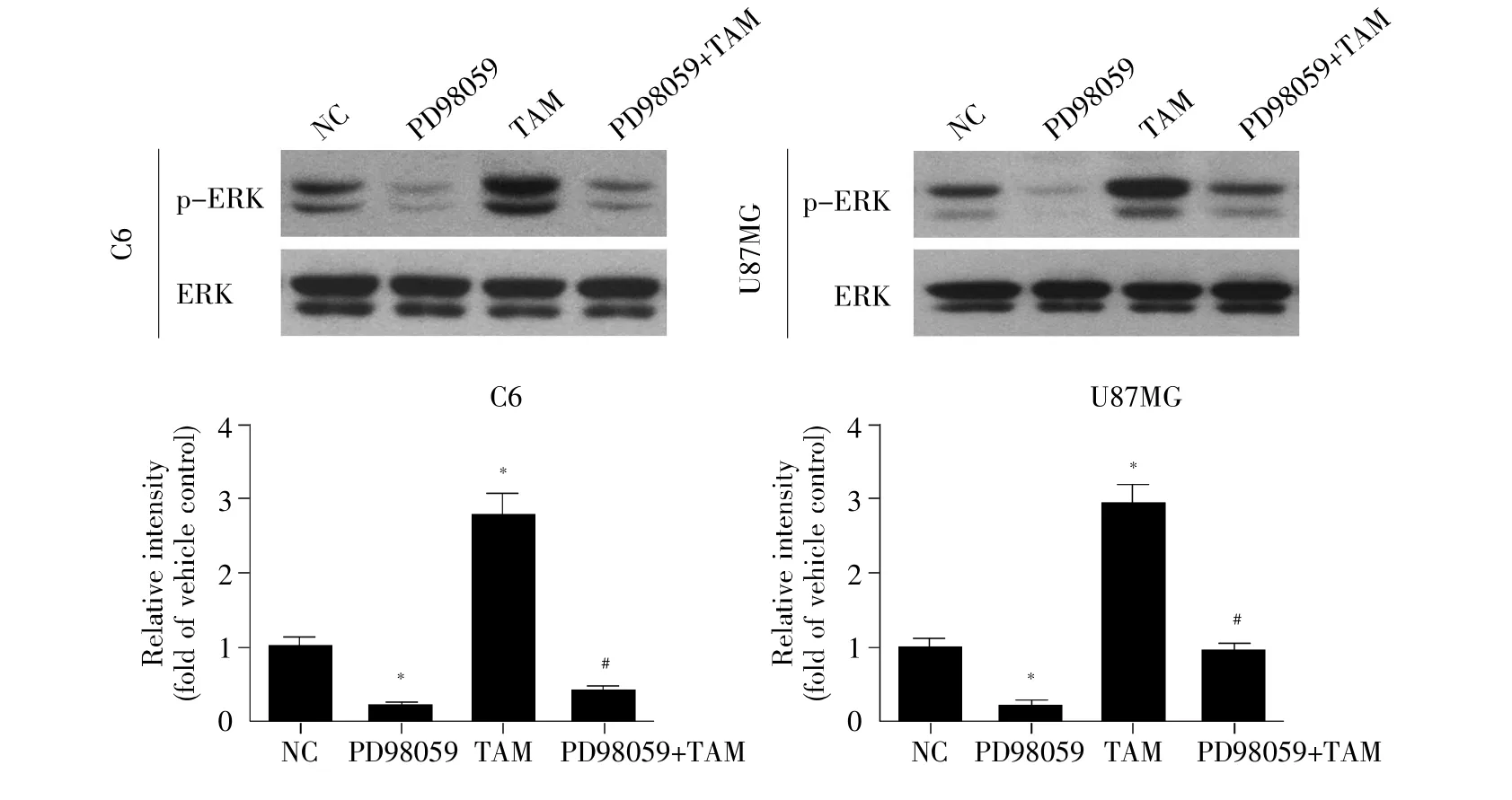
图5 TAM和PD98059联合作用对ERK1/2磷酸化的影响*与 NC 组相比,P<0.05;#与 TAM 组相比,P<0.05。Fig.5 Effect of TAM and PD98059 on phosphorylation of ERK1/2 in C6 and U87MG glioma cells after treatment for 24 h(±s,n=3)*Compared with NC group,P<0.05;#Compared with TAM group,P<0.05.
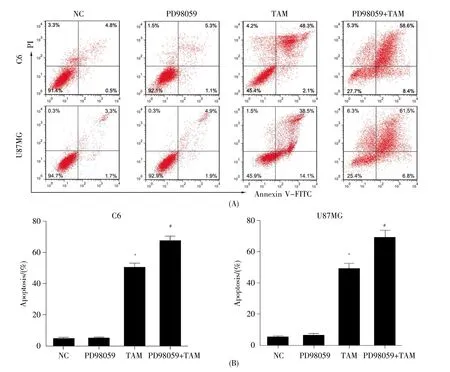
图6C6和U87MG胶质瘤细胞经TAM和PD98059联合作用后的凋亡水平*与 NC 组相比,P<0.05;#与 TAM 组相比,P<0.05。Fig.6 The apoptosis of C6 and U87MG glioma cells co-treated with TAM and PD98059(±s,n=3)*Compared with NC group,P<0.05;#Compared with TAM group,P<0.05.
TAM作为抗肿瘤药物,现已被应用于ER阳性的乳腺癌的治疗,临床上能显著改善患者预后[15]。其主要作用机制是,通过与天然雌激素竞争性结合雌激素受体阻断雌激素诱导的增殖信号,从而抑制细胞增殖和诱导细胞凋亡[16]。近年来研究发现,TAM也能通过ER非依赖的途径诱导细胞凋亡。神经胶质瘤是一种非激素依赖性肿瘤,TAM对该肿瘤的作用一般是经ER非依赖的途径来实现。相关的体内外研究表明,TAM能阻碍胶质瘤细胞生长,并且促进细胞凋亡[17]。我们的实验结果也验证了这一点,TAM能抑制胶质瘤细胞的活性(图1),提高细胞的凋亡率(图2、图3),并伴随着ERK1/2磷酸化水平增加(图4)。
ERK1/2属于MAPKs家族成员之一,根据相对分子质量的大小分为ERK1和ERK2两种类型。在细胞静息状况下,ERK处于胞浆内,一旦受到一些生长因子、药物等生物因素或放射线、高温高压等物理因素的激活,会迅速地穿过核膜进入核内,并激活下游转录因子,从而导致细胞产生相应的生物学效应。已有文献报道,ERK1/2信号通路在骨肉瘤、食道癌、卵巢癌、乳腺癌等多种恶性癌细胞中可被各种机制所激活,从而促进癌细胞增殖,抑制细胞凋亡[18~21],提示ERK1/2信号通路在细胞恶性转化过程中起到至关重要的作用。同时,体外实验研究表明,ERK1/2信号通路的活化能够诱导胶质瘤细胞凋亡,并抑制细胞增殖[22]。我们的实验结果表明,PD98059(ERK1/2抑制剂)能增加TAM诱导的胶质瘤细胞凋亡(图5、图6)。然而,这一结论与TAM诱导细胞凋亡和增加ERK磷酸化水平的结果(图2~4)似乎相矛盾。我们分析可能是由于TAM能在短时间内快速激活ERK,反应性保护细胞,抑制其诱导细胞凋亡的作用;但是随着TAM浓度的增加,细胞内其他促凋亡信号途径将被激活,这些促凋亡信号途径逐渐占据优势,最终导致细胞凋亡。
综上所述,本研究表明MAPKs家族中ERK1/2信号通路的激活参与了TAM对胶质瘤细胞的凋亡诱导作用,为TAM治疗胶质瘤提供了重要的实验依据。

