子宫内膜异位症相关性卵巢透明细胞癌与子宫内膜样癌的临床及预后特点
孙婷婷,王姝,刘玉婷,郎景和
(中国医学科学院 北京协和医学院 北京协和医院妇产科,北京 100730)
子宫内膜异位症是妇科最常见的良性疾病之一,但子宫内膜异位症有恶变潜能,与某些卵巢癌密切相关[1-3]。近年来一系列流行病学研究显示,子宫内膜异位症患者患卵巢癌的风险与普通人群相比显著升高,尤其是卵巢透明细胞癌(OCCC)及卵巢子宫内膜样癌(OEC)[3-4]。因此有学者认为子宫内膜异位症可能是OCCC及OEC的“癌前病变”[2]。既往有研究报道,子宫内膜异位症相关性卵巢癌(EAOC)的临床及预后特点不同于其他上皮性卵巢癌,EAOC可能是一种特殊的上皮性卵巢癌[5-6]。然而,子宫内膜异位症相关性卵巢透明细胞癌、卵巢子宫内膜样癌在临床特点及预后上是否存在相似或不同之处、这两种肿瘤是否可看作一个整体,却少有相关研究。因此,本研究在EAOC人群中分析并比较子宫内膜异位症相关卵巢透明细胞癌(EAOCCC)与子宫内膜异位症相关卵巢子宫内膜样癌(EAOEC)的临床及预后特点,旨在阐明两者之间的差别并对EAOC患者的诊疗提供参考依据。
资料与方法
一、研究对象
回顾性分析2000年1月至2012年12月间在我院妇产科就诊并接受手术治疗的上皮性卵巢癌患者的临床及病理资料,随访截止至2017年3月。术后病理诊断均由经验丰富的病理医师复核。根据术后病理报告,所有上皮性卵巢癌患者中共有121 例OCCC患者及188例OEC患者。
根据病理报告,研究纳入符合EAOC诊断、术后定期随诊及随访信息齐全的患者,排除合并其他卵巢上皮性肿瘤成分、临床病理信息不全及术后失访者。经过上述标准筛选后,研究共纳入69例EAOC患者,其中包括37例EAOCCC及32例EAOEC患者。
二、方法
1.随诊回顾:69例EAOC患者自初次治疗结束后均定期门诊随诊。每次门诊复诊,由有经验的妇科肿瘤医师做盆腔妇科检查,血清肿瘤标记物检查包括血CA125或其他既往曾升高的肿瘤标记物、盆腹腔超声,必要时复查胸部X片、CT、MRI 和(或) PET/CT。通过门诊随访或电话随访方式获取患者术后生存情况及末次随访时的疾病状态,随访截止时间为2017年3月。
2.分析指标:收集上述69例EAOC患者的临床/病理资料,包括年龄、月经状况、首发症状、孕产次数、既往内科合并症、术前CA125水平、FIGO分期、肿瘤大小及侧别、合并妇科其他良性肿瘤或疾病情况、手术切净程度,以及术后是否化疗、化疗方案疗程及是否耐药,详见表1。
3.判定标准:化疗耐药定义为末次化疗结束后6个月以内出现肿瘤进展或复发。细针穿刺或再次手术获得组织病理学证据和(或)影像学出现新进展被认为是肿瘤复发。患者死于其他疾病或末次随访时仍存活被认为是数据截尾。生存分析内容包括总生存时间(OS)及无病生存时间(DFS)。OS定义为患者从接受初次手术到死亡或末次随访的时间,DFS定义为患者从接受初次手术治疗到出现肿瘤进展/复发的时间。本研究中EAOC的诊断标准为病理确诊的上皮性卵巢癌合并子宫内膜异位症病灶,共存的内异症病灶符合Scott标准诊断,即卵巢肿瘤与子宫内膜异位症同时存在,包括存在于不同侧卵巢,同侧卵巢,或盆腔子宫内膜异位症(如腹膜子宫内膜异位症)。

表1 EAOCCC与EAOEC患者的基本特征及临床病理特点[n(%)]
注:与EAOCCC组比较,*P<0.05;a根据2013年FIGO分期系统进行分期
三、统计学分析
利用SPSS 23.0软件进行统计分析。连续变量通过Mann-Whitney检验进行分析,分类变量通过t检验进行分析。连续变量通过ROC曲线选取最佳截断值(optimal cutoff value)并进行分层。经过单因素分析选取有统计学意义的变量,进一步用逻辑回归模型进行多因素分析。多因素分析中通过Cox风险模型计算校正后的风险比(HR),通过95%置信区间(95%CI)评估校正后的相对风险。生存分析采用未校正的Kaplan-Meier曲线模型评估无复发生存和总生存,并通过log-rank检验进行组间比较。本研究中所有P值均为双侧检验,P<0.05为差异有统计学意义。
结 果
一、患者人口统计学及临床/病理特征
研究共纳入69例EAOC患者,包括37例EAOCCC患者及32例EAOEC患者,患者的人口学特点及临床病理特点见表1。本研究患者平均发病年龄为(45.0±9.0)岁(28~79岁)。发病时未绝经患者居多,占76.81%(53例)。
经ROC曲线分析后,本研究将患者年龄38岁和肿瘤直径5.5 cm作为评估DFS的截断值(图1),两组患者之间基本特征及临床病理特点的对比见表1。EAOCCC组与EAOEC组的发病年龄(45.0 vs. 44.0,P>0.05)及年龄分组(<38或≥38岁)对比无统计学差异(P>0.05);发病时绝经前患者所占比例无统计学差异(P>0.05);两组间未孕或未产患者比例无统计学差异(P>0.05)。
两组患者的首发症状对比均无统计学差异(P>0.05)。但是,EAOCCC组患者术前Ca125水平显著低于EAOEC组(43.7 vs. 207.6 U/ml,P=0.044),且EAOCCC组术前Ca125水平正常患者比例显著高于EAOEC组(40.54% vs. 3.13%,P=0.000 2)。其余因素两组患者间未见统计学差异,如肿瘤大小、肿瘤侧别、FIGO分期、残余病灶、铂类化疗耐药、合并子宫内膜病变及合并高血压或糖尿病等。

A:发病年龄的ROC 曲线;B:肿瘤大小的ROC 曲线图1 年龄及肿瘤直径的ROC曲线
二、患者生存信息
整组患者术后随访的中位时间为67 月,69例患者中共观察到6例(8.70%)肿瘤导致的死亡,其余63例(91.30%)患者在末次随访时均确认为生存状态。死亡病例在EAOCCC组占13.51%(5/37),在EAOEC组占3.13%(1/32),两组死亡患者比例无统计学差异(P>0.05)。EAOCCC组与EAOEC组随访时间相当(72月 vs. 60 月,P>0.05),两组整体生存率无统计学差异(86.49% vs. 96.88%,P>0.05)。EAOCCC组与EAOEC组患者无病生存时间无统计学差异(62 vs. 60月,P>0.05),两组无病生存率(75.68% vs. 81.25%)无统计学差异(P>0.05)。
共15例患者出现术后复发,其中9(9/37)例为EAOCCC组,6(6/32)例为EAOEC组。15例复发患者的中位复发时间为28月,其中EAOCCC组中位复发时间为12月,EAOEC组中位复发时间为33.5月。
在单因素分析中,OS的影响因素包括腹胀、FIGO分期、早期/晚期、单侧/双侧肿瘤、淋巴结转移、残余病灶及化疗耐药(P<0.05)(表2、图2)。而在多因素分析中,DFS的独立影响因素包括年龄、FIGO分期、早期/晚期、淋巴结切除、淋巴结转移、残余病灶及化疗耐药(P<0.05) (表3、图3)。

表2 单因素分析EAOC患者的OS [n(%)]
注:*独立影响因素;组间比较,#P<0.05(详见图2);a根据2013年FIGO分期系统进行分期

A:腹胀;B:早期/晚期;C:FIGO分期;D:肿瘤侧别;E:淋巴结转移;F:残余病灶;G:化疗耐药图2 单因素分析EAOC患者的OS
讨 论
本研究共纳入37例EAOCCC患者及32例EAOEC患者,两组间平均发病年龄、绝经状态、孕次、首发症状、肿瘤大小、肿瘤侧别及合并症等方面均无显著性差异。本研究中I期患者在两组中均占大多数,与Mangili等[7]、Scarfone等[8]及Lim等[9]报道结果一致。根据本研究结果,EAOEC组患者术前Ca125水平显著高于EAOCCC组,而且16例术前Ca125水平正常的患者中,15例为EAOCCC组患者,两组Ca125水平正常患者所占比例显著不同(表1)。近来,Ca125水平在不同上皮性卵巢癌亚型中的诊断及判断预后价值引起热议。既往研究显示,在EAOCCC 患者的诊断及预后判断中Ca125的敏感性和特异性相对较低,尤其对于一直伴有子宫内膜异位症的患者。Babic等[10]报道,在卵巢癌的诊断中合并子宫内膜异位症为术前Ca125水平较低的唯一独立影响因素。本研究结果显示只有1例合并子宫内膜异位症的EAOEC患者术前Ca125水平正常。对于正常位置的子宫内膜病变,本研究中EAOEC组的发生率轻微高于EAOCCC组(12.50% vs. 8.11%)。根据既往研究结果,EAOEC合并子宫内膜癌的发生率为12%~50%[11],显著高于本研究结果。Mogensen等[12]报道子宫内膜异位症患者发生子宫内膜癌的风险显著升高。根据目前结果,EAOC患者中“正位”子宫内膜发生病变的分子生物学价值尚需进一步研究,以探寻正位子宫内膜病变与异位子宫内膜恶变之间的分子学关联。

表3 多因素分析EAOC患者的DFS [n(%)]
注:*独立影响因素;组间比较,#P<0.05(详见图3);a根据2013年FIGO分期系统进行分期
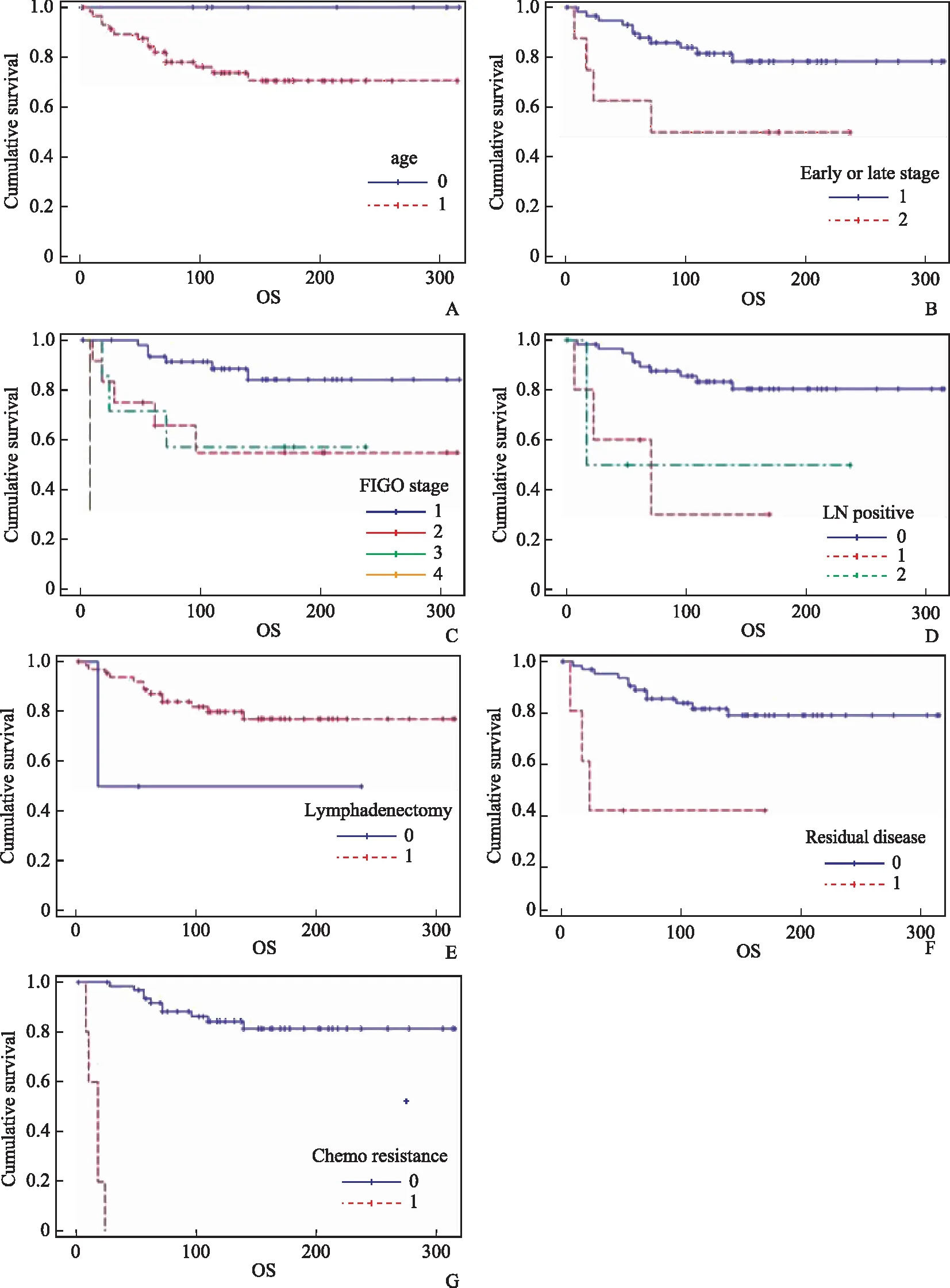
A:年龄;B:早期/晚期;C:FIGO分期;D:淋巴结转移;E:淋巴结切除;F:残余病灶;G:化疗耐药图3 多因素分析EAOC患者的DFS
本研究中共有67例患者术后行以铂类药物为基础的联合化疗,其中5/67(7.46%)例表现出化疗耐药,均来自EAOCCC组,占EAOCCC组患者的13.51%。然而,统计结果显示两组化疗耐药比例无显著性差异(P=0.056 7)。既往研究显示,EAOCCC易对铂类药物形成化疗耐药,进而导致其预后较差[13-15]。本研究首次在EAOC人群中对EAOCCC及EAOEC的化疗耐药情况进行报道,然而,导致EAOC患者化疗耐的分子机制尚需进一步研究。对于此类化疗耐药患者,是否存在特定的分子标志物可帮助临床医师在制定化疗决策前对其进行鉴别,亦需进一步探讨。
本研究中患者术后中位随访时间为67个月,共观察到6例死亡病例,其中5例为EAOCCC组、1例为EAOEC组,两组患者总生存率及中位总生存时间无显著性差异。结果显示,无论EAOCCC或EAOEC,患者均能获得较好的总生存结局。Kuo等[16]报道,EAOC患者在随访时间23~130月内,其总生存率为90.9%(10/11)。本研究中EAOCCC组有9例患者出现复发而EAOEC组有6例,两组中位复发时间分别为12月及33.5月,两组中位无病生存时间及无病生存率均无统计学差异。既往有研究报道,合并子宫内膜异位症的卵巢癌患者OS及DFS较好[17-18]。Barreta等[19]研究了23例EAOCCC患者与27例EAOEC患者的生存结局,合并内异症并不改变EAOEC患者的生存结局,但在EAOCCC患者中,合并内异症组OS较好。由于类似研究均例数较少,未来尚需扩大样本量来进一步研究EAOC中的EAOCCC与EAOEC的临床及预后特点。
前期研究结果显示,EAOCCC患者的临床及预后特点均不同于普通EAOCCC。同样,EAOEC患者特点亦不同于普通EAOEC。因此有学者提出,EAOC应该被看作为一类特殊的卵巢癌。然而,很少有研究致力于探寻这两种肿瘤之间临床及预后特点的相似点及差异性。本研究结果显示EAOCCC与EAOEC之间具有相似的临床特点及相当的生存结局,提示这两类卵巢肿瘤可能具有相同的发病机制。Kajihara等[18]提出:某些EAOCCC可能起源于早期子宫内膜异位病变,这些异位内膜来自于经血逆流的子宫内膜;而HNF-1β表达阴性的EAOEC可能起源于继发性子宫内膜异位症恶变,而这部分内膜来自于体腔间皮化生。还有理论提出,子宫内膜异位症分化为两种组织是一个性激素调控的“双元模型”[20-21]:(1)雌孕激素受体阳性的子宫内膜异位灶受雌激素长期刺激而恶变形成激素依赖性子宫内膜样癌;(2)雌孕激素受体阴性的萎缩性异位子宫内膜受氧化应激长期刺激而恶变形成非激素依赖性透明细胞癌。这些结果及假说可能有助于解释本研究发现的EAOCCC与EAOEC之间的差别,如两组患者之间术前Ca125水平正常的比例不同。但是,很少有学者提出其它假说,EAOC的发病机制尚需进一步研究,以最终阐明子宫内膜异位症恶变的机理。
本研究的优势在于总结了EAOC的临床及预后特点,并在EAOCCC与EAOEC之间进行比较。作为一项回顾性研究,本研究的局限性主要在于回忆偏差及固有选择性偏差。由于每组患者例数较少,研究相关结果结论可能会受到影响,未来需要样本量更大的研究来进一步探讨EAOC相关特征及机制。而由于其发病率较低,大规模研究的实施具有一定挑战性。
本研究结果显示,EAOCCC与EAOEC之间具有相似的临床特征及生存结局,但两者是否可作为一个整体对待仍无法确定。目前研究均为回顾性且样本量较小,未来需要实施大规模前瞻性研究来进一步探究EAOC患者的临床及预后特点。相关分子研究亦需进一步明确EAOC的分子生物学机制,以对子宫内膜异位症恶变的高危患者进行筛查,早期诊断并明确分类,为EAOC患者制定个体化治疗方案。

