活性酵母对仔猪生产性能及血清生化指标的影响
张城,郑建峰,李孝辉
(1.杭州正兴牧业有限公司,浙江 杭州 311301; 2.浙江省农业科学院 植物保护与微生物研究所,浙江 杭州 310021)
仔猪断奶后生产效率下降、腹泻率高等问题严重影响生猪生产效益,饲用高剂量抗生素及氧化锌能提高仔猪生产性能,降低腹泻率,但是长期使用会造成耐药性及环境污染等负面影响,“无抗、低锌”饲粮是畜牧业发展的趋势。益生菌是一种可通过改变宿主肠道菌群而对动物施加有利影响的活性微生物[1],可改善宿主肠道功能,提高免疫[2-3]。酵母是益生菌的一种,被我国农业部批准为允许在饲料中添加的益生菌。大量研究表明,活性酵母能促进动物生产、提高胃肠道消化率、改善肠道菌群、增强机体免疫功能、提高抗应激能力等,具有广阔的研究和发展前景[4-5]。本试验旨在研究饲粮中添加活性酵母对断奶仔猪生产性能,血液免疫、抗氧化力、炎症等指标的影响,为其在断奶仔猪饲粮中的应用提供依据。
1 材料与方法
1.1 材料
活性酵母由浙江省农业科学院植物保护与微生物研究所提供的酿酒酵母,菌数为2×109个·g-1。断奶仔猪由杭州正兴牧业有限公司提供。
血清中免疫球蛋白A(immunoglobulin A,IgA)、免疫球蛋白G(immunoglobulin G,IgG)、免疫球蛋白M(immunoglobulin M,IgM)、炎症因子白介素6(interleukin 6,IL-6)、白介素1β(interleukin 11β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)ELISA试剂盒购自北京华英生物技术有限公司;过氧化氢酶(catalase, CAT)、总抗氧化力(total antioxidant capacity,T-AOC)、二胺氧化酶(diamine oxidase,DAO)、内毒素(lipopolysaccharide,LPS)试剂盒购自南京建成生物科技有限公司。
1.2 处理设计及饲粮
选取48头健康状况良好的体质量(7.42±0.85)kg仔猪(公母各半),同一性别的仔猪按体质量排序,从大到小分成4个区组,每个区组2栏共12头仔猪(公母各半)。每个区组内的2个栏将随机分配到对照组和酵母组中。对照组饲喂基础饲粮,酵母组在基础饲粮中添加0.3%活性酵母,试验期28 d。参考NRC(2012)7~11、11~25 kg仔猪营养需要配置基础饲粮,其组成及营养水平见表1,按试验设计要求配制试验饲粮。
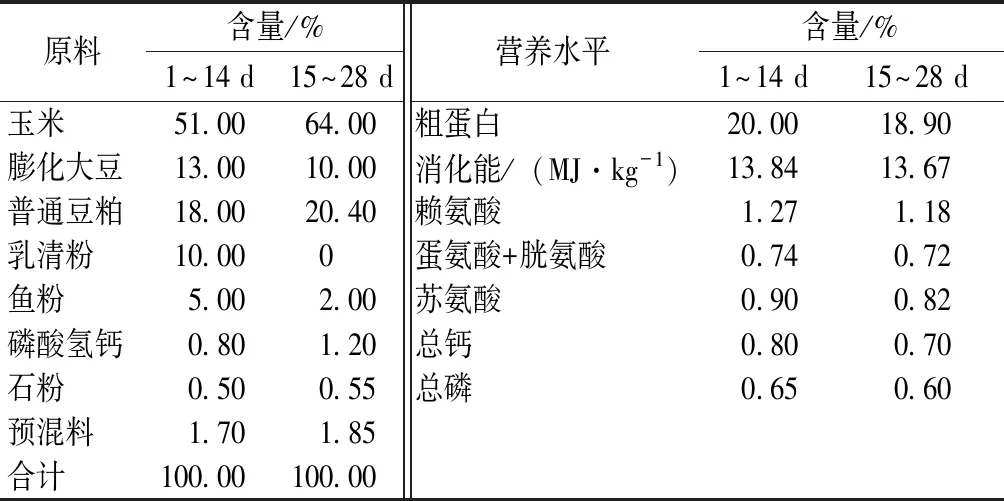
表1 基础饲粮组成及营养水平(风干基础)
注:1)预混料为每1 kg饲粮提供Cu 25 mg(以硫酸铜形式),Zn 100 mg(以硫酸锌形式),ZnO 1 600 mg·kg-1(以氧化锌形式),Fe 100 mg(以硫酸亚铁形式),Mn 30 mg(以硫酸锰形式),Se 0.3 mg(以亚硒酸钠形式),10.4 mg(以碘酸钙形式),VA7 500 IU,VD3750 IU,VE 25 IU,VK32.0mg,VB11.875mg,VB23.75 mg,VB62.19 mg,VB12,0.025 mg,烟酸25 mg,泛酸15.6 mg,叶酸2.0 mg,生物素0.1 875 mg,金霉素75 mg,吉他霉素20 mg。营养水平含量为计算值。
1.3 饲养管理
试验仔猪以重复为单位进行圈养,采用群饲,自由采食和饮水。免疫消毒程序按猪场常规方法进行。试验期观察和记录猪只健康状况,发现死淘猪只后及时进行结料并称重。
1.4 样品采集及测定
1.4.1 生长性能测定
以重复为单位记录耗料量。分别于试验第0、14、28天仔猪空腹称重,统计阶段耗料量及总耗料量。以重复为单位分别计算1~14 d、15~28 d及全期(1~28 d)平均日增重、平均日采食量(ADFI)及料重比(F/G)。
1.4.2 腹泻率测定
试验开始后,每天早晚2次记录试验猪腹泻频数,每栏全期频次数与每栏总头次数之比即为该栏仔猪腹泻率。
1.4.3 血清生化指标测定
试验第28天称重后,每重复随机选择2头仔猪(公母各1头)前腔静脉采血。静置血样至析出血清,3 000 r·min-1离心10 min,分装上清于Eppendorf管中,-20 ℃冰箱中保存,待测。ELISA法测定血清中IgA、IgG、IgM含量。钼酸铵法、FRAP法、硫代巴比妥酸法分别测定血清中CAT、T-AOC、MDA含量。紫外比色法、鲎试剂法、酶比色法分别测定血清中DAO、LPS、MPO含量。ELISA法测定血清中炎症因子IL-6、IL-1β、TNF-α含量。
1.5 统计分析
试验数据用Excel 2007进行初步处理,用SPSS 17.0软件进行差异显著性检验。其中生长性能指标采用以处理为固定因子、区组为随机因子进行一般线性模型分析,血液生化指标进行LSD单因素分析。
2 结果与分析
2.1 活性酵母对仔猪生产性能及腹泻率的影响
试验全期仔猪均较为活跃,精神状态良好,采食及饮水情况均正常。生产性能指标如表2所示,与对照组相比,试验1~14 d、1~28 d,饲喂酵母能显著提高仔猪体质量、平均日增重(ADG)、平均日采食量,14~28 d平均日采食量显著提高。对照组和酵母组对仔猪料重比及腹泻率的影响未见显著差异。
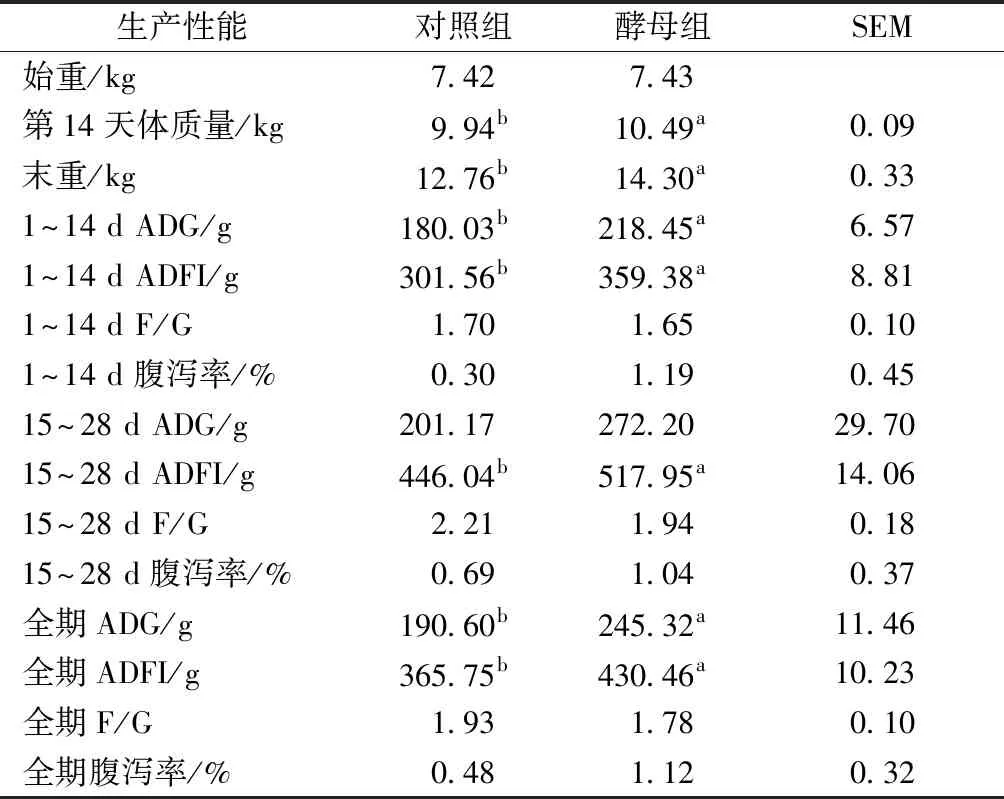
表2 活性酵母对仔猪生产性能及腹泻率的影响
注:同行数据中肩标字母表示差异显著(P<0.05),相同字母或无字母表示差异不显著(P>0.05)。表3~4同。
2.2 活性酵母对仔猪血清免疫及抗氧化指标的影响
如表3所示,在免疫指标方面,饲喂活性酵母较对照组显著提高了血清IgA含量,但是IgM、IgG含量各组间差异不显著。抗氧化指标上,与对照组相比,饲喂活性酵母能显著提高血清总抗氧化力,显著降低血清MDA含量,血清中过氧化氢酶活性虽未见显著差异,但有增加趋势,增幅达27.8%(P=0.11)。
2.3 活性酵母对仔猪血清粘膜屏障及炎症相关指标的影响
如表4所示,与对照组相比,饲喂活性酵母能显著降低血清MPO活性,但DAO及LPS含量未见显著差异。在炎症相关指标上,饲喂活性酵母较对照组显著降低了血清IL-1β含量,TNF-α含量也有降低趋势(P=0.054),降幅为12.5%,但活性酵母对IL-6含量未见显著影响。
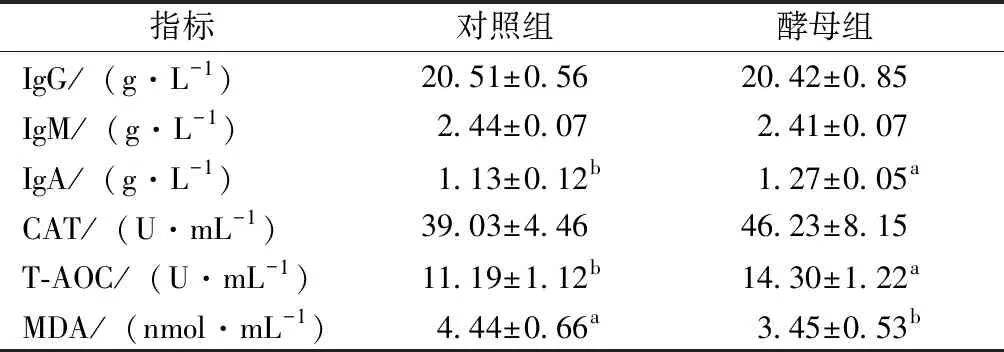
表3 活性酵母对仔猪血清免疫、抗氧化指标的影响
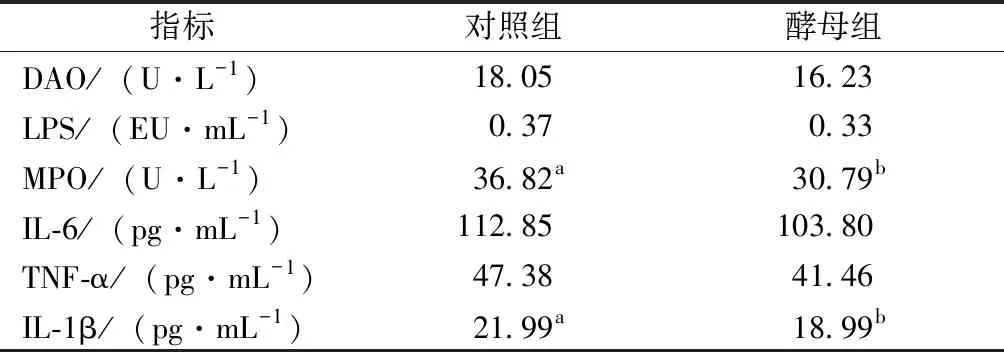
表4 活性酵母对仔猪血清粘膜屏障及炎症相关指标的影响
3 讨论
仔猪断奶后几周的生产性能对其全期生产表现有着至关重要的作用,活性酵母能够在宿主肠道内调节肠道菌群,其自身的酵母细胞壁、甘露寡糖等物质还能吸附毒素,激活免疫,降低炎症,对宿主生长起到积极作用[6-8]。罗世乾[9]研究表明,添加酿酒酵母或布拉迪酵母均能显著提高仔猪末重、ADG、ADFI。陈生龙等[10]也发现,饲喂中等剂量(1×107、2×107g-1)酵母能显著提高仔猪ADG和ADFI,但低剂量(0.5×107g-1)或高剂量(4×107g-1)酵母对生产性能的影响并不显著。在新生仔猪中也发现,饲喂活酵母直至断奶后,仔猪体质量、ADFI及ADG较对照组均显著提高[11]。本试验条件下,饲喂活性干酵母后仔猪ADG、ADFI均显著提高,与之前研究结果一致,但F/G无显著差异,这提示本试验中酵母是通过提高仔猪采食量来达到促生长作用,对饲料利用率影响并不明显,与陈生龙等[10]、刘化伟等[12]的研究结果一致。
活性酵母被认为可以吸附肠道毒素,减少有害菌吸附,对降低腹泻率具有较好的效果[13-14]。本研究中对照组和酵母组腹泻率均处于较低水平,未见显著差异,这可能是因为试验实施阶段为6~7月份,气温在30 ℃左右且未出现明显波动,较适宜仔猪生长,所以所有仔猪腹泻率均未见差异。
IgA、IgG、IgM是动物机体重要的免疫球蛋白。IgM多见于免疫初期,持续时间较短;IgA为局部免疫主要抗体,主要由浆细胞分泌;IgG为体液免疫主要抗体。罗士乾[9]研究表明,酵母能显著提高了IgM的含量,但对IgA、IgG无显著影响。Trckova等[5]对仔猪进行大肠杆菌攻毒后,饲喂活性酵母(5×107g-1)能显著提高IgA含量。本研究中,饲喂酵母后血清IgA含量显著增加,与之前研究一致,但IgM和IgG未见显著差异,不同结果中的略微差异可能是由仔猪生理阶段及所处的免疫阶段不同造成的。
MDA间接反映机体细胞受自由基攻击的严重程度,过氧化氢酶和总抗氧化能力则是机体内重要的抗氧化酶,参与自由基的清除。本研究中饲喂酵母显著降低了血清MDA含量,增加了血清总抗氧化能力,结果表明酵母具有一定的抗氧化功效。肖旭等[15]研究也发现的活性干酵母能显著提高仔猪血清中SOD含量,降低MDA含量,与本研究基本一致。
仔猪断奶应激常会引起肠道功能紊乱,粘膜屏障破坏,炎症加剧。MPO是中性粒细胞的功能标志和激活标志,常被作为监测肠道炎症及粘膜完整性的生物标记物。TNF-α及IL-1β是炎症反应过程中重要的炎性介质,其浓度升高提示体内炎症的增加。徐琴[16]研究表明,在致病性大肠杆菌攻毒仔猪中发现灌服100 mL活性酵母(1×109g-1)能显著降低IL-6及猪MAP浓度,先天免疫Toll样受体信号通路的关键基因表达显著降低。在正常仔猪中,也发现类似结果,仔猪血清中抑炎因子IL-4、IL-10随着酵母添加量的增加出现增长趋势[10]。本试验中,饲喂0.3%酵母显著降低了MPO及IL-1β含量,TNF-α也有降低趋势,这提示虽然仔猪生活环境温度较高,腹泻未大量出现,但断奶后仍因为饲粮等因素仔猪肠道造成应激损伤,而0.3%添加量的酵母能降低仔猪体内炎症,提高粘膜功能。
综上所述,在断奶仔猪日粮中添加0.3%活性酵母能通过提高采食量来促进仔猪生长,提高仔猪免疫功能及抗氧化力,降低体内炎症,在断奶仔猪饲粮中有良好的应用前景。

