转化生长因子-β(TGF-β)空间动态分布的角膜基质创伤修复体外三维培养体系的构建△
彭昶璠 徐路星 罗世男 王霜宁 袁检宝 李霞
作者单位:530021 广西壮族自治区南宁市,广西医科大学第一附属医院眼科
角膜病是仅次于白内障的第二大致盲性眼病,占整个角膜厚度90%的角膜基质损伤后的瘢痕化修复是角膜在外伤、炎症愈合后视力下降的主要原因。因此,研究角膜基质创伤修复的病理过程、探寻减少角膜基质瘢痕化的治疗方法对于防治角膜盲具有重要意义。转化生长因子-β(transforming growth factor-β,TGF-β)参与并介导了角膜损伤修复的过程,造成角膜基质细胞外基质(extracellular matrix,ECM)纤维化,进而引起病理性ECM沉积,最终导致瘢痕形成[1]。我们在前期研究工作中建立了Pellet体外三维培养模型,证实TGF-β可导致ECM纤维化[2-3]。角膜创伤修复过程中TGF-β具有时间、空间动态分布的特点[4-5],已有研究关注生长因子对角膜基质创伤修复的影响,但对于生长因子空间分布对修复过程的影响研究却较少。本研究在前期研究工作基础上,应用Transwell三维培养系统,结合透析膜进行改良,以构建模拟TGF-β空间动态分布的体外三维培养系统,为研究角膜基质创伤修复提供候选模型。
1 材料与方法
1.1主要试剂及仪器DMEM/F-12(11)培养基、胎牛血清(美国Gibco公司);Ⅰ型胶原酶(北京索莱宝公司);Trizol试剂(美国Invitrogen公司);TaqDNA聚合酶、MLV逆转录体系、PCR引物(日本Takara公司);TGF-β1、TGF-β2(美国Thermo Fisher公司);6孔0.4 μm孔径Transwell细胞培养板(美国Corning公司);相对分子质量 15 000 生物级高精度即用型透析袋(北京索莱宝公司);超净工作台(苏净AIRTECH公司);恒温CO2培养箱(美国Therma Forma公司);高速低温离心机(德国Eppendorf Centrifuge公司);倒置相差显微镜(日本Olympus公司)。
1.2原代牛角膜基质细胞的获取在屠宰场取新鲜成年牛眼球置于冰盒中,予碘伏和磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗3遍后沿角巩膜缘内侧约2 mm处环形剪出角膜,在无菌操作台上用PBS和DMEM/F12(11)培养基清洗后用无菌手术刀片刮除上皮层和内皮层。再次用DMEM/F12(11)培养基清洗后,用眼科剪将角膜剪碎至约1.0 mm×1.0 mm大小的组织块,置于含2 g·L-1I型胶原酶的 DMEM/F12(11)培养基中,放在 37 ℃ 恒温箱中避光消化4 h后得细胞悬液。用孔径200 μm的过滤网过滤细胞悬液,1000 r·min-1离心5 min,弃上清,加入培养基[体积分数10%胎牛血清(fetal bovine serum,FBS)+DMEM/F12,11]按 200×103个·cm-2细胞密度接种于25 cm2细胞培养瓶中,获得原代牛角膜基质细胞。
1.3构建Pellet、Transwell与透析袋相结合三维培养系统
1.3.1结合透析袋的Transwell小室系统制作在无菌操作台内用PBS冲洗透析袋3次后依照Transwell小室尺寸用眼科剪进行裁剪,以透析袋能从外部全面包裹小室且不超过小室顶部为宜,抹平小室滤过膜与透析袋间气泡,用无菌橡皮圈将透析袋固定在小室外侧。
1.3.2实验分组原代细胞贴壁80%以上时传代,当传代细胞达到80%融合时收集于15 mL离心管中,1000 r·min-1离心5 min,弃去上清液,加入体积分数10%FBS后再次离心即为Pellet模型。将建好的Pellet模型分为有透析袋组和无透析袋组,分别置于结合透析袋和不结合透析袋的Transwell的上室、下室进行培养,48 h后换液,其中上室为0.50 μg·L-1TGF-β1+0.25 μg·L-1TGF-β2+体积分数10%FBS,下室为体积分数10%FBS,分别培养72 h后进行后续实验。自然光条件下肉眼观察Pellet的形态,并拍照记录。
1.4实时荧光定量PCR法检测应用实时荧光定量(Real-time) PCR法检测三维培养系统内Pellet样本α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、纤维连接蛋白(fibronectin,FN)、Ⅰ型胶原(collagen Ⅰ,Col Ⅰ)、Col Ⅲ mRNA的表达,Pellet培养后72 h进行Real-time PCR检测,目的基因α-SMA的上下游引物序列分别为:5’-CTAACAACGTCCTCTCCGGG-3’、5’-GACAAGAGAGCAGGGAGTGTC-3’,FN的上下游引物序列分别为:5’-CACCAACGAACTTGCACCTG-3’、5’-CTGATCGGCATGGACCACTT-3’,Col Ⅰ的上下游引物序列分别为:5’-TTCAGCTTTGTGGACCTCCG-3’、5’-CGTTCTGTACGCAGGTGACT-3’,Col Ⅲ的上下游引物序列分别为:5’-TGAAAGGCCCAGCTGGTATG-3’、5’-CCATCATTACCTCGAGCCCC-3’,内参基因β-肌动蛋白的上下游引物序列分别为:5’-GCAGAAAGAGATCACTGCCC-3’、5’-TAACGCAGC-TAACAGTCCGC-3’。各基因的相对表达量参考文献[3]用2-ΔΔCt法计算。
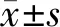
2 结果
2.1牛角膜基质细胞体外二维培养48h后的生长情况倒置相差显微镜下见,牛角膜基质细胞体外二维培养48 h后贴壁生长,伸展呈梭形(图1)。
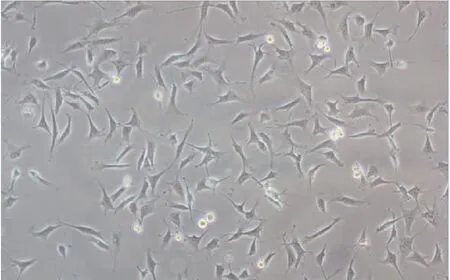
图1 倒置相差显微镜牛角膜基质细胞体外二维培养48 h后细胞形态(×100)
2.2Pellet模型的生长情况Pellet模型在培养后48 h开始呈团状生长,在Transwell小室系统培养后72 h Pellet模型的结构均稳定(图2),2组Pellet模型外观上无明显差异。

图2 Pellet模型生长情况。A:48 h开始呈团状生长,形成Pellet;B:有透析袋组培养72 h Pellet在Transwell上下室呈团状生长;C:无透析袋组培养72 h Pellet在Transwell上下室呈团状生长
2.3培养72h后各组Pellet模型中目的基因mRNA的表达
2.3.1Pellet在有透析袋组上室与下室各目的基因mRNA表达Pellet模型在Transwell小室系统培养后72 h,有透析袋组上室细胞4种基因mRNA表达均明显高于下室细胞,差异均有统计学意义(tα-SMA=4.073、tFN=0.069、tCol Ⅰ=3.839、tCol Ⅲ=1.531,均为P=0.000)。有透析袋组上室细胞的Col Ⅲ/Col Ⅰ比值为1.126±0.019,有透析袋组下室细胞的Col Ⅲ/Col Ⅰ比值为0.957±0.013,有透析袋组上室的Col Ⅲ/Col Ⅰ比值显著高于下室,差异有统计学意义(t=0.137,P=0.000)。见表1。
2.3.2Pellet在无透析袋组上室与下室各目的基因的mRNA表达Pellet模型在Transwell小室系统培养后72 h,无透析袋组上室与下室细胞中4种基因mRNA比较,差异均无统计学意义(tα-SMA=8.300,P=0.845;tFN=1.202,P=0.631;tCol Ⅰ=3.148,P=0.879;tCol Ⅲ=0.027,P=0.904)。Pellet模型在Transwell小室系统培养后72 h,无透析袋组上室细胞的Col Ⅲ/Col Ⅰ比值为1.157±0.029,无透析袋组下室细胞的Col Ⅲ/Col Ⅰ比值为1.163±0.090,无透析袋组上室的Col Ⅲ/Col Ⅰ比值与下室无明显差异(t=0.239,P=0.651)。见表1。
2.3.3Pellet在无透析袋组上、下室与有透析袋组组上、下室各目的基因mRNA表达情况Pellet模型在Transwell小室系统培养后72 h,无透析袋组上室细胞中α-SMA、FN、Col Ⅰ和Col Ⅲ mRNA的相对表达量与有透析袋组上室、有透析袋组下室比较,差异均有统计学意义(tα-SMA上室=0.570,P=0.000;tα-SMA下室=2.463,P=0.000;tFN上室=1.364,P=0.000;tFN下室=0.334,P=0.002;tCol Ⅰ上室=2.957,P=0.001;tCol Ⅰ下室=0.571,P=0.000;tCol Ⅲ上室=0.191,P=0.002;tCol Ⅲ下室=0.512,P=0.000)。见表1。
Pellet模型在Transwell小室系统培养后72 h,无透析袋组下室细胞中α-SMA、FN、Col Ⅰ和Col Ⅲ mRNA的相对表达量与有透析袋组上室、有透析袋组下室比较,差异均有统计学意义(tα-SMA上室=8.505,P=0.000;tα-SMA下室=2.090,P=0.000;tFN上室=0.006,P=0.000;tFN下室=0.046,P=0.001;tCol Ⅰ上室=0.091,P=0.002;tCol Ⅰ下室=4.371,P=0.006;tCol Ⅲ上室=0.023,P=0.003;tCol Ⅲ下室=0.494,P=0.000)。见表1。
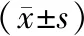
表1 2组上室及下室各基因mRNA表达量比较
注:Fα-SMA分组=381.086,P=0.000;FFN分组=153.937,P=0.000;FCol Ⅰ分组=72.767,P=0.000;FCol Ⅲ分组=172.043,P=0.000
3 讨论
在角膜损伤修复过程中,TGF-β在空间及时间上具有动态分布的特点。TGF-β1可促进成纤维细胞增殖、分化及促进间质细胞转化为成纤维细胞[6];TGF-β2则参与了损伤区域成纤维细胞的聚集,引发胶原合成[7]。在角膜创伤修复过程中,二者协同促进ECM纤维化。根据Huh等[8]和Fini等[9]研究发现,在角膜创伤后12 h TGF-β2开始在增殖、迁移的角膜上皮细胞及活化的成纤维细胞中出现,在伤后48 h TGF-β1开始在角膜上皮细胞高度表达。在损伤初期二者即在损伤区域高表达,于伤后7 d达到高峰,而TGF-β1在损伤后7 d扩散到非损伤区。然而,TGF-β1在角膜创伤修复过程中在非损伤区的作用鲜有报道,在皮肤疾病领域则有研究表明TGF-β1可促进正常真皮基质细胞转化为成纤维细胞,并促进成纤维细胞向伤口的趋化,促进周边未损伤区细胞向损伤区增殖迁移,进而促进创面收缩[10]。此外,现有体外创伤修复研究一般基于二维培养,实际上角膜损伤修复有空间和时间的动态变化,且损伤区与未损伤区存在相互影响。三维培养是二维培养与动物实验之间连接的桥梁。相对于二维培养,体外三维培养能更好地模拟体内角膜损伤修复的病理生理过程;虽然三维培养不能完全模拟动物实验所发生的病理生理变化,但体外三维培养由于对实验条件的精确控制较动物实验好,因而常常用来研究病理生理过程、药物筛查及组织工程学[11]。目前国际上有两个课题组应用三维培养研究角膜损伤修复病理生理过程[12-15],但目前对TGF-β的空间分布进行模拟的三维培养模型尚未见报道。建立TGF-β空间分布的体外三维培养模型对研究角膜创伤修复损伤区及未损伤区相互作用的病理生理过程及抗瘢痕药物的筛选均有帮助。
本研究利用Transwell结合透析袋建立TGF-β空间动态分布的角膜基质创伤修复体外三维培养体系。Transwell目前广泛应用于共培养体系、趋化性实验、肿瘤细胞侵袭实验等研究中,对上下室进行了空间的分隔,在细胞共培养中提供空间分隔作用。TGF-β的相对分子质量为25 000,而实验室常用Transwell小室滤过膜孔径最小规格为0.4 μm,TGF-β还是能通过Transwell小室滤过膜干扰下室。透析袋可根据实验需要选择不同的材料和截留相对分子质量,可截留相对分子质量为100~300 000的分子。本研究中选择了截留相对分子质量15 000的透析袋,理论上可阻隔相对分子质量15 000以上的分子,可阻隔TGF-β向下室渗透。目前评估角膜基质纤维化程度的主要研究指标包括α-SMA、FN、Col Ⅲ、Col Ⅰ 等基因的表达,Col Ⅲ/Ⅰ的比值增大亦是纤维化的标志。本研究应用Real-time PCR检测以上目的基因在mRNA水平上的表达以评估各组Pellet纤维化程度。本研究中对上室应用含有TGF-β1、TGF-β2培养液后,上室Pellet高表达了α-SMA、FN、Col Ⅲ等基因,Col Ⅲ/Ⅰ的比值增大,提示上室的角膜基质细胞启动了纤维化的过程,下室中Pellet的以上纤维化标志物的表达及Col Ⅲ/Ⅰ的比值低于上室,下室不含TGF-β1,因此下室的角膜基质细胞纤维化程度小。本研究培养48 h内上下室培养液均为基础培养液,48 h后上室培养液改为含有0.5 μg·L-1TGF-β1联合0.25 μg·L-1TGF-β2的基础培养液,是模拟角膜创伤修复中动物模型角膜伤口区TGF-β1及TGF-β2在48~72 h的高表达状态。由于根据Huh等[8]的研究结果,小鸡角膜损伤过程中,伤后7 d损伤区的TGF-β1扩展至伤口外角膜基质后部及角膜内皮细胞附近,故本研究中下室培养液在培养前的72 h是含体积分数10%FBS的DMEM培养基,模拟了未损伤区无TGF-β1在伤后72 h内在未损伤区的无表达状态[8]。无透析袋组上下室目的基因表达无显著性差异,提示透析袋阻断了上下室之间TGF-β1及TGF-β2的穿透。因此,应用Transwell结合透析袋建立的TGF-β空间动态分布的角膜基质创伤修复体外三维培养体系,可模拟角膜创伤修复过程中损伤区以及未损伤区TGF-β的动态变化,为研究角膜基质创伤修复的病理生理过程及抗瘢痕药物的筛查提供了更好的研究手段。然而,实际体内环境中损伤区与非损伤区之间存在相对分子质量大于25 000的物质的交流,因此该模型仍存在一定局限性,有待今后进一步改进。

