高糖饮食对小鼠真菌性角膜炎的影响△
陈雨晴 简守珺 岳娟 刘素素 李志杰 王丽娅
作者单位:450003 河南省郑州市,郑州大学人民医院,河南省立眼科医院,河南省眼科研究所,河南省人民医院,河南省眼科学与视觉科学重点实验室(陈雨晴,简守珺,岳娟,刘素素,王丽娅);510632 广东省广州市,暨南大学医学院眼科研究所,暨南大学再生医学教育部重点实验室(李志杰)
真菌性角膜炎是一种由致病真菌感染引起的致盲率极高的感染性角膜病[1]。近几年真菌性角膜炎患病率已上升到感染性角膜病的首位(占51%~70%)[2]。河南省是一个农业大省,真菌性角膜炎的发病率较高,降低真菌性角膜炎致盲率的研究具有重要意义[3]。随着生活水平的提高,含糖食品无处不在,尤其是儿童食品和饮料中,糖的含量普遍较高[4]。已有多项研究表明,过多食用高糖食品影响了机体正常的糖代谢,带来多种危害[5-8]。本研究旨在探讨高糖饮食对真菌性角膜炎病程的影响,以期指导真菌性角膜炎的治疗。
1 材料与方法
1.1材料
1.1.1实验动物及分组C57BL/6J雄性小鼠共78只,8~12周龄,体质量23~28 g,购自南京大学模式动物研究所。自由摄食、饮水,室温18~24 ℃,相对湿度40%~70%,每日12 h光照维持,昼夜循环。实验动物的饲养和使用均遵照美国视觉与眼科研究协会制定的科研动物使用规范,经河南省眼科研究所实验动物伦理委员会审查批准。
1.1.2主要试剂及仪器D-果糖、Triton X-100(北京索莱宝科技有限公司),FITC/Gr-1、F4/80 PE (美国eBioscience),小鼠白细胞介素-1β(interleukin-1β,IL-1β)酶联免疫吸附测定试剂盒(武汉伊莱瑞特生物科技股份有限公司),牛血清白蛋白(中国BIOSHARP)。腐皮镰刀菌(3.1791)标准菌株(北京中国科学院微生物研究所)。血糖仪(美国Roche),双光子激光扫描显微镜(德国Zeiss),荧光显微镜(日本Nikon),酶标仪(美国EnVision-PerkinElmer)。
1.2方法
1.2.1实验动物分组及处理根据随机数字表将小鼠分为高糖饮食组和模型对照组,每组各39只。模型对照组给予正常饮用水,高糖饮食组给予含体积分数10%果糖溶液,其他饲养条件相同。10 d后,两组均建立真菌性角膜炎模型。期间每2 d定时测量两组小鼠体质量和血糖。
1.2.2真菌性角膜炎模型的建立小鼠腹腔注射80 mg·kg-1戊巴比妥钠进行全身麻醉,用10 g·L-1盐酸丁卡因滴眼液进行角膜表面麻醉,按照文献[9]和[10]的方法建立双眼真菌性角膜炎模型。菌种选用国内最常见的致病真菌——腐皮镰刀菌。
1.2.3小鼠模型的临床观察各组小鼠于造模后24 h、36 h、48 h、72 h、96 h、120 h、168 h在裂隙灯显微镜下对角膜进行临床评分并拍照,临床评分规则参照文献[11]和[12]。
1.2.4角膜组织病理学观察造模后24 h、48 h、72 h、168 h,两组各时间点均分别处死2只小鼠,摘取双眼眼球,在解剖显微镜下修剪角膜,固定、脱水、石蜡包埋后,在角膜中央以矢状位做5 μm厚切片,二甲苯脱蜡,行HE染色和PAS染色,封片后荧光显微镜下观察。
1.2.5中性粒细胞及巨噬细胞浸润情况观察造模后24 h、36 h、48 h、72 h、96 h、120 h、168 h,两组各时间点均分别处死 3只小鼠,摘取双眼眼球,取角膜,于20 g·L-1多聚甲醛溶液中固定60 min,PBS冲洗10 min×5次;1 g·L-1Triton 100-牛血清白蛋白破膜20 min;20 g·L-1牛血清白蛋白封闭20 min;加入FITC/Gr-1、F4/80 PE 4 ℃孵育过夜,PBS避光冲洗10 min×5次;将角膜平铺于载玻片上,使用刀片将角膜均匀切分为四个扇形,且各角膜叶在角膜组织的中央部分相互连接,吸水纸吸去多余PBS,使用荧光封片胶封片。使用双光子激光扫描显微镜对样品进行逐层扫描。将角膜瓣分别划分为17个区域,观察中性粒细胞和巨噬细胞的数量及分布。用Imaris 7.2.1(Bitplane)图像处理软件对角膜铺片各视野图像中的中性粒细胞及巨噬细胞体积进行逐层渲染,各视野所有层面的中性粒细胞体积之和即为整个角膜中性粒细胞的总体积,各视野所有层面的巨噬细胞体积之和即为整个角膜巨噬细胞的总体积。
1.2.6ELISA法测定IL-1β含量造模后24 h、48 h、72 h、120 h、168 h,两组各时间点均分别处死2只小鼠,摘取双眼眼球,取角膜,加入100 μL蛋白酶抑制剂,剪碎角膜,12 000 r·min-14 ℃离心20 min,取上清。BCA试剂盒测定角膜内蛋白浓度。使用ELISA法检测角膜中IL-1β的含量。在酶标仪中读取450 nm处的吸光度(A)值,并用已知标准溶液制备的特定校准曲线计算IL-1β的含量。
1.3统计学方法采用SPSS 21.0统计软件进行统计分析,以均数±标准差描述计量资料。各组角膜病变临床评分统计采用秩和检验;各组角膜穿孔率比较采用卡方检验;各组中性粒细胞体积、巨噬细胞体积、IL-1β含量比较采用单因素方差分析,方差齐时采用LSD检验,方差不齐时采用Tamhane’s T2检验。以P<0.05为差异有统计学意义。
2 结果
2.1两组小鼠体质量与血糖的比较自分组喂养开始后每2 d测量高糖饮食组和模型对照组小鼠体质量,0~14 d两组小鼠体质量与血糖差异均无统计学意义(均为P>0.05)。见表1和表2。
2.2两组小鼠真菌性角膜炎临床表现裂隙灯显微镜下观察(图1)可见,真菌性角膜炎造模后24 h,两组小鼠角膜均出现角膜基质浸润,高糖饮食组病灶范围大于模型对照组。造模后48 h,两组小鼠角膜混浊程度均进一步加重,病灶区瞳孔和虹膜纹理均不可见,角膜缘均可见大量前房积脓,呈典型的真菌性角膜炎临床表现。造模后72 h,两组小鼠角膜均出现后弹力层膨出和新生血管,高糖饮食组相较于模型对照组后弹力层膨出发生率高,新生血管面积更大。两组均在造模后120 h病变最为严重,甚至出现角膜穿孔,高糖饮食组更为严重。两组小鼠造模后不同时间点临床评分见表3。造模后24 h、36 h、48 h、120 h、168 h,高糖饮食组小鼠角膜临床评分均明显高于模型对照组,差异均有统计学意义(均为P<0.05)。
2.3两组小鼠角膜穿孔率高糖饮食组与模型对照组均在造模后72 h开始出现角膜穿孔,此时两组各剩余22只鼠44眼,其中高糖饮食组角膜穿孔35眼,未穿孔9眼,穿孔率为79.5%;模型对照组角膜穿孔18眼,未穿孔26眼,穿孔率为40.9%;两组角膜穿孔率相比差异有统计学意义(χ2=15.174,P=0.000)。
2.4两组小鼠角膜组织病理学表现角膜组织病理学检查结果显示,高糖饮食组炎症反应更重,角膜组织破坏更早且更为严重。HE染色结果显示,高糖饮食组造模后24 h,中性粒细胞分布于感染角膜基质全层;造模后72 h,中性粒细胞明显增多,角膜浅层基质坏死脱落,溃疡形成;造模后168 h,角膜穿孔,虹膜脱出。模型对照组炎症反应相对较轻,恢复后的角膜厚度较高糖饮食组薄,且完整性更好。PAS染色结果显示,两组均为炎症早期菌丝较多,随着病程进展菌丝逐渐减少;但高糖饮食组各时间点菌丝均明显多于模型对照组。
2.5两组小鼠角膜内中性粒细胞浸润体积高糖饮食组与模型对照组中性粒细胞浸润体积均在造模后36 h到达高峰。高糖饮食组各个时间点中性粒细胞浸润体积均高于模型对照组,差异均有统计学意义(均为P=0.000)。见表4和图2。
2.6两组小鼠角膜内巨噬细胞浸润体积两组小鼠巨噬细胞浸润体积均在造模后72 h明显升高。造模后24 h、36 h、48 h,两组巨噬细胞浸润体积相比差异均无统计学意义(均为P>0.05),而在造模后72 h、96 h、120 h、168 h时,两组巨噬细胞浸润体积相比差异均有统计学意义(均为P=0.000)。见表5和图2。
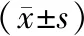
表1 两组小鼠造模后不同时间点体质量监测
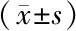
表2 两组小鼠造模后不同时间点血糖监测

图1 两组小鼠角膜真菌性角膜炎表现。注:Con示模型对照组,HFrD示高糖饮食组
2.7两组小鼠角膜内IL-1β含量两组小鼠角膜内IL-1β含量均在造模后24 h达到最高值。造模后24 h、48 h,高糖饮食组IL-1β含量均明显高于模型对照组(均为P<0.05)。见表6。
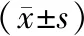
表3 两组小鼠造模后不同时间点角膜临床评分
注:F分组=98.755,P=0.000;F时间=212.050,P=0.000
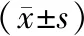
表4 两组小鼠造模后不同时间点中性粒细胞浸润体积
注:F分组= 5488.537,P=0.000;F时间=488.788,P=0.000

图2 两组造模后中性粒细胞和巨噬细胞浸润情况。注:Con示模型对照组,HFrD示高糖饮食组,Gr-1示中性粒细胞,F480示巨噬细胞(标尺=20 μm)
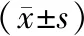
表5 两组小鼠造模后不同时间点巨噬细胞浸润体积
注:F分组= 849.069,P=0.000;F时间= 1484.918,P=0.000
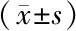
表6 两组小鼠造模后不同时间点角膜内IL-1β含量
注:F分组= 9.188,P<0.05;F时间= 8702.128,P<0.05
3 讨论
真菌性角膜炎是致盲率极高的感染性眼病,在我国居感染性角膜病致盲率的首位[13]。该病主要与植物外伤有关,其中常见的致病菌是腐皮镰刀菌和黄曲霉菌[3]。本实验通过研究高糖饮食对小鼠真菌性角膜炎病程的影响,以期为临床真菌性角膜炎患者的治疗提供一定理论依据。
本研究通过对高糖饮食组与模型对照组小鼠体质量与血糖监测发现,两组各时间点差异均无统计学意义(均为P>0.05),表明短期的高糖饮食并未打破小鼠的糖代谢平衡。统计真菌性角膜炎小鼠角膜临床评分结果示,多个时间点高糖饮食组临床评分明显高于模型对照组;组织病理学检测结果示,多个时间点高糖饮食组角膜水肿和炎症浸润程度高于模型对照组,角膜内真菌量多于模型对照组。有研究表明,高糖饮食可能通过相关机制诱发癌症的发生,引起胰岛素抵抗、高胰岛素血症、甾体类激素生物利用度增加、氧化应激反应及炎症反应等[14-15]。Buyken等[16]认为,高糖饮食与氧化应激及炎症反应相关的途径可能为:高糖饮食导致餐后血糖大量升高,引起一氧化氮生成,随后产生过氧化硝酸盐,而过氧化硝酸盐是潜在的促进氧化应激反应的分子。此外,相关研究已阐明,饮食中糖的摄入能激活人体炎症反应程序,其机制可能是膳食中糖类促进肝脏中游离脂肪酸的合成,游离脂肪酸代谢产物诱发炎症反应及活性氧形成[17]。
真菌性角膜炎发生时,机体同时存在固有免疫与适应性免疫,中性粒细胞是病程早期最活跃的炎症细胞,能快速到达病灶部位消灭真菌[18],但其杀灭真菌孢子时又会破坏角膜结构[19]。众多研究证明,在真菌性角膜炎感染晚期阶段,巨噬细胞在获得性免疫中发挥重要调节作用[20]。本实验对真菌感染后角膜内中性粒细胞及巨噬细胞浸润体积计算后发现,多个时间点高糖饮食组高于模型对照组,表明高糖饮食可能加剧了真菌性角膜炎炎症免疫反应,使角膜破坏严重,穿孔率增加。
在真菌性角膜炎中,IL-1β含量与角膜病变程度和炎症细胞浸润密切相关。造模后24 h、48 h,高糖饮食组IL-1β含量高于模型对照组,因宿主的炎症反应程度也是角膜损害的重要因素,IL-1β的早期高表达可能在角膜病变损害中起着重要作用。除此之外,高糖饮食导致肠道微生物菌群的变化,可使血浆内脂多糖浓度升高,从而导致炎症反应和相关代谢性疾病发生[21]。
然而,关于高糖饮食对炎症反应影响的研究仍有争议。Korntner等[7]在骨科方面的研究表明,在非糖尿病小鼠模型中,高糖饮食对肌腱的修复具有促进作用。因此,高糖饮食在感染过程中也可能存在着促进愈合的积极作用,这可能与糖的种类、剂量及感染的类型有关,未来仍需要深入研究。
综上所述,本研究结果表明,高糖饮食加剧了真菌性角膜炎的病情,但因真菌性角膜炎致病机制复杂,高糖饮食对真菌性角膜炎的影响及机制仍有待进一步深入研究。

