针刺对类风湿性关节炎小鼠血清IL-4和TNF-α的影响
刘金星,胡 琼,丁 宁,袁 斓
(1.成都中医药大学 针灸推拿学院,四川 成都610075;2.成都中医药大学 发展规划处,四川 成都610075)
类风湿性关节炎(Rheumatoid Arthritis,RA)作为医学界广泛关注的一种复杂的自身免疫性疾病,虽然病因尚不明确,但辅助T细胞免疫平衡功能异常在RA的发病中起到的中心环节作用已得到普遍认同。T 细胞主要是通过细胞相互作用以及分泌的细胞因子在RA致病中扮演不同的角色[1]。Th1/Th2失衡导致的Th1或Th2占主导的免疫漂移是引起RA的重要免疫学机制,免疫性炎症反应是其主要表现[2]。因此恢复Th1/Th2的平衡对于治疗RA有积极作用。
Th1细胞分泌的促炎TNF-α因子和Th2细胞分泌的抗炎IL-4因子的含量变化是Th1/Th2比例变化的表现之一[3]。基于此,本实验从分子水平出发,通过检测针刺后RA小鼠血清中IL-4和TNF-α的含量,观察其RA小鼠Th1/Th2细胞因子平衡的影响,探讨针刺治疗RA细胞因子层面的作用机制。
1 材料与仪器
1.1 动物
取24只雄性小鼠,体重18~22 g。实验动物由成都达硕实验动物有限公司提供(实验动物许可证号:SCXK(川)2015-030)。小鼠在进行1周的适应性驯养后开始实验,每4只一笼群养,饲养于普通动物实验室,室温控制在23~25℃,定时通风换气,自然明暗周期,自由饮水摄食。
1.2 主要试药与仪器
1.2.1 试剂 MouseIL-4ELISAKIT(规格:96孔/盒,货号:xl-Em0194);MouseTNF-aELISAKIT(规格:96孔/盒,货号:xl-Em0359)。以上均由abcam生产,鑫乐生物进口分装。
1.2.2 仪器 华佗牌一次性针灸针(常规0.25 mm×13 mm),粗细为32号,长短为0.5寸。计算机(TFT185W80PS,冠捷显示科技有限公司);酶标仪(MultlskanMk3,赛默飞世尔仪器有限公司);优普超纯水制造系统(UPH-Ⅱ-10T,成都超纯科技有限公司);电子恒温水浴锅(DZKW-4,北京中兴伟业仪器有限公司);手提式不锈钢压力蒸汽灭菌器(SYQ-DSX-280B,上海申安医疗器械厂);移液枪(规格1000μL、200μL、20μL、10μL、2μL,大龙兴创实验仪器(北京)有限公司);枪头(规格1000μL、200μL、20 μL,美国Axygen公司);EP管(规格1.5 m L、0.2 m L、100 μL,美国Axygen公司)。
2 方法
2.1 分组
采用完全随机的方法将小鼠分为3组,每组8只,分别为空白对照组(简称空白组)、RA模型组(简称模型组)、针刺治疗组(简称针刺组)。在开始治疗后的第21天处死各组小鼠(颈椎脱臼法),提取眼部血液进行相关检测。
2.2 造模方式
在实验开始的第1天,参照文献[4-6],将II型胶原与0.1 mol/L乙酸溶液配制成2 mg/m L的溶液,在4℃的环境中充分搅拌并储存,第2天按照1∶1的比例将其与弗氏完全佐剂进行混合乳化处理,使之完全乳化。除空白组外,每只小鼠皮下注射共200μL乳液,注射部位为背部的4~6点。1周后将等量不完全佐剂和牛Ⅱ型胶原乙酸溶液混合并使之乳化,通过皮下注射方式,将100μL液体注射于每只小鼠尾根部3~5点。1周后将等量不完全佐剂和牛Ⅱ型胶原乙酸溶液混合并使之乳化,将100μL液体皮下注射于小鼠左右后足趾,左右各50μL。一般在末次免疫后的7~12天,80%以上造模小鼠会表现出关节炎相关症状。参照5级评分法观察记录关节炎指数,观测记录时间为免疫前和免疫后的第3、5、7、12天。采用足趾容积测量仪测量踝关节的容积,观察关节肿胀度,每周测定2次,每次反复测定3次取平均值[7]。
2.3 治疗方法
于RA造模21天后开始针刺治疗,用自制鼠架对针刺组小鼠进行固定,选取肾俞和足三里穴进行针刺,两穴皆取双侧,每日1次,治疗时间均在下午15∶00-18∶00之间,每次30min。连续治疗6天为1个疗程,整个实验共3个疗程,每2个疗程间隔1天。参照文献[8](《实验针灸学》的动物穴位图谱)进行定位。用同样的方法对空白组和模型组小鼠进行固定,但不实施针刺治疗。实验过程中针刺组因操作不当,1只在治疗前死亡,其余7只小鼠正常治疗。其余组小鼠未有异常。
2.4 观察指标和检查方法
取各组小鼠外周血,分离其上清液。采用ELISA联合检测代表Th1和Th2型细胞因子的(TNF-α、IL-4)的分泌水平,分析Th1和Th2细胞的分化格局。步骤为①复温:将所有试剂平衡至室温;②标准品稀释;③加样;④配液;⑤洗涤;⑥显色;⑦终止:每个孔加终止液50μL;⑧测定:将空白调整为零,于450nm波长下依次检测各个孔的吸光度(OD值)。
2.5 统计学处理
采用SPSS19.0软件对数据进行统计学处理,数据以均数加减标准差(±s)表示。各组数据经过正态检验和方差齐性检验后,组间比较用单因素方差分析。方差齐时,选用LSD(LeastSignificantDifference,最小显著差异法),方差不齐,选用Tamhane'sT2检验。P<0.05为差异显著,P<0.01为差异极显著。
3 结果
3.1 针刺对实验性RA小鼠血清中IL-4含量的影响
表1结果显示,与空白组相比,模型组小鼠血清中IL-4含量降低,差异极显著(P<0.01)。与模型组相比,针刺组小鼠血清中IL-4含量升高,差异显著(P<0.05)。提示针刺治疗能明显提高实验性RA小鼠血清中IL-4含量。
表1 针刺对实验性RA小鼠血清组织中IL-4含量的影响(±s)

表1 针刺对实验性RA小鼠血清组织中IL-4含量的影响(±s)
注:与空白组比较,#P<0.05,## P<0.01,与模型组比较,*P<0.05,**P 0.01。
组别 样本数量(n) 含量(ng/L)空白组 8 11.66±1.88模型组 8 8.54±1.37##针刺组 7 10.69±1.04*
3.2 针刺对实验性RA小鼠血清中TNF-α含量的影响
表2结果显示,与空白组相比,模型组小鼠血清中TNF-α含量升高,差异极显著(P<0.01);与模型组相比,针刺组小鼠血清中TNF-α含量降低,差异显著(P<0.05)。提示针刺治疗能明显降低实验性RA小鼠血清中TNF-α含量。
表2 针刺对实验性RA小鼠血清组织中TNF-α含量的影响(±s)
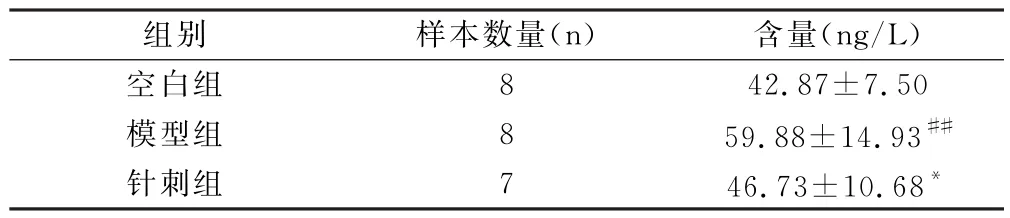
表2 针刺对实验性RA小鼠血清组织中TNF-α含量的影响(±s)
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
组别 样本数量(n) 含量(ng/L)空白组 8 42.87±7.50模型组 8 59.88±14.93##针刺组 7 46.73±10.68*
4 讨论
RA的主要病理表现包括滑膜增生、炎性细胞浸润、血管新生等,继而导致软骨与骨膜破坏,最终导致关节畸形,功能丧失。其病因病机较为复杂,至今仍未能完全明确。目前许多研究表明,细胞因子与RA的发生发展密切相关,关系着疾病的治疗及预后。这些细胞因子能通过相互间的网络参与细胞间的信息传递,诱导免疫细胞分化,促使炎症反应扩大[9]。
在RA细胞因子体系中,TNF-α处于上游,在其体系中有“中心犯罪”的作用[10]。TNF-α能影响免疫细胞反应和非免疫炎性反应,促使相关炎性细胞因子产生,介导疾病的发展。有研究表明,TNF-α可促使相关细胞分泌生长因子,造成血管翳,如滑膜细胞、血管内皮细胞、成纤维细胞;还可导致糖蛋白合成减少,破坏关节软骨和骨质,使得相关细胞产生IL-1、IL-8等炎性细胞因子,加强白细胞向关节腔的聚集能力,进一步导致组织损伤[11]。
Th2细胞分泌产生IL-4,IL-4可促使IL-1和TNF-α细胞因子分泌水平降低,起到抑制后两者腐蚀破坏关节软骨的作用。IL-4的分泌还能起到抑制IL-8和IL-6释放的作用。在体外培养的RA滑膜细胞中,IL-4对NK细胞有负调节的作用,既能减少IL-1分泌,又可以促进表达IL-1受体拮抗物。IL-4不仅有利于Th2的增殖,还可抑制Th1细胞增生和拮抗TNF-α的前炎症效应[12]。因此,作为Th2细胞分泌的抗炎细胞因子,其可以减缓RA的发展。
大量临床与实验研究表明,免疫分子与免疫细胞的失衡可以通过针刺进行调节,针刺对免疫器官能起到保护作用并抑制免疫应答[13]。足三里、肾俞二穴是临床治疗RA应用频次最多的两个穴位,临床疗效显著[14]。此次实验运用的动物模型是T细胞和相关炎性因子引起的细胞免疫模型,与人类的发病机制有很高的相似度。此外,该模型具有急性和慢性RA的病理变化特点,是国际公认的最好的RA动物模型[15-16]。
本研究结果显示,与空白组相比,模型组小鼠血清中IL-4含量降低、TNF-α含量升高,差异极显著(P<0.01)。说明造模后小鼠血清中存在细胞因子的失衡,与以往研究相一致。而与模型组相比,针刺组小鼠血清中IL-4含量升高、TNF-α含量降低,差异显著(P<0.05)。说明针刺可以通过调节RA小鼠体内IL-1和TNF-α的含量,改善Th1/Th2的失衡,起到免疫调节和抗炎作用,有利于RA的治疗与预后。

