Th17/Treg细胞及相关细胞因子在复发缓解型多发性硬化中的作用及机制
李丹 王黙 纪元 王玮 袁晓燕
作者单位:264200 威海市立医院检验科(李丹,纪元,王玮,袁晓燕);250021山东大学附属省立医院血管外科(王默)
多发性硬化(multiple sclerosis,MS)是一种以中枢神经系统脱髓鞘病变为主的自身免疫性疾病,在中国发病率为(1 ~2)/10万人,其确切病因及发病机制尚未清楚。MS最常见的类型是复发缓解型多发性硬化(relapsing remitting multiple sclerosis,RRMS)。目前,辅助性T细胞(T helper cell 17,Th17)和调节性T细胞(regulatory cells,Treg)细胞在免疫性疾病、肿瘤性疾病和感染性疾病研究较多,但对RRMS患者的研究相对很少,本文通过对31例RRMS患者静脉血Th17/Treg细胞百分率及相关细胞因子水平的检测,深入研究Th17/Treg细胞在RRMS发生发展中的作用及机制。
1 对象和方法
1.1对象选取2014-01—2017-08期间威海市立医院神经内科门诊及住院RRMS患者(RRMS组)31例,男8例、女23例;年龄26~48岁,平均年龄(37±11)岁,均为急性发作期,入院前3个月未使用免疫抑制剂和糖皮质激素,均符合2005年修订的McDonald诊断标准[1],并剔除:合并其他自身免疫性疾病、严重心脑血管疾病、肝肾功能不全、急慢性感染、肿瘤和合并妊娠患者。 入院时EDSS评分2.5~8.0分,平均(6.31±1.54)分,病程3个月至5年,平均(30.41±4.85)个月。31例RRMS患者均存在新发阳性症状和(或)体征,其中感觉异常12例,肢体无力10例,视力减退5例,共济失调4例,同时存在两种或两种以上症状者19例;头颅MRI检查均出现新的增强病灶。
另外选取同期神经系统非炎性患者29例为对照组,包括偏头痛患者19例,紧张性头痛患者10例,男15例、女14例,年龄25~45岁,平均年龄(35±10)岁,该组患者头颅CT或MRI均正常;脑脊液常规、生化、细胞学均正常。排除标准:合并其他自身免疫性疾病、急慢性感染、并发严重的心、肝、肾功能不全者,半年内接受免疫抑制剂或糖皮质激素或其他免疫治疗。
两组在性别和年龄方面两组差异无统计学意义。
1.2主要仪器与试剂流式细胞仪采用美国BD 公司FACSCalibur型号,鼠抗人CD4-APC和FOXP3-PE抗体购自美国BD公司,鼠抗人IL-17A-FITC抗体购自eBiocience公司,淋巴细胞分离液、佛波酯乙醇、离子霉素和蛋白质转运抑制剂莫能霉素均购自美国Sigma公司,ELISA试剂盒购自R&D公司。
1.3方法
1.3.1治疗方法:RRMS组患者入院后静脉滴注甲泼尼龙1000 mg/d冲击治疗,3 d后减量至500 mg/d,每3 d剂量减半,至30 mg时改为泼尼松口服35 mg/d,每周减量5 mg直至停药。
1.3.2标本采集:RRMS组治疗前和对照组于入院后采集标本,另外RRMS组在甲泼尼龙治疗2周后再次采集标本设为治疗后组。
所有研究对象均于清晨空腹采集肘静脉血5 mL置肝素于抗凝管中,其中3 mL血液标本进行流式细胞学检测,2 mL血标本离心后留取血浆置EP管中保存在于-80低温冰箱中备用。
1.3.3流式细胞仪检测Th17和Treg细胞百分率:向BD离心管中加入3 mL血液标本和等体积PBS稀释液,采用淋巴细胞分离液密度梯度离心法分离单个核细胞。向BD离心管中加入10 mg/L的布雷菲德菌素A、1 mg/L的离子霉素和0.02 mg/L的佛波酯,于37℃、5%(体积分数)2CO2培养箱孵育4 h。以3000r/min(离心半径13.5 cm) 离心5 min,弃上清液收集细胞,调整细胞浓度至1×106/mL,取细胞悬液300 μL,加入10 μL CD4-APC抗体,室温避光孵育30 min,4%(质量浓度L)多聚甲醛固定20 min,PBS洗涤后离心弃上清,加破膜缓冲液作用10 min。测定管中加入相应的IL-17A-FITC和FOXP3-PE抗体各10 μL,对照管中加入相应的同型对照,室温避光孵育30 min,以PBS充分洗涤,加300 μL 1%(质量浓度)多聚甲醛固定,上机检测,以CD4+T 细胞射门,Th17细胞百分率即检测CD4+IL-17+双阳细胞所占的百分比,Treg细胞百分率即检测CD4+FOXP3+双阳细胞所占百分比,每份标本采集的细胞数≥20 000个,采用CellQuest分析软件分析Th17和Treg细胞百分率。
1.3.4ELISA法检测血浆细胞因子:严格按照R&D公司酶联免疫吸附试剂盒说明书要求检测血浆中IL-17A、IL-23、IL-6、IL-10、IL-35和TGF-β水平。分别比较RRMS组治疗前与对照组、RRMS组甲泼尼龙治疗前后上述各因子水平,并分析RRMS 组患者治疗前Th17细胞百分率与上述各因子水平的相关性。
1.4统计学处理采用 SPSS 18.0软件包对进行统计分析。所有数据以均值±标准差表示。组间差异比较采用独立样本t检验分析。Th17细胞与IL-17、IL-23、IL-35、IL-6、IL-10及TGF-β水平的相关性分析采用Spearman相关分析。以P<0.05表示差异具有统计学意义。
2 结果
2.1RRMS组治疗前后EDSS评分比较RRMS组治疗前EDSS评分为(6.31±1.54)分,高于治疗后〔(4.02±0.68)分〕,差异具有统计学意义(t=0.75,P<0.05)。
2.2两组患者外周血Th17和Treg细胞百分率比较RRMS组治疗前Th17细胞百分率〔(15.24±2.54)%〕明显高于对照组〔(3.12±1.27)%〕(t=0.91,P<0.05),而Treg细胞百分率〔(11.12±3.13)%〕明显低于对照组〔(35.04±4.21)%〕(t=-0.93,P<0.05),Th17/Treg比例,与对照组(0.10±0.02)相比,RRMS组治疗前(1.51±0.62)也明显升高。与RRMS组治疗前〔(15.24±2.54)%〕相比,甲泼尼龙治疗后Th17细胞百分率〔(4.24±1.14)%〕明显降低(t=0.88,P<0.05);与RRMS组治疗前〔(11.12±3.13)%〕相比,治疗后Treg细胞百分率〔(23.14±2.86)%〕明显升高(t=-0.79,P<0.05);Th17/Treg比例,与RRMS组治疗前(1.51±0.62)相比,甲泼尼龙治疗后(0.19±0.07)显著降低(t=0.95,P<0.01)(图1)。
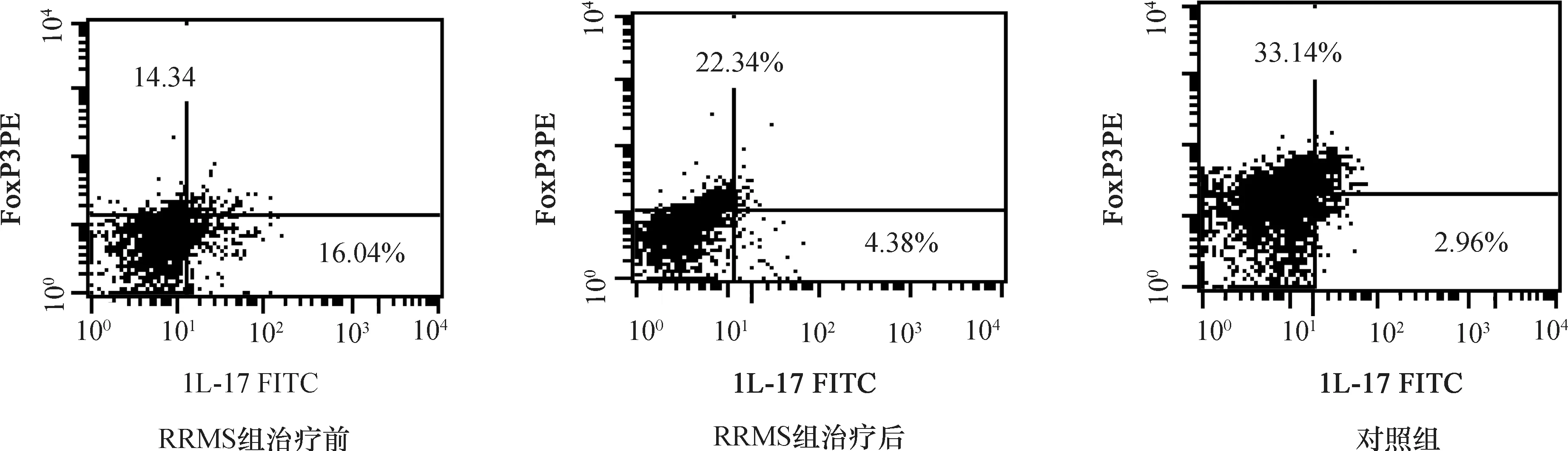
图1 三组患者外周血Th17/Treg细胞FCM图
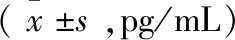
表1 RRMS组治疗前与对照组血浆IL-17A、IL-23、IL-6、IL-10、IL-35 和 TGF-β水平比较
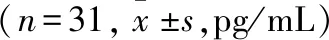
表2 RRMS组患者治疗前后血浆IL-17A、IL-23、IL-6、IL-10、IL-35 和 TGF-β水平比较
2.3RRMS组治疗前与对照组血浆IL-17A、IL-23、IL-6、IL-10、IL-35和TGF-β水平比较RRMS组治疗前IL-17A、IL-23、IL-6和IL-10水平均明显高于对照组(P<0.05;P<0.01),而IL-35 和 TGF-β水平显著低于对照组(分别P<0.05、P<0.01)。具体见表1。
2.4RRMS组患者治疗前后血浆IL-17A、IL-23、IL-6、IL-10、IL-35和TGF-β水平比较与治疗前比较,RRMS组治疗后IL-17A、IL-23和IL-6水平明显降低(P<0.05),IL-35和TGF-β水平明显升高(P<0.05;P<0.01),IL-10水平两者差异无统计学意义(P>0.05)。具体见表2。
2.5RRMS组Th17细胞百分率与IL-17A、IL-23、IL-6、IL-10、IL-35和TGF-β水平的相关分析Th17细胞百分率与IL-17A(r=0.89,P=0.002)、IL-23(r=0.71,P=0.038)和IL-6(r=0.83,P=0.021)水平呈正相关,与IL-35(r= -0.82,P=0.001)和TGF-β(r=-0.74,P=0.042)水平呈负相关;与IL-10水平无相关性(r=0.31,P=0.058)。
3 讨论
过去普遍认为,传统的Th1/Th2细胞失衡是MS的重要免疫发病机制,随着研究不断深入,Th1/Th2细胞失衡不能很好地解释MS这类自身免疫性疾病的发生。近年来Th17/Treg细胞成为自身免疫性疾病中的研究热点,Th17和Treg细胞是两类独立的CD4+T细胞,在IL-6和TGF-β共同作用下初始CD4+T细胞向Th17细胞分化,在仅有TGF-β的情况下向Treg细胞分化。Th17细胞活化后产生IL-17、IL-21、IL-23、IL-6、IL-29和TNF-α等多种细胞因子(以IL-17A为主),这些细胞因子可以诱导促炎性细胞因子、趋化因子和基质金属蛋白酶的表达,引起组织细胞炎性浸润和组织破坏[2], 引起自身免疫性疾病的发生。已有研究表明在MS动物模型自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)大鼠外周血中Th17细胞百分率明显升高[3]。于周等[4]的研究表明在MS患者外周血中CD4+IL-17+T细胞比例显著高于对照组,且外周血清中IL-17和IL-23水平也明显升高。梁君利等[5]的研究表明在RRMS患者病灶中IL-17转录上调,且脑脊液中IL-17表达明显高于健康对照组。本研究发现RRMS患者Th17细胞百分率高于对照组,血清中Th17细胞的三种功能蛋白IL-17A、IL-23和IL-6表达水平显也具有相同的变化趋势,且这三种细胞因子水平均与Th17细胞百分率呈正相关性,可以间接证明IL-6在Th17细胞分化中发挥了关键作用。IL-23是在Th17细胞分化起始后的存活、功能维持及介导免疫应答中发挥不可或缺的作用[6],研究结果初步提示Th17及相关因子的高表达参与了RRMS的发生过程,但其具体的机制还有待深入研究。
Treg细胞是近几年发现的具有强大免疫抑制功能的CD4+T细胞亚型之一,业已证明,Foxp3+Treg可以调节机体对外源性抗原免疫反应的程度,其数量减少和功能失调与多种疾病如自身免疫性疾病、过敏性疾病、感染性疾病等密切相关,它主要是通过细胞分泌的细胞因子,如IL-35、IL-10和TGF-β等发挥负性的免疫调节作用。有研究表明,Treg细胞抑制Th17细胞分化是通过其特异性转录因子Foxp3发挥作用,或是通过下调细胞因子IL-17和IL-23的表达抑制Th17细胞分化[7]。周冬亮等[8]的研究中发现MS患者外周血中Treg细胞减少、功能降低, 受Treg细胞负调控的Th17细胞增加, Th17细胞和DC细胞分泌的促炎因子诱发一系列自身免疫级联反应, 最终导致髓鞘脱失和轴突损害, 引发一系列MS临床症状。Jamshidian 等[9]研究发现Treg细胞百分率和Treg/Th17比值与MS的临床症状严重程度呈负相关。本研究中发现RRMS组外周血Treg细胞百分率明显低于对照组, ELISA检测Treg细胞功能蛋白发现IL-35和TGF-β水平明显降低,且两者与Th17细胞百分率呈负相关,可能是IL-35参与抑制FOXP3的表达进而使Treg细胞免疫功能下降[10]。RRMS组IL-10水平显著升高,与Th17细胞百分率无相关性,原因可能是IL-10虽然是Treg细胞的功能蛋白,但并不是仅由Treg细胞分泌,Th2和Th9细胞也可以大量分泌IL-10,故当RRMS时Treg细胞分泌IL-10减少,但Th2 和Th9细胞仍然可以大量分泌IL-10,所以发生RRMS时IL-10水平是升高的;也有可能是因为IL-10是炎性抑制因子,当发生RRMS炎性反应时,IL-10反应性增高,具体的原因还有待深入研究。另外,甲泼尼龙治疗急性期RRMS起效快,效果良好,治疗后EDSS评分明显降低,Th17细胞表达下调,Treg细胞表达上调,纠正Th17/Treg失衡,同时相关的功能蛋白也发生相应改变,其机制可能是因为甲泼尼龙作为一种合成的糖皮质激素具有强大的抗炎和抗过敏作用,抑制RRMS患者Th17细胞的炎性反应。有研究报道证实甲泼尼龙冲击治疗RRMS患者使其血清中IL-23和IL-17水平降低。也有报道称甲泼尼龙冲击治疗RRMS患者后,CD4+CD25+T细胞比例明显升高,TNF-α和干扰素-γ水平减低,IL-10水平升高。正常生理情况下Th17和Treg细胞之间相互拮抗和制约,维持两者的生理平衡是机体抗感染免疫和自身免疫耐受的重要机制,而甲泼尼龙是通过抑制Th17细胞的炎性反应,还是通过上调Treg细胞,恢复其功能来抑制Th17细胞的炎性反应,或是调节细胞因子水平来改善病情,还是几种机制协同存在发挥作用仍有待进一步研究。
综上,本研究结果显示,RRMS的发生与Th17/Treg比例失衡关系密切,且在RRMS的发生发展中,Th17/Treg相关细胞因子相互协同或制约发挥着重要的免疫调节作用,希望在今后的科研及临床工作中,研究者们可以以此为切入点,能为RRMS患者提供更有效、更精准的治疗方法。

