益生菌和复合营养剂对鱼虾混养池塘水质及细菌群落结构的影响
陈锦豪,郑锦滨,毛 勇,2,苏永全,王 军
(1.厦门大学 海洋与地球学院,福建 厦门 361005; 2.厦门大学 近海海洋环境科学国家重点实验室,福建 厦门 361005 )
水质优劣是水产养殖成败的关键,优良的水质能够为养殖生物提供良好的生存环境,直接影响到水产养殖的经济效益。随着水产养殖业的快速发展,养殖规模的不断扩大,尤其是高密度集约化养殖模式的应用,养殖过程中有害污染物的积累严重破坏养殖水体生态环境,养殖水域环境质量日益下降,各种养殖疾病频繁发生,严重制约水产养殖业的可持续健康发展。在水产养殖中通常采用化学药物和抗生素进行养殖环境的改善和病害的控制,但传统的水处理方法费用高,对生态环境造成不良影响,而且抗生素的长期使用也带来了一系列负面影响,如细菌耐药性产生、养殖动物体内抗生素的积累,动物肠道微生物平衡被破坏等[1]。因此,维持良好的水质条件并减少化学药物和抗生素的使用,是确保水产养殖业可持续健康发展的必然选择。益生菌具有降解水体中有害物质、净化水质的功能,且具有成本低、无毒副作用、不污染环境等特点,已被广泛应用于水产养殖中,并取得良好效果[2]。传统的养殖实践中以添加无机氮磷元素或有机粪肥为主,由于营养成分单一,易引起养殖水环境生态环境失调[3]。通过联合使用益生菌和营养物质提高水质净化效果和养殖动物品质的研究鲜有报道。本研究通过向鱼虾混养池塘中添加益生菌和复合营养剂对养殖水环境进行生态调控,探讨其对养殖池塘水质和细菌群落结构的影响,评价联合使用益生菌和复合营养剂对养殖水体环境的调控效果,以期为鱼虾健康养殖及改善水体生态环境提供理论依据。
1 材料与方法
1.1材料有机玻璃水样采集器(1 L);透明度盘;盐度计(杭州陆恒生物科技);GM-0.5A无油隔膜真空泵(天津津腾);砂芯过滤装置(1 000 mL);0.22 μm滤膜;TCBS琼脂培养基;氨氮检测试剂盒(厦门利洋水产科技);亚硝酸氮检测试剂盒(厦门利洋水产科技);便携水质检测仪(青岛邦邦信息科技)。
1.2养殖池塘水质调控方法试验在3 000 m2的鱼虾混养池塘中进行,混养对象为凡纳滨对虾(Litopenaeusvannamei)与黄鳍鲷(Acanthopagruslatus)。凡纳滨对虾苗种[体长(0.6 ± 0.05)cm]来自海南中正水产科技有限公司,放苗数15万尾;黄鳍鲷为福建省诏安县养殖户的标粗苗,放养规格为2~4 cm,放苗密度为62~94尾·hm-2。本实验使用的益生菌为商品化复合益生菌制剂调水先锋(厦门欣蓝瑞生物科技有限公司,含酵母菌、乳酸菌、芽孢杆菌、光合细菌、硝化细菌等,有效活菌含量60亿个·mL-1以上),复合营养剂为氨基酸肽肥(厦门欣蓝瑞生物科技有限公司,含氨基酸、多肽、氮、磷、钾和微量元素等)。方法如下:复合益生菌制剂和复合营养剂各10 L,全池泼洒,7 d 1次。
1.3养殖池塘水质测定方法每日上午10:00测定养殖池塘的温度、盐度、pH、溶解氧、透明度,每3 d检测1次氨氮、亚硝酸盐、弧菌数。测定方法:使用便携水质检测仪测定池塘水下约20 cm处温度、pH和溶解氧;使用有机玻璃水样采集器采集水下20 cm的池水,使用盐度计测定盐度;使用黑白盘法测定池水透明度,具体方法为将黑白盘缓缓放入池中,至看不见白盘后,记录第1次读数,继续下沉黑白盘至看不见的深度,再缓缓将其拉起,至看见白盘后,记录第2次读数,2次读数的平均值即为池水透明度;池塘内分别设置5个采样点(池塘四角和中央),采集水下20 cm水样,混匀,使用氨氮试剂盒、亚硝酸氮试剂盒,参照试剂盒说明书测定相应水质参数;使用灭菌海水将采集的水样稀释10倍,取100 μL涂布于TCBS琼脂培养基平板上,设置3个平行组,30 ℃恒温培养24 h后,记录弧菌数。
1.4水体细菌群落结构分析
1.4.1 样品采集当养殖池塘水色稳定时(茶褐色),于池塘内设置5个采样点,用1 L的采水器分别采集水样(水下20 cm),将水样等量混合后取1 L,0.22 μm滤膜抽滤,所得滤膜即为所需样品,-80 ℃保存待测。
1.4.2 样品测序运用Illumina HiSeq2500测序平台,构建小片段文库进行双末端(Paired-End)测序,对养殖水体细菌微生物16S rRNA V3-V4区(基因的2个高变区)进行多样性测序分析(水体细菌微生物多样性分析由美因生物科技有限公司完成)。
1.4.3 测序数据处理与分析测序得到的原始下机数据(Raw reads))经过拼接、过滤,得到Clean Tags,Clean Tags经过嵌合体的去除得到有效数据(Effective Tags),基于质控合格的有效数据进行后续生物信息分析:根据特定的阈值(默认选取97%)进行OTU聚类,结合微生物目前最权威的数据库——SILVA数据库进行物种注释和物种分类分析。根据物种注释结果,选取样本在门、纲、目、科、属 5个分类级别上最大丰度排名前 10 的物种,生成物种相对丰度柱形累加图,并得到样品OTU数量统计结果。测序分析流程见图1。
2 结果与分析
2.1养殖水体理化因子和弧菌浓度变化试验期间养殖池塘水温、盐度、pH、溶解氧、透明度、氨氮、亚硝酸盐和弧菌浓度的变化范围分别在(26.37±1.94)℃,(28.44±1.04) mg·L-1,(8.32±0.33) mg·L-1,(8.22±3.48) mg·L-1,(22.23±3.57)cm,(0.2±0.09)mg·L-1,(0.06±0.04)mg·L-1,4×102~35×102cfu·mL-1(表1)。添加益生菌和复合营养剂后,养殖水体透明度增大,且维持在(22.66±2.88)cm。养殖水体中的氨氮和亚硝酸盐浓度分别在实验后期(25 d)和中期(10 d和16 d)有所升高,但均在养殖鱼虾适宜范围内(表1)。添加益生菌后养殖水体中弧菌浓度在试验前期和中期(1~19 d)总体呈下降趋势,后期(22~25 d)恢复至起始浓度(表1)。
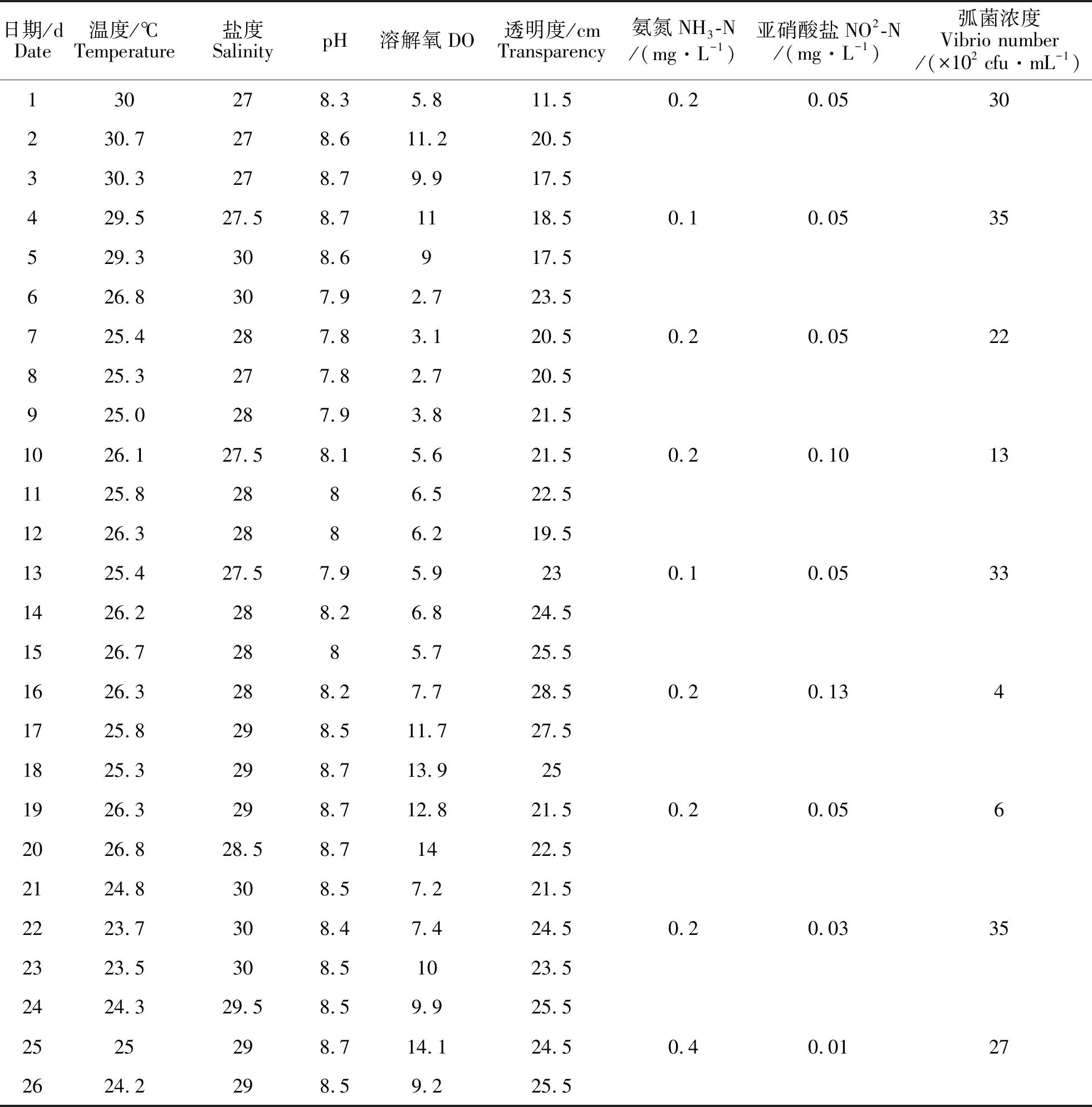
表1 水质指标检测结果
注:第6~9天,天气闷热、无风,故DO较低
Note: Low DO was due to the fact that it was hot without wind on days 6-9.
2.2细菌多样性分析
2.2.1 高通量测序数据水体样品经Illumina HiSeq2500平台测序后得到下机数据Raw PE共114 397条,经过拼接和质控后得到103 384条Clean Tags,经过嵌合体过滤后得到102 842条Effective Tags,碱基质量值Q30比例大于93.00%。使用USEARCH方法,对样品的Effective Tags进行聚类,以97%的一致性,将水样所得的序列聚类成OTU,本实验得到的OTU数目为1 878。以OTU中出现频数最高的序列为该OTU代表序列;利用OTU代表序列进行分类注释,采用算法为UCLUST算法,考序列为Silva数据库,分类水平为界(kingdom)、门(phylum)、纲(class)、目(order)、科(family)、属(genus)、种(species);根据注释情况,统计样品注释到各个分类水平上的序列数目,样品在界、门、纲、目、科、属、种上的OTU数目分别为4,43,79,91,652,952和16,其中,注释到属的OTU数目所占比例超过50%,说明样本OTU注释效果好。测序数据质控结果统计如表2所示。
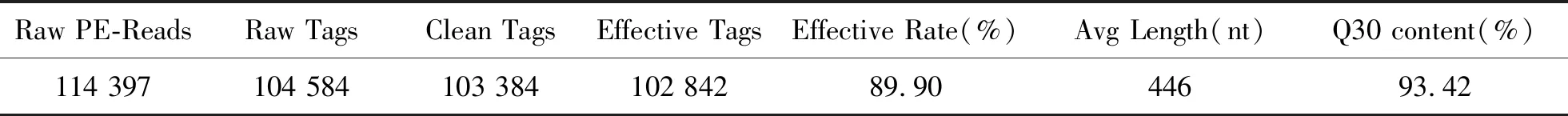
表2 测序数据质控结果
注: Raw PE-Reads:原始下机的PE-Reads数目;Raw Tags:拼接得到的Tags序列;Clean Tags:Tags过滤低质量和短长度Tags后的序列;Effective Tags:过滤嵌合体后,最终用于后续分析的Tags序列;Effective Rate:Effective Tags占Raw PE-Reads的比例; Avg Length:Effective Tags的平均长度; Q30contont:Effective Tags中碱基质量值大于30(测序错误率小于0.1%)的碱基所占的百分比
Note: Raw PE-Reads: The number of PE-Reads from the original machine; Raw Tags: Tags sequences obtained by splicing; Clean Tags: The sequence that filter the low quality and short length Tags; Effective Tags:Tags sequence that are finally used for subsequent analysis after filtering the chimera; Effective Rate(%): The proportion of Effective Tags in Raw PE-Reads; AvgLength: The average length of Effective Tags; Q30content: The percentage of bases that the quality of base is greater than 30 ( The sequencing error rate less than 0.1%) in the Effective Tags
2.2.2 物种相对丰度水体中的优势菌门为蓝细菌门(Cyanobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes),其相对丰度分别为38.19%,28.11%,18.85%,12.85%,0.76%,0.37%和0.08%;优势纲蓝细菌纲(Cyanobacteria)、α-变形菌(Alphaproteobacteria)、放线细菌纲(Actinobacteria)、酸微菌纲(Acidimicrobiia)、鞘脂杆菌纲(Sphingobacteriia)、拟杆菌纲(Flavobacteriia)的相对丰度分别为36.39%,24.87%,8.95%,8.85%,7.47%和4.86%;优势目SubsectionI、红细菌目(Rhodobacterales)、酸微菌目(Acidimicrobiales)、微球菌目(Micrococcales)、鞘脂杆菌目(Sphingobacteriales)、黄杆菌目(Flavobacteriales)的相对丰度分别为36.21%,22.22%,8.95%,7.88%,7.47%和4.86%;优势科FamilyI、红细菌科(Rhodobacteraceae)、酸微菌科(Acidimicrobiaceae)、微杆菌科(Microbacteriaceae)、腐螺旋菌科(Saprospiraceae)、黄杆菌科(Flavobacteriaceae)的相对丰度分别为36.21%,22.22%,8.68%,7.87%,7.19%和3.59%;优势属原绿球藻属(Prochlorococcus)、Marivita、聚球藻属(Synechococcus)、CandidatusAquiluna、Phaeodactylibacter的相对丰度分别为27.46%,8.05%,7.95%,5.05%和4.54%。从养殖水体中鉴定到的主要益生菌为红螺菌科(Rhodospirillaceae)细菌、蛭弧菌属(Bdellovibrio)细菌、芽孢杆菌属(Bacillus)细菌、乳杆菌属(Lactobacillus)细菌,其相对丰度分别为0.09%,0.002%,0.006%和0.02%。
3 讨 论
本研究通过联合使用益生菌和复合营养剂对鱼虾混养池塘进行生态调控,结果表明,该调控方式能够维持养殖水环境pH、溶解氧、透明度、氨氮、亚硝酸盐和弧菌浓度等重要水质指标在养殖鱼虾适宜范围内。细菌群落结构分析表明,添加益生菌和复合营养剂后,养殖水体中细菌多样性水平较高,含有红螺菌科(Rhodospirillaceae)细菌、蛭弧菌(Bdellovibrio)、芽孢杆菌属(Bacillus)细菌与乳杆菌属(Lactobacillus)细菌等水产养殖中的常见益生菌,为养殖水产动物创造良好的生态环境。试验前期,笔者通过走访调查,发现本研究中的鱼虾混养在养殖的过程中水色较为稳定,故对其进行研究,分析其细菌群落结构,为后续益生菌的筛选和鉴定奠定基础,故未设置对照组。
3.1添加益生菌和复合营养剂对鱼虾混养池塘pH值的影响pH值不仅是海水水质的重要指标,同时也影响着水生生物一系列代谢活动,是反映水质是否适合鱼虾生存的依据。水产养殖中pH的适宜范围为6.5~9,鱼虾最适宜的范围是7~8.5[4],而海水养殖品种的适宜pH一般在7.5~8.5,其中黄鳍鲷的最适pH为7.5~8.6[5],凡纳滨对虾的最适pH为7.7~8.6[6]。pH值过高或过低,都会对养殖生物造成不同程度的损害,甚至死亡。本试验中养殖水体pH的范围在7.8~8.7之间,适合黄鳍鲷和凡纳滨对虾的养殖,这与李斌等[7]关于生物絮团对水质调控作用的研究结果相似,在添加微生态制剂后,其各试验组pH变化范围在7.9~8.5之间,表明添加益生菌和复合营养剂能够稳定水体pH,起到改善水质的作用。
3.2添加益生菌和复合营养剂对鱼虾混养池塘溶解氧的影响溶解氧(Dissolved Oxygen,DO)影响着养殖动物的摄食量、饵料系数、抗病力等[8],同时也是判定养殖池塘水质好坏的重要指标之一。研究结果表明[9],鱼虾类养殖水域溶解氧应保持在5~8 mg·L-1,过高或过低的溶解氧都会影响到养殖动物的生长、发育。
3.3添加益生菌和复合营养剂对鱼虾混养池塘透明度的影响透明度是表示光透入池塘水中深浅的程度,是池塘养殖水质的重要度量参数之一。文献[10-11]研究结果表明,在池塘养殖中,池水透明度的适宜范围在25~40 cm,透明度过高或过低,说明水体过清或过肥,均会影响养殖生物的正常生长。本试验中,添加益生菌和复合营养剂后,养殖水体透明度维持在22.66±2.88,适合黄鳍鲷和凡纳滨对虾的养殖。
3.4添加益生菌和复合营养剂对鱼虾混养池塘氨氮浓度的影响氨是水体中各种生物蛋白质代谢的重要终产物,并且氨可以通过细菌的硝化作用被氧化为亚硝酸盐,水中一定量的氨氮及亚硝酸盐含量都会对鱼虾的健康造成影响,故而氨氮、亚硝酸盐是衡量养殖水质的重要标准[12]。据研究报道,黄鳍鲷养殖池塘中氨氮应低于0.5 mg·L-1,亚硝酸盐低于0.3 mg·L-1[5],凡纳滨对虾养殖池塘中氨氮应低于0.6 mg·L-1,亚硝酸盐应低于0.2 mg·L-1[13]。过高的氨氮及亚硝酸盐浓度都会对养殖动物造成不同程度的危害。当氨氮含量高于0.2 mg·L-1时,会使养殖动物出现慢性中毒或急性中毒,慢性氨氮中毒主要表现为摄食强度降低,生长受阻,组织损伤,降低了氧在组织间的运输;急性氨氮中毒表现为养殖动物行动亢奋,在水中失去平衡能力,严重者死亡[14-15]。亚硝酸盐是氨转化为硝酸盐过程中的中间产物,当转化过程受到阻碍,中间产物的亚硝酸盐就会在水体中积累,对鱼虾的毒性较强[9]。当亚硝酸盐含量高于0.2 mg·L-1时,养殖的水生动物表现厌食、游动缓慢、反应迟钝、呼吸急促、时常到水面上呼吸、体色深暗及鳃丝暗红[14];研究表明,一定质量的亚硝酸盐会使养殖动物血液中的血红蛋白被氧化成高铁血红蛋白,血液载氧能力下降,造成动物缺氧,甚至窒息死亡,尤其对血蓝蛋白载氧能力的破坏被认为是其对虾类产生毒性的主要机制之一[14,16]。宋协法等[17]报道了添加益生菌对半滑舌鳎养殖水质及仔稚鱼生长的影响,结果表明,添加益生菌与复合营养剂能够使养殖水体pH、氨氮和亚硝酸盐维持在适宜范围。邹文娟等[18]研究结果表明,添加光合细菌与枯草芽孢杆菌对污水中氨氮、亚硝酸盐的降解效果较好,氨氮与亚硝酸盐的降解率分别达到了86.13%与71.96%。谢永斌等[3]的研究发现,添加益生菌与复合营养剂能够明显降低水中氨氮及亚硝酸氮含量[氨氮(0.17±0.1) mg·L-1;亚硝酸氮(0.07±0.00)mg·L-1],对水环境具有较好的改善作用。聂伟[19]报道了添加由絮凝活性菌株培育的生物絮团对水质的影响,结果表明,添加由枯草芽孢杆菌培育的生物絮团能显著降低水中氨氮及亚硝酸盐含量[氨氮(0.14±0.05)mg·L-1;亚硝酸盐(0.055±0.012)mg·L-1],起到净化水质的作用。本研究中,通过向鱼虾混养池塘中添加益生菌和复合营养剂,使养殖水体中氨氮及亚硝酸盐的变化范围分别在(0.2±0.09)mg·L-1与(0.06±0.04)mg·L-1之间,维持在黄鳍鲷和凡纳滨对虾养殖的适宜范围内。
3.5添加益生菌和复合营养剂对鱼虾混养池塘弧菌浓度的影响在水产养殖过程中,弧菌是一种常见的细菌,部分弧菌能够降解养殖水体中的有机物,对水质的净化具有积极的意义,但在导致养殖水产动物感染的病原菌中,致病性弧菌占有较高比例,不仅给水产动物健康带来高风险,也给海水养殖产业造成严重的经济损失。在本试验中共检测到罗尼氏弧菌(Vibrioshilonii)、副溶血弧菌(Vibrioparahaemolyticus)和创伤弧菌(Vibriovulnificus)3种致病弧菌,仅占总细菌微生物的0.06%。研究结果表明,副溶血弧菌的变异种可能是导致凡纳滨对虾养殖过程中“早期死亡综合征(Early mortality syndrome,EMS)”发病的病原菌,对养殖业危害极大[20]。倪军等[21]的研究发现,当水中副溶血弧菌接种密度为2.5×104cfu·mL-1时,10 d内对虾累计死亡率高达98%,接种密度为5.0×103cfu·mL-1时,10 d内对虾累计死亡率达到72%。本试验期间养殖水体中副溶血弧菌的浓度范围为1.0×102~5×102cfu·mL-1,低于上述致死浓度,说明该调控方式能使养殖水体弧菌数量维持在安全范围内。这可能是由于添加益生菌和复合营养剂后增加了养殖水体中枯草芽胞杆菌的数量,进入水体后能够通过分泌相关的杀菌物质,如有机酸、抑菌素等,对有害菌起到一定的抑制作用,从而抑制了病原菌的生长[22-23]。
3.6添加益生菌和复合营养剂对鱼虾混养池塘细菌群落结构的影响对添加益生菌和复合营养剂后鱼虾混养池塘细菌群落结构的分析表明,水体中相对丰度占主要优势的细菌微生物是蓝细菌门(Cyanobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、绿弯菌门(Chloroflexi)和厚壁菌门(Firmicutes),占总细菌微生物的98%以上,为水体菌群主要组成成分[24-25];其中,蓝细菌们细菌数量最多,占总细菌微生物的38.19%,厚壁菌门细菌仅占总细菌微生物的0.08%,这与郑佳佳等[26]关于复合益生菌对草鱼养殖水体水质和菌群结构影响的研究结果相似,说明添加益生菌打破原有水体的微生态平衡,形成新的优势种群,改善了水质条件。蓝细菌门中,原绿球藻属(Prochlorococcus)与聚球藻属(Synechococcus)分别占总细菌微生物的27%与8%,属于光和细菌,也是海洋微型蓝细菌最重要的2个类群,在大洋中分布广且数量多,是全球海洋初级生产力的主要贡献者[27]。变形菌门中,α-变形菌纲(Alphaproteobacteria)、β-变形菌纲(Betaproteobacteria)、红螺菌科(Rhodospirillaceae)及蛭弧菌属(Bdellovibrio)分别占总细菌微生物的24.87%,0.25%,0.09%和0.002%。研究表明,α-变形菌纲和β-变形菌纲对多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)具有降解作用,可以利用PAHs进行生长[28];红螺菌科细菌是在水产养殖中主要运用的一类光合细菌,具有净化水质,促进动物生长、提高动物免疫力和减少动物病害的作用[29-31];蛭弧菌(Bdellovibrio)能够在较短的时间内裂解弧菌、气单胞菌、假单胞菌、沙门菌和志贺菌等常见病原菌,将这些病原菌限制在较低的数量水平,同时又可以有效地控制水体中的氨氮、亚硝酸盐、硫化物等有害物质[32]。放线菌门占总细菌微生物的18.85%,研究结果[33-34]表明,放线菌门中放线菌(Actinomycetes)能够释放多种水解酶降解水中有机质来改善水质,且菌体本身营养丰富,从而促进鱼虾生长,保证鱼虾健康;同时,它能够产生拮抗化合物或竞争生存位点来预防和控制病原菌,以此降低病原菌带来的危害。Cottrell等[35]研究结果指出,拟杆菌门细菌是海洋中溶解性有机物的主要消费者,能够降解水体中动物的粪便以及残留的饵料等有机物。本试验中,拟杆菌门中的Flavobacteriia纲占总细菌微生物的5%,它能降解海水中高分子有机物,净化池塘水质,影响着养殖动物的生存情况[36]。海洋环境与土壤环境中广泛分布着疣微菌门细菌,本试验中疣微菌门细菌占总细菌微生物的0.76%,目前对该门类细菌生态功能的了解甚少,且多数该门类细菌属于不可培养微生物[36-37]。绿弯菌门细菌也被称作绿色非硫细菌(green non-sulfur bacteria),是细菌界中一个非常多元化的类群,本试验中该门类细菌占总细菌微生物的0.37%,该门类细菌代谢类型多元化,包括厌氧光合自养菌,能够通过氧化亚硝酸盐营化能无机营养,进行硝酸盐或铁还原,以及严格好氧或兼性厌氧菌,能够进行还原脱氧营厌氧生长等[38]。厚壁菌门中,芽孢杆菌属(Bacillus)细菌与乳杆菌属(Lactobacillus)细菌是水产养殖中的常用益生菌,分别占总微生物的0.006%与0.02%。研究结果表明,益生芽孢杆菌(Bacillus)可分泌各种消化酶,帮助动物对营养物质的消化吸收,促进生长,同时抑制病原微生物,调节免疫活性及改善水体环境,直接或间接地保护水产动物免受病原菌的感染[39-40];乳酸杆菌(Lactobacilli)可通过产生抗菌物质或通过竞争营养或肠道黏附位点来抑制致病菌,通过诱导黏付素的分泌或阻止细胞凋亡而增强肠道的屏障功能,从而保护肠道并增强动物机体免疫力及抵抗力[41-42]。

