167例胃肠道神经内分泌肿瘤的内镜表现及病理特征回顾性分析
苏 惠, 李 娜, 王海红, 赵晓军, 金 鹏, 何玉琦, 杨 浪, 盛剑秋
中国人民解放军总医院第七医学中心消化内科,北京 100700
神经内分泌肿瘤(neuroendocrine neoplasms, NEN)由OBERNDOFER教授在1907年首次描述,是一种临床上相对少见的肿瘤,而胃肠道是常见的发病部位之一,约占NEN的50.6%[1]。由于其较为少见且早期无特异的临床表现,许多临床医师对其认识不充分,易造成误诊或漏诊。本研究分析了2011年至2017年于中国人民解放军总医院第七医学中心诊断的胃肠道NEN的内镜及病理资料,现将结果报道如下。
1 资料与方法
1.1研究对象回顾性收集2011年1月至2017年12月于中国人民解放军总医院第七医学中心消化内科行胃镜、结肠镜检查,并经病理诊断为NEN的患者共167例,男101例,女66例,年龄(50.6±12.6)岁(21~88岁)。所有患者均无类癌综合征的临床表现。
1.2超声内镜检查对部分患者进行了超声内镜检查,使用微型超声探头(Olympus EndoEcho EU-M2000,探头频率20 MHz),采用脱气水充盈法,以确定病变的个数、部位、超源层次、回声及与毗邻脏器的关系。
1.3治疗方式本研究所有患者检查所用胃镜、结肠镜均由奥林巴斯公司(Olympus, Japan)生产。患者的确诊及治疗方式包括活检、内镜下黏膜切除术(endoscopic mucosal resection, EMR)、内镜黏膜下剥离术(endoscopic submucosal desection, ESD)、内镜黏膜下肿物挖除术、腹腔镜辅助内镜联合切除术及外科手术。
1.4病理学检查活检及切除标本均用质量浓度为100 g/L甲醛溶液固定,之后由原陆军总医院病理科进行HE染色。NEN的诊断按照2010年WHO诊断标准,由病理医师根据显微镜下组织形态学特征与相关生物标记物的免疫组织化学染色结果进行诊断。相关的生物标记物包括突触素(synaptophysin, Syn)、嗜铬粒素A(chromogranin A, CgA)等。NEN的分级评估指标包括组织分化程度和细胞增殖活性。增殖活性分级采用核分裂象数(每10个高倍视野)及Ki-67标记率,可分为:G1(低级别),核分裂象数<2,Ki-67 标记率≤2%;G2(中级别),核分裂象数2~20,Ki-67 标记率3%~20%;G3(高级别),核分裂象数>20,Ki-67标记率>20%[2]。
1.5随访以电话随访及门诊随访为主,患者在术后3个月内、6个月及1年时进行胃镜及结肠镜复查,并定期复查腹、盆腔CT。

2 结果
2.1NEN分布在167例患者中,NEN位于上消化道者共37例(22.2%),位于下消化道者共130例(77.8%)。其中,仅发现1处病变即单发病例者154例(92.2%),其中上消化道病变29例,下消化道病变125例。发现2处及以上病变即多发病例共13例(7.8%),其中上消化道病变8例,下消化道病变5例。
2.2超声内镜检查在167例患者中,直接行活检钳除及EMR治疗等病例共35例未行超声内镜检查,其余共132例患者进行了超声内镜检查,结果显示低回声共50例(37.9%),中-低回声53例(40.1%),中回声12例(9.1%),中-高回声16例(12.1%),高回声1例(0.8%)。超声内镜下能够明确病变起源者共125例(包括ESD 121例+双镜2例+外科手术2例),其中位于黏膜层者30例(24.0%),位于黏膜深层即黏膜肌层者40例(32.0%),源于黏膜下层者52例(41.6%),位于固有肌层者3例(2.4%)。NEN在白光内镜及超声内镜下显示最大径≤10.0 mm者147例(88.0%),10.1~20.0 mm者17例(10.2%),>20.0 mm者3例(1.8%)。
2.3处理方式在167例病例中,进行活检钳除诊治者共19例(11.4%),EMR治疗者18例(10.8%),ESD治疗者125例(74.9%),腹腔镜消化内镜双镜联合治疗者2例(1.2%),单纯外科手术者3例(1.8%)。肿瘤大小及其具体处理方式详见表1。
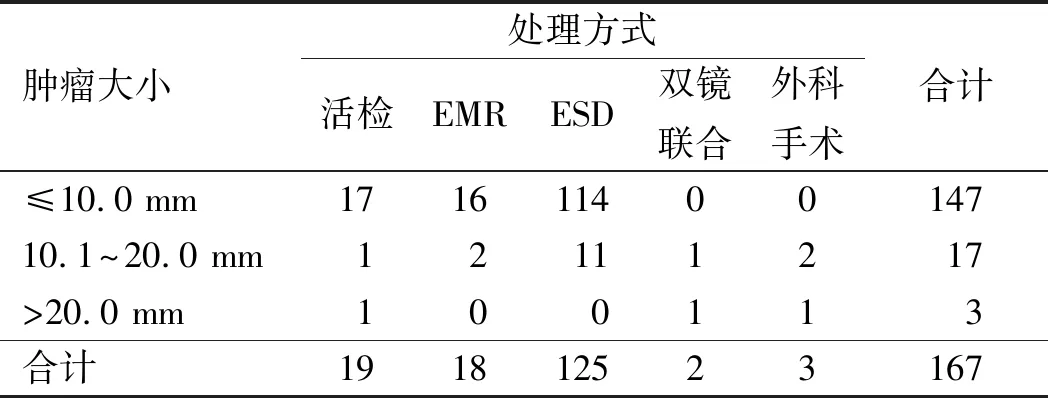
表1 不同大小的NEN处理方式Tab 1 Treatment of NEN of different sizes
2.4病理结果有5例患者经影像学或外科术中发现有远处脏器转移,其中4例转移至肝脏,1例转移至肠系膜淋巴结。其余162例患者均未发现转移证据。在167例患者中,有3例患者未进行免疫组化检查,因此无法进行病理分期,其余164例患者均行免疫组化检查,其中G1期共135例(82.3%),G2期共12例(73.0%),G3期共4例(2.4%),免疫组化检查仍无法分期者13例(7.9%)。
在167例患者中,有38例无法在病理下明确病变起源层次,其余129例(包括EMR 16例,ESD 108例,双镜2例,外科手术3例)可明确起源层次,其中3例(2.3%)源于黏膜层,65例(50.4%)源于黏膜肌层,59例(45.7%)源于黏膜下层,2例(1.6%)源于固有肌层。
2.5超声内镜及病理结果对病变起源层次的判断对比
有110例(ESD 106例+双镜2例+外科2例)病变同时有明确的超声内镜起源层次及病理起源层次,与病理所判断的病变起源层次相比,52例(47.3%)病变的超声内镜提示起源层次相同,32例(29.1%)病变病理起源层次较深,而26例(23.6%)病变则超声提示起源层次较深。
2.6免疫组化指标结果G1+G2+G3共151例,此151例均进行Syn及CgA染色,Syn阳性者146例(96.7%),Syn阴性者5例(3.3%)。CgA阳性者96例(63.6%),CgA阴性者55例(36.4%)。CgA及Syn均阳性者92例(60.9%)。以上167例病例统计结果见表2。

表2 NEN内镜、病理特征Tab 2 Endoscopic and pathological features of NEN
续表2
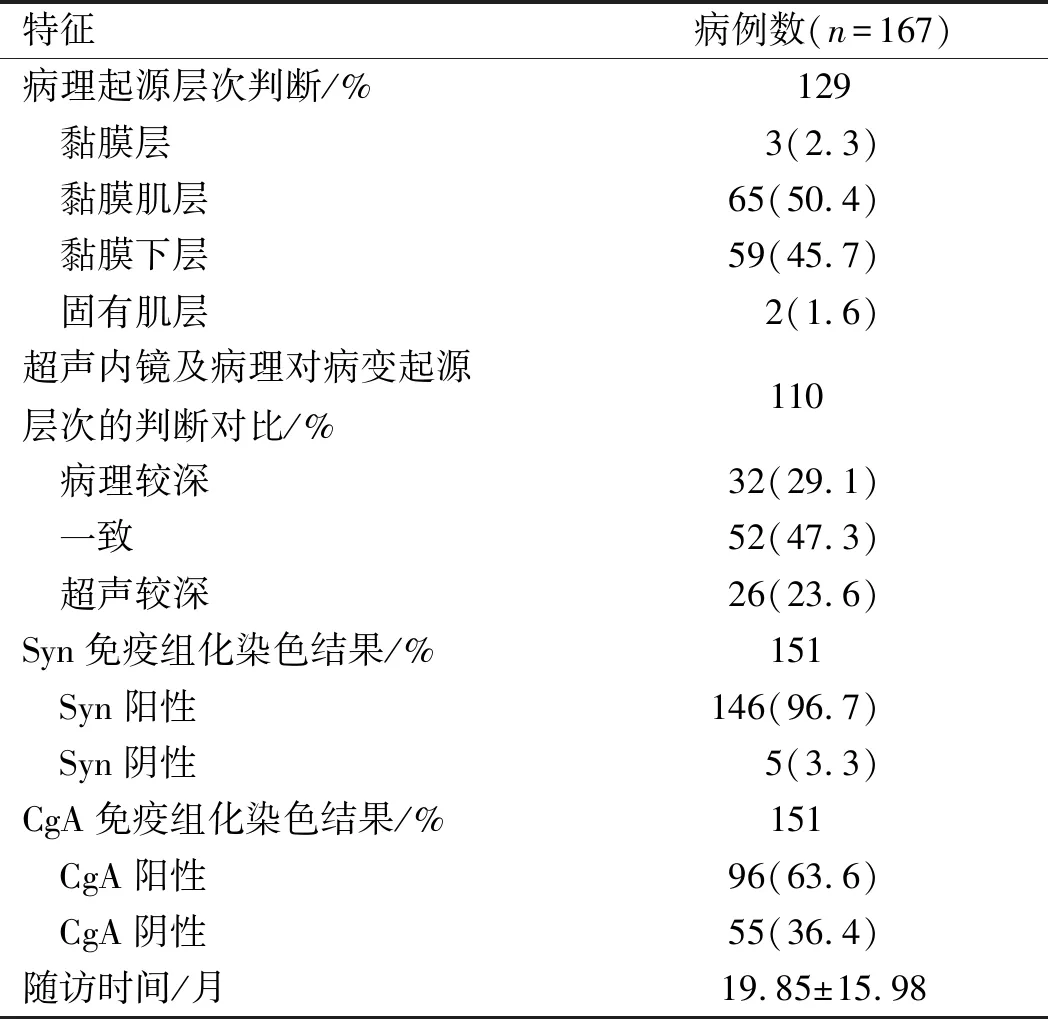
特征病例数(n=167)病理起源层次判断/%129 黏膜层 3(2.3) 黏膜肌层 65(50.4) 黏膜下层 59(45.7) 固有肌层 2(1.6)超声内镜及病理对病变起源层次的判断对比/%110 病理较深 32(29.1) 一致 52(47.3) 超声较深 26(23.6)Syn免疫组化染色结果/%151 Syn阳性 146(96.7) Syn阴性 5(3.3)CgA免疫组化染色结果/%151 CgA阳性 96(63.6) CgA阴性 55(36.4)随访时间/月 19.85±15.98
2.7随访结果167例患者中, 151例于诊断后进行至少1次电话或门诊随访,另16例患者失访。最短随访时间为2个月,最长者为75个月,平均随访时间为(19.83±16.06)个月。有3例确诊时有脏器转移患者在诊断后1年内死亡,其余患者随访中均未发现远处脏器转移,单发患者内镜下治疗后均未发现病变再发。
3 讨论
NEN是一组异质性很高的肿瘤,生物学行为从惰性生长、缓慢生长的低度恶性到容易复发、转移的高度恶性不等。近年来随着国民健康意识增加、胃镜及结肠镜检查的日益普及以及临床医师对其认识逐渐增多,胃肠道NEN的检出率也日趋增多。
胃肠道NEN按其是否分泌激素可分为有功能性NEN及无功能性NEN。有功能性NEN通常是根据患者的临床症状及血清学激素检测结果先进行拟诊,再行胃肠镜检查来定位。而无功能性NEN则大多是在全面而细致的胃肠镜检查或其他影像学检查中偶然发现的。本研究所纳入的167例患者经问诊均无类癌相关临床表现,考虑均为无功能性NEN。其中1例食管NEN患者的就诊原因为吞咽不畅,胃NEN患者的就诊原因大多为腹胀、腹痛及早饱等非特异性症状,直肠NEN的就诊原因大多为体检及结肠息肉切除术后复查等。
2010年第4版世界卫生组织消化系统肿瘤分类对胃肠胰NEN的命名及分类做了修订[3]。基于肿瘤分化程度和增殖活性将胃肠NEN分为:(1)神经内分泌瘤G1(neuroendocrine tumor G1, NET G1),即类癌;(2)NET G2;(3)神经内分泌癌(neuroendocrine carcinoma, NEC),大细胞或小细胞此类型曾被分类为NET G3,但WHO并不推荐再继续使用该分类;(4)混合性腺神经内分泌癌(mixed adenoendocrine carcinoma, MANEC);(5)增生性和癌前病变。而胃NEN(g-NEN)又可分为4型:1型g-NEN是由萎缩性胃底炎继发胃酸缺乏引起,临床表现多为消化不良、大细胞或缺铁性贫血,实验室检查可发现胃泌素升高。内镜常表现为胃底、胃体息肉,65%为多发,也有文献报道女性多发,中位直径5 mm,多数预后良好[4]。但也有研究分析了20例1型胃类癌患者,认为以下因素为发生转移的相关因素:肿瘤≥1 cm、肿瘤增殖指数Ki-67升高及高胃泌素水平(平均2 138.4 mol/L)[4]。提醒临床上对于具有此类特征的胃NEN患者应慎重评估其有无转移。2 型g-NEN则是由于胃泌素瘤分泌大量激素导致高胃泌素血症引起。3型g-NEN多为散发,无胃泌素升高,可以是G1、G2或G3。4 型较少见,恶性度较高,生物学行为类似胃腺癌[5]。本研究中有8例上消化道病变为多发病变,但未行血清胃泌素检测,因此未能进一步分型。
有研究[1]表明,不同性别中NEN的原发部位不同,女性的原发部位更多在肺、胃、阑尾或盲肠,而男性则更多发生于胸腺、十二指肠、胰腺、空回肠或直肠。也有研究报道,食管NEN发病率不足1%[4],在本研究中,167例NEN仅1例(0.6%)发生于食管,与文献报道一致,且该病变肉眼形态为溃疡型肿物生长,仅活检诊断后患者未于我院行进一步治疗,活检病理提示为G3期。因此,对食管NEN的临床特征需积累更多病例。
内镜检查在NEN的发现、诊断、活检、治疗及术后随访方面有着不可替代的重要作用,而超声内镜检查则对于黏膜下肿物的起源、大小及与周围脏器毗邻关系有较准确的评估,同时可对后续内镜处理起到指导作用。NEN内镜下多表现为椭圆形、半球状隆起或息肉样隆起,表面或可见迂曲的血管,也可表现为溃疡或肿物生长。本研究有1例发生在食管的NEN即表现为髓质型肿物,中心凹陷、糜烂、出血,其病理提示NEC。也有1例位于十二指肠乳头部位的NEN表现为环半腔隆起溃疡型肿物,病理提示为G3期NEC。而本研究超声内镜的结果则提示NEN大多来源于黏膜层及黏膜下层,为低回声及中-低回声(共占78%),提示病变较为表浅,可进行后续内镜下治疗。将本研究中病变切除前超声内镜所评估的起源层次与术后病理评估的起源层次进行对比发现,近50%(52/110例,47.3%)的病例二者评估的起源层次相同,提示超声内镜的检查仍然是表现为黏膜下病变NEN的必要检查手段。
NEN的处理方式需要对病变的部位、数量、大小、起源深度、淋巴结转移及周围脏器转移情况进行综合评估后再决定。表浅的、直径≤1 cm的NEN可经EMR或ESD切除,但如果肿瘤直径>2 cm则通常需要行外科手术,必要时应进行淋巴结清扫[6]。而1~2 cm的肿瘤则需要临床医师、内镜医师综合评估后再决定治疗方案。我国2016年发布的胃肠胰神经内分泌肿瘤专家共识指出,对直径<2 cm的结直肠NEN可以考虑内镜下切除[2,7]。有研究分析了直肠<16 mm且无淋巴结转移的NEN分析使用EMR及ESD治疗,结果提示整块切除(en bloc resection)率相似,但病理结果提示ESD的完整切除率显著高于EMR(90.3%vs71%)[8]。本研究中80%以上的NEN患者(147例,88.0%)最大直径在1 cm以内,部分为经过活检及EMR治疗后得以诊断,其余114例为超声内镜检查后行ESD治疗,均为完整切除。本研究中1~2 cm的NEN共17例,其中2例行EMR治疗,11例行ESD治疗,均提示切缘阴性。以上经ESD治疗的患者随访中均未发现肿瘤再发。而3例最大径在2 cm以上的NEN患者中,1例患者因肿瘤较大仅行活检后未于我院行后续治疗,另2例影像学检查未发现有脏器转移情况,分别经双镜联合及外科手术治疗,术后病理提示切缘阴性,随访也未发现内镜下复发。有文献对EMR、改良EMR及ESD在直肠NEN治疗中的有效性及安全性进行了Meta分析,纳入14个研究共782个病例,结果表明,ESD及改良EMR对病变的完整切除率显著高于传统EMR,而ESD与改良EMR对病变的完整切除率差异无统计学意义[7]。结合文献及我们的回顾性分析表明,ESD是治疗NEN的可靠方法,对病变的完整切除率优于EMR,但该技术对内镜医师操作水平要求较高。除内镜及手术治疗外,目前可用于胃肠道NEN的药物包括生长抑素类似物(SSA)、干扰素、依维莫司和化疗等; 对于不同分级的患者首选的治疗方案应该不同[2]。
NEN的病理评估中有2个重要指标:核分裂象和Ki-67标记率。通常核分裂象数与Ki-67 标记率呈正相关;少数情况下,两者可能出现不一致,应采纳分级较高的结果。在手术切除的标本中,核分裂象数和/或Ki-67 标记率均可使用;在活检小标本中,若计数不足50 个高倍视野,依据Ki-67标记率评估分级更为可靠[2]。本研究中根据核分裂象与Ki-67标记率将病变分为G1期、G2期及G3期,除部分病例分期困难外,G1期病例占82.3%,提示绝大多数NEN为分化较好,增殖缓慢的肿瘤,与文献报道一致[9]。而Syn及CgA是所有考虑NEN的免疫组化常规检测项目,有助于病变性质的进一步判定。本研究中Syn阳性率为96.7%,CgA阳性率为63.6%,与既往我中心相关报道一致[9]。
一般来讲,NEN分化较好、生长缓慢、预后良好,但也有部分肿瘤展示出与之相反的特性[10],因此实际上,目前并无一种对其预后有较明确作用的预测因素。文献报道CgA是一项非常有价值的NEN标记物,但血清CgA水平并不能真实地反映机体的肿瘤负荷及结直肠NEN的预后情况[2],因此,规律随访对患者来说非常重要。按照目前指南推荐,随访应包括生化指标、常规影像学检查(CT/MRI)以及内镜检查。总体来说,对于R0/R1切除的NETs (G1/G2),建议每3~6个月复查CT/MRI;而对于NEC(G3)则应每2~3个月进行复查[9]。本研究人群随访的平均时间为19.85个月,提示诊治2年内患者对随访的依从性较好,说明临床上制定个体化随访计划对提高患者依从性尤为重要。

