辽河口滨海湿地CH4排放特征及其影响因素
袁晓敏,杨继松,刘 凯,郑冬梅,郑佳玉,刘 强
1 鲁东大学资源与环境工程学院, 滨海生态高等研究院, 烟台 264025 2 北京师范大学环境学院, 水环境模拟国家重点实验室, 北京 100875 3 沈阳大学环境学院, 区域污染环境生态修复教育部重点实验室, 沈阳 110044
近年来,大气中的温室气体含量升高加速,是目前世界各国学者和政府都很关注的全球性环境及生态问题[1]。工业时代前80万年间,南极大气中CH4浓度在320×10-3mL/m3和780×10-3mL/m3之间波动[2],2012年大气CH4浓度已达到1803×10-3mL/m3,约为工业革命前的3倍[3]。虽然CH4在大气中的浓度较低,但其增温潜势为CO2的10—25倍,对温室效应的贡献达23%[4],并且在大气中的平均存留时间长达10年,远高于CO2的3年。因此减少CH4排放对缓和潜在的全球增温趋势比减少CO2的排放更为有效[5]。

1 研究区域与研究方法
1.1 研究区域概况
辽河口湿地位于盘锦市境内滨海地区,地理位置40°41′03.06″—41°27′42.01″N,121°30′30.29″—122°30′21.33″E。本区域属于温带季风气候区,具有雨热同季、干冷同期的特点,年均降水量611.6—640.1 mm,集中在7—9月,年平均气温9.2℃,每年11月至次年4月为冻土期。土壤盐渍化比较严重,盐化沼泽土按盐分组成分氯化物盐化沼泽土和硫酸盐氯化物盐化沼泽土两个土属,且沿向海方向土壤盐分呈上升趋势。自然湿地类型距海由远及近依次为芦苇湿地(Phragmitesaustraliswetland)、翅碱蓬湿地(Salineseepweedwetland)和裸滩湿地(Mudflat),优势植被依次为芦苇、翅碱蓬,裸滩湿地无植被覆盖。芦苇和翅碱蓬植株生长旺盛期均为6—9月,8月中旬左右,芦苇植株最高2.8—3.2 m,翅碱蓬植株20—22 cm,2016年地上生物量观测最高值分别为(2033.3±256.5) g/m2和(321.9±62.8) g/m2。本试验以3种典型的自然湿地类型为研究样地,选取3个固定观测点,地理坐标分别为(41°14′03.06″N,121°50′30.29″E)(芦苇湿地)、(40°56′03.06″N,121°49′30.29″E)(翅碱蓬湿地)、(40°57′03.06″N,121°42′30.29″E)(裸滩湿地),其中芦苇采样点和翅碱蓬采样点之间的距离约10 km,翅碱蓬采样点和裸滩采样点之间的距离约0.5 km。
1.2 研究方法
1.2.1CH4气体样品采集
采用静态箱-气相色谱法。采样装置由3个部分构成:底座+连接箱+顶箱。底座材料为不锈钢,观测试验前的4月中旬将底座固定在每个采样点;连接箱和顶箱均为不透光的PVC板(厚度3 mm),规格分别为45 cm×45 cm×100 cm和45 cm×45 cm×80 cm。顶箱上安装小风扇,以保证箱内气体混合均匀,侧壁安装三通阀和温度计,用于气体样品的采集和温度测量。采样时将顶箱置于底座之上(植被地上高度超过80 cm后,在底座和顶箱之间添加连接箱),并在底座凹槽中持续加水,利用液封来提高采样装置密闭性。扣箱后立即开始计时,并用100 mL注射器于扣箱后的0、10、20、30 min依次采集气体,采集的气体通过三通阀注入铝塑复合气袋(化工部大连光明化工研究所生产,250 mL)。考虑涨潮过程对CH4气体排放的影响,在翅碱蓬湿地和裸滩湿地研究样点,同一采样日期内均在涨潮前2个小时采集涨潮前的气体样品,当潮水水位达到10 cm时,开始采集涨潮中的气体样品。涨潮过程中,平潮时间约30 min,潮水最高水位可达静态箱34 cm处。采样时间为2016年6—11月,其中7、8月份采集时间为月初和月中,其他月份每月采集1次。每个湿地类型设置3个重复观测点。
1.2.2 土壤样品采集与测量
采集气体样品的同时,在每个采样点,用土钻采集0—10 cm深度的土壤,3个重复。分别混合均匀后带回实验室,挑出明显的根系后自然风干,研磨,过100目筛。分别用高温外热重铬酸钾氧化-容量法和开氏法测定土壤中有机碳(soil organic carbon,SOC)和全氮(total nitrogen,TN)含量[13](表1)。

表1 供试土壤有机碳、氮含量及地上生物量
SOC:soil organic carbon;TN:total nitrogen; 均值±标准差
1.2.3 环境因子和地上生物量测定
采集气体样品时,同步观测环境因子的变化。本研究主要观测的环境因子包括土壤温度、pH、电导率值(EC)、氧化还原电位(Eh)和地上生物量,分别采用水银温度计、电导率仪(DDBJ- 350)和酸度计(PHBJ- 260)进行测量;采用收割法测定植物地上生物量。
1.2.4 气体样品分析与通量计算
气体样品中CH4浓度用配有FID(氢火焰离子化检测器)的气相色谱仪(安捷伦7890B)分析测定。载气为氮气,流速25 mL/min;燃气为氢气,流速40 mL/min;助燃气为空气,流速400 mL/min,检测器温度为250℃,柱箱温度55℃,辅助加热器温度375℃。用国家标准物质中心生产的CH4标准气体,浓度为1.99 μL/L。利用下列公式计算气体排放通量:
(1)
式中,J为气体排放速率(mg m-2h-1),dc/dt为采样时气体浓度随时间变化的直线斜率,M为被测气体的摩尔质量,P为采样点气压(Pa),T为采样时绝对温度(K),V0,P0,T0分别为标准状态下的气体摩尔体积、空气气压(Pa)和绝对温度(K),H为水面以上采样箱高度(m)。
1.2.5 数据处理与分析
利用SPSS 18.0软件进行方差分析和Pearson相关性分析,Origin 8.5软件进行制图。
2 结果与分析
2.1 不同湿地类型CH4排放特征
3种类型湿地CH4排放呈现出不同的变化特征(图1)。芦苇湿地CH4排放随时间变化呈单峰型排放特征:自6月初至8月初,CH4排放通量开始上升,7月初上升速率加快,于8月初出现排放峰值(10.40±3.82) mg m-2h-1。此后,CH4排放呈下降趋势,至观测结束(11月初),CH4排放通量值为(0.575±0.095) mg m-2h-1。
翅碱蓬湿地CH4排放特征与芦苇湿地不同(图1):6月初,涨潮前CH4排放通量逐渐升高,并于7月中旬出现排放峰值(0.509±0.106) mg m-2h-1,8月初快速下降至(0.132±0.004) mg m-2h-1,之后,呈现波动下降趋势;涨潮期间,CH4排放变化特征与涨潮前基本一致,但排放峰值出现在7月初,相应值为(0.353±0.052) mg m-2h-1。
裸滩湿地CH4排放特征与翅碱蓬湿地近似(图1):涨潮前和涨潮中的CH4排放通量均在7月中旬达到峰值,其值分别为(0.593±0.013) mg m-2h-1(涨潮前)和(0.335±0.103) mg m-2h-1(涨潮中),至11月初,CH4排放通量分别下降至(0.040±0.001) mg m-2h-1(涨潮前)和(0.018±0.0002) mg m-2h-1(涨潮中)。

图1 3种类型湿地CH4排放通量Fig.1 CH4 flux in different types of wetlandBar线表示3个重复之间的标准误差
整个观测期内,芦苇湿地的CH4排放通量均值为(3.699±3.679) mg m-2h-1,明显高于其他两类湿地(表2)。涨潮前,翅碱蓬湿地和裸滩湿地CH4排放通量均值分别为(0.165±0.156) mg m-2h-1和(0.198±0.191) mg m-2h-1,呈现裸滩湿地>翅碱蓬湿地,两类湿地CH4排放通量无显著差异(P>0.05)(表2);涨潮过程中,翅碱蓬湿地和裸滩湿地的相应值分别为(0.119±0.132) mg m-2h-1和(0.131±0.103) mg m-2h-1,也表现为裸滩湿地>翅碱蓬湿地。根据单因素方差分析结果,3类湿地CH4排放通量具有显著差异(P<0.05),芦苇湿地>裸滩湿地(涨潮前)>翅碱蓬湿地(涨潮前),芦苇湿地>裸滩湿地(涨潮中)>翅碱蓬湿地(涨潮中)。比较分析涨潮前后CH4排放通量均值,潮汐明显降低了翅碱蓬湿地和裸滩湿地的CH4排放速率(P<0.05)。

表2 观测期内CH4排放通量均值
均值±标准差,同行和同列之间,不同字母表示差异显著(P<0.05)
2.2 环境因子变化特征及其对CH4排放的影响
由于芦苇湿地无明显的潮汐过程,故将涨潮前的翅碱蓬和裸滩湿地CH4排放与之对比分析环境因子的影响。3类湿地土壤温度8月中旬之前在25.0—28.5℃之间变动,之后,开始快速下降,至11月初观测结束温度降为7.0—9.0℃(图2)。翅碱蓬湿地和裸滩湿地电导率(EC)值变化范围(均值)为21.0—31.4(25.0±4.17) mS/cm与22.1—31.3(25.2±3.61) mS/cm,二者变化趋势大致相同(图2),且高于芦苇湿地相应值2.50—8.09(5.24±1.88) mS/cm;单因素方差分析表明,芦苇湿地电导率(EC)值明显区别于翅碱蓬和裸滩湿地(P<0.01)。观测期内,3种湿地土壤水pH变化也呈波动特征,同时具有下降趋势,相应的变化范围分别为6.77—8.14、6.94—7.90和6.82—8.54(图2)。3种类型湿地氧化还原电位(Eh)变化均呈波动特征,变化范围依次为-110—220、54—233 mV 和-38—70 mV(图2)。除EC外,3种类型湿地间土壤温度、pH和氧化还原电位(Eh)差异均不明显(P>0.05)。

图2 观测期内环境因子变化Fig.2 Variations of environmental factors during the observation period
Pearson相关分析表明(表3),不同湿地类型间,CH4排放通量与EC呈极显著负相关(r=-0.665,P<0.01),与土壤温度、pH和Eh相关性不显著(P>0.05)。翅碱蓬湿地涨潮前CH4排放通量与pH相关性极其显著(r=0.852,P<0.01),与土壤温度、EC和Eh无相关性(P>0.05);芦苇湿地和裸滩湿地涨潮前CH4排放则与土壤温度、EC、pH和Eh相关性均不显著(P>0.05)。以上结果表明,盐分是影响不同湿地类型间CH4排放的重要环境因子,同时,pH对翅碱蓬湿地涨潮前CH4排放通量有一定的影响。
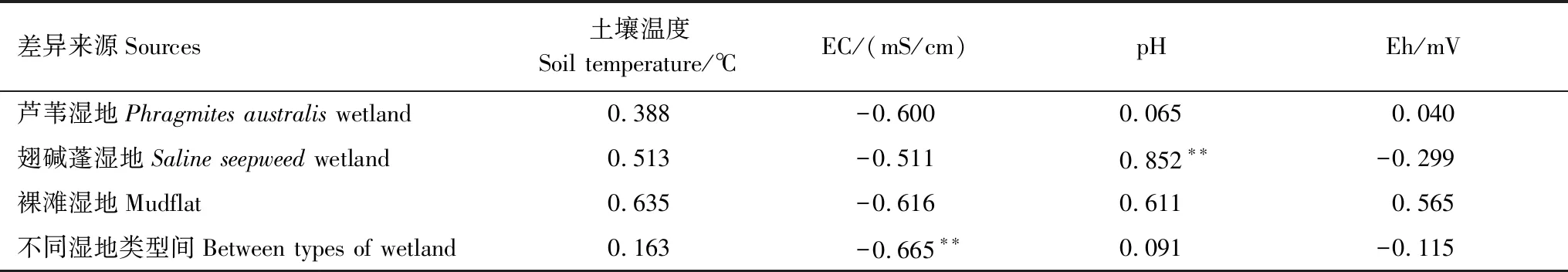
表3 CH4排放通量与环境因子间的Pearson相关系数
*表示在α=0.05水平上显著相关; **在α=0.01水平上极显著相关;EC:电导率,electric conductivity;Eh:氧化还原电位
3 讨论
3.1 不同类型湿地CH4排放特征
不同类型湿地甲烷排放速率差异显著,表现为芦苇湿地>裸滩湿地(涨潮前)>翅碱蓬湿地(涨潮前),芦苇湿地>裸滩湿地(涨潮中)>翅碱蓬湿地(涨潮中)这与湿地土壤有机质(SOC)和上覆植被有重要关系。有研究表明SOC含量是造成不同湿地CH4生成潜力差异的主要原[14];吴家梅等[15]进一步揭示了甲烷排放的主要底物为易氧化有机碳组分。本研究结果显示,芦苇湿地的土壤有机质含量为(24.02±0.79) g/kg,远高于翅碱蓬湿地和裸滩湿地(表1),而且芦苇湿地地上生物量高达(2033.3±256.5) g/m2,这可以增加土壤有机质的输入,为CH4产生提供底物来源,从而影响CH4排放[16]。同时,植物通气组织可以将地下CH4有效运输至大气。长江口的研究中发现,芦苇生长季对CH4排放的促进量达1.99 mg m-2h-1[17],芦苇的存在增加了大约41.5%—69%的CH4释放,割除芦苇导致长期淹没样点CH4释放显著减少[18]。
然而,裸滩地表无植被覆盖,其CH4排放通量高于翅碱蓬湿地,这可能与裸滩湿地相对于翅碱蓬湿地土壤含水量更高有关。黄河三角洲的研究也发现,近海的潮滩湿地CH4排放高于靠陆的潮滩湿地,且光滩的CH4排放通量与土壤含水量呈正相关[19- 20]。Hirota等[21]认为土壤水分的多少直接影响O2可利用率、气体扩散速率和微生物活性等,水分增加促进厌氧环境的形成。根据实测结果(图2),同一采样时段内,裸滩湿地的氧化还原电位(Eh)均低于翅碱蓬湿地,这说明裸滩湿地的厌氧条件更好,更有利于CH4生成。此外,不同植物群落地下根系深度的不同也会造成CH4排放的差异,当优势种根系分布较浅时,由根系输送的O2会使土壤的氧化性更强,导致生成的CH4被氧化[22]。较高的CH4生成和较低的CH4氧化,最终导致裸滩湿地的CH4排放通量略高于翅碱蓬湿地。
3.2 水位与CH4排放
潮汐作为滨海湿地独有的自然现象,对湿地土壤最直观的影响是水位变化。涨潮过程中,淹水条件通过改变土壤孔隙中O2的分布和浓度可影响CH4的生成和氧化[8],平衡后的CH4或从土壤或通过近地面植物体茎部先排放到CH4浓度较低的潮水中,之后,进入潮水中的CH4一部分被潮水氧化,一部分溶解在潮水中,然后逐渐间接扩散到大气环境[16]。目前,CH4排放通量与高潮水位之间的关系没有统一的定论。闽江口的研究显示,2007年CH4排放通量与高潮水位显著正相关,2008年无显著相关性,2009年涨落潮过程中CH4排放通量平均每月比涨潮前下降59.25%,但其与最高潮水位的正负相关性存在月份差异[23]。Van der Nat 等[24]认为,当潮水水位低于8 cm的时候,CH4排放通量增长明显,而超过地表一定高度后,CH4排放量将会锐减。仝川等[16]研究则表明,芦苇湿地平均排放到潮水中的CH4显著高于排放到大气中的CH4通量,为其1.43倍。
本研究采样所得气体通量均为湿地土壤CH4生成后最终进入大气的部分,采样期间潮汐水位变化范围为10—34 cm,翅碱蓬湿地植株在6—8月份生长至最高值20—22 cm,较高的水位使得部分植株被淹没;裸滩湿地没有植被覆盖,土壤产生的CH4在淹水状态下直接进入潮水,然后通过扩散的形式排放到大气。综上,两种类型湿地在涨潮过程中,进入潮水中的CH4比例增大,导致最终排放到大气中的CH4较涨潮前有所下降。Yang等[25]在淡水湿地的研究表明,淹水2—14 cm促进了CH4排放,这可能是由于水位“脉冲”变化对CH4排放的影响与长期淹水对其影响存在差异。辽河口湿地属于周期性潮汐地区,每日周期性的涨落潮使其土壤状况与季节性淹水地区相比更具特殊性,因此CH4排放对其响应也不同。
3.3 盐分与CH4排放
同时,较高的离子强度会引起微生物细胞的渗透势变化,表现为低盐刺激微生物活性,高盐则形成离子胁迫,干扰微生物的生长繁殖[32],甚至引起群落结构变化[33]。模拟海水入侵过程中,盐度低于5的海水添加无显著影响,盐度大于5的海水添加,对土壤CH4产生潜力表现出显著的抑制作用[14]。余晨兴和曾志华等[4- 35]在闽江口的研究也表明,产甲烷菌群落组成及丰度差异与盐度有极显著相关关系,且相比其他环境因子,盐度对其影响更大。
3.4 pH与CH4排放
以往研究表明,产甲烷菌可以忍受的土壤pH范围为5.50—9.00,最适宜的范围为6.80—7.20,该范围内CH4生成率随着pH的升高明显增加[14];超出最适范围,CH4排放较低[36]。根据原位监测,翅碱蓬湿地的pH在6.94—7.90之间变化,基本上能够保证产甲烷菌活性处于最佳水平,相关性分析也表明,该区域CH4排放与pH呈显著的正相关。而芦苇湿地和裸滩湿地的pH变化范围分别为6.77—8.14和6.82—8.54,更宽幅度的pH变化可能是导致其与CH4排放的相关性不显著的原因之一。王纯等在感潮区淡水沼泽湿地的研究中也有类似结果[14]。
3.5 温度、氧化还原电位与CH4排放
温度在CH4的生成、氧化和排放过程中有重要作用,是CH4季节排放动态的重要影响因素[16]。一般而言,湿地CH4排放表现为夏秋高冬春低[24,27- 28]。Kankaala等研究发现,土壤温度可解释芦苇湿地50.3%—60.7%的CH4排放[37]。另有研究表明,生长季内CH4排放通量几乎与整个0—90 cm土层的温度都具有显著正相关关系,相关性系数最高可达0.91[38]。研究认为,土壤温度主要是通过影响微生物活性[39]和改变产甲烷菌群落组成[40]来改变土壤CH4的产生和排放。本研究中不同类型湿地CH4排放通量均在7、8月份最大,且与温度具有一定的正相关性(表3),但温度对CH4排放的影响不显著,这与其他类型湿地的研究结果不同。
氧化还原电位(Eh)在一定程度上可反映土壤的厌氧状况。以往的研究表明,CH4生成过程需要保证严格的厌氧条件,然而,本研究过程中发现,在Eh>0 mV的情况下,3类湿地中均能观测到CH4排放。这说明,非厌氧条件下可能仍有部分CH4生成。关于Eh对CH4排放的影响,不同学者得出结论存在一定差异。室内控制试验结果显示,CH4生成所需Eh阈值存在很大的不确定性,其值变化在-300—70 mV[20,22];有学者认为,厌氧条件建立起来以后,就有CH4生成;Peters等也发现,原位条件下产甲烷菌在有氧环境中生存良好,其数量相比厌氧条件下仅低10倍左右[43]。此外,本研究实测所得Eh测量深度为地下5 cm,测量深度以下土壤生成的CH4及前期淹水状态下生成的CH4完全排放进入大气均需要一定的时间。
4 结论
(1)辽河口3类典型自然湿地CH4排放通量具有明显的季节特征,随时间变化呈先上升后下降趋势,并于7—8月份出现排放峰值。不同类型湿地间CH4排放通量差异显著,表现为芦苇湿地>裸滩湿地(涨潮前)>翅碱蓬湿地(涨潮前),芦苇湿地>裸滩湿地(涨潮中)>翅碱蓬湿地(涨潮中)。
(2)潮汐带来的水盐变化对3类湿地土壤CH4排放有显著影响。涨潮过程明显降低了翅碱蓬湿地和裸滩湿地的CH4排放通量;不同湿地类型间CH4排放通量与EC呈极显著负相关,表明盐分对CH4排放过程具有一定的抑制作用。而关于CH4排放与pH的相关性有待进一步研究。

