华北石质山地侧柏人工林C、N、P生态化学计量特征的季节变化
封焕英,杜满义,辛学兵,高 旭,张连金,孔庆云,法 蕾,吴 迪
中国林业科学研究院华北林业实验中心,北京 102300
碳(C)、氮(N)、磷(P)是植物的基本营养元素,参与细胞的结构与功能,与植物体生长和各种代谢过程存在密切联系[1-2]。生态化学计量学通过分析生物系统多重化学元素和能量的交互作用,为探索C、N、P等元素的生态学过程和生物地球化学循环提供了一种新思路、新手段[3]。陆地植物生态化学计量学的研究起步较晚,但近年来取得了较大的进展[4],在开展不同时空尺度下森林[5]、草地[6]、荒漠[7]和湿地[8]的生态化学计量学研究中发现,植物各器官因养分储存及功能性分化的差异性[9],可能导致同一植物不同器官间[10-11]及不同物候期下的化学计量特征存在差异[12-13]。
侧柏(Platycladusorientalis)为多年生常绿乔木,具有耐干旱瘠薄,适应性强且寿命长的特性,是华北石质山区主要造林树种之一,广泛存在于我国北方地区,同时也是北京地区中低山的地带性植被类型。目前,关于侧柏人工林的研究多集中于其生物量及碳储量[14-15]、水分利用策略与抗旱机理[16]、密度效应[17]、枯落物水文效应[18-19]、养分元素分配及循环特征[20],其生态化学计量学相关研究较少。尽管白雪娟等[21]和张海鑫等[22]对黄土高原地区侧柏的“叶片-凋落物土壤”进行了生态化学计量特征和重吸收率的研究,但实验仅是通过单次采集植物体光合器官完成的,研究亟待拓展至其他器官和整个生长季,且目前关于侧柏不同器官养分元素间的相互作用和分配差异尚不明晰。华北石质山地是华北平原的重要生态屏障,属于半干旱区域,然而该地区土层瘠薄、土壤储水能力差、岩石渗漏性强,水土流失严重;且早期山地植被破坏严重,土壤退化显著[23]。侧柏是该区域典型造林树种之一,对维持石质山区脆弱生态环境起到重要作用。因此,本文以华北石质山地幼龄侧柏林人工林为研究对象,系统研究不同器官(叶、枝、根(0—10 cm、10—20 cm))在整个生长季节C、N、P生态化学计量学特征:1)明晰侧柏人工林各器官生态化学计量特征的异同;2)揭示侧柏人工林各器官化学计量特征在生长季节的变化规律及变异性;3)通过各器官化学计量同步、系统的研究,试图找出不同器官间化学计量的关联性。研究旨在解析生长季节内侧柏人工林各器官生态化学计量特征,丰富我国植物种群化学计量学内容,为我国生态化学计量学的区域性研究与生物地球化学循环的模型整合提供基础数据,同时也为指导幼龄侧柏人工林经营提供理论支持。
1 研究方法
1.1 研究区概况
研究区位于北京市门头沟区九龙山自然保护区(39°54′—39°59′N,115°59′—116°07′E),太行山低山丘陵区,海拔100—997 m;属于暖温带大陆半湿润季风气候,年均气温11.8℃,年均降水量623 mm,主要集中在6—9月;年均蒸发量l 870 mm,无霜期216 d左右;土壤类型属于山地褐土,土层普遍较薄,石砾含量高。九龙山有着华北石质山区典型的地形地貌、土壤和气候条件及区域代表性地带植被类型,九龙山进行封山育林始于20世纪60年代,并且营造了大面积的人工林,构成了以人工森林和灌丛为主的植被类型。目前天然植被以次生灌丛和灌草为主,包括荆条(Vitexnegundovar.heterophylla)、三裂绣线菊(Spiraeatrilobata)、酸枣(Ziziphusjujubavar.spinosa)等灌木和狗尾草(Spiraeaviridis)、黄背草(Themedajaponica)、茜草(Rubiacordifolia)、荩草(Arthraxonhispidus)等草本;乔木以人工林为主,主要包括侧柏、油松(Pinustabulaeformis)、栓皮栎(Quercusvariabilis)、华北落叶松(Larixprincipis-rupprechtii)、樟子松(Pinussylvestrisvar.mongolica)、白蜡(Fraxinuschinensis)、紫丁香(SyringaoblataLindl)等树种[24]。
1.2 样地选择与采样分析
2016年4月,在北京九龙山自然保护区共设置3个林龄35 a,面积20 m×20 m的干扰程度较小、立地条件一致、具有代表性的幼龄侧柏人工林样地,每个样地间设置大于5 m宽的缓冲带,3个样地共计3次重复。样地内侧柏平均胸径6.59 cm,平均树高7.30 m,密度3000株/hm2,郁闭度0.70,土壤表层(0—10 cm)C、N、P含量分别为32.31、2.05、0.65 g/kg,土壤(0—30 cm)中大于2 mm的石砾含量约为40%。依据侧柏各项生长指标的平均值,在样地内确定5株中等大小、长势及冠幅较一致的健康标准木,在2016年4月至2016年12月,每2个月的中旬利用高枝剪或爬树收集植物叶、枝样品,植物样品分别从树冠的上、中、下3个层次的4个方向进行采集,每株植株采集12个健康标准枝,每个样地内共计获得60个健康标准枝,收集其上的所有针叶和枝,分别混合后作为1个重复样品。使用根钻进行植物根系的采集,每个月中旬用根钻(φ=10 cm)分别在所确定的各标准木根际约50 cm处钻取0—10、10—20 cm样木根(粗根与细根的混合样品),每个样地5次重复,同一样地内相同层次混合后作为1个重复样品。因此,在4—12月生长季节内,分别获得侧柏叶、枝和根系样品各15份,共计45份植物样品。
将采集的新鲜叶、枝和根系样品洗净装入信封,于烘箱中105℃下杀青0.5 h,然后在65℃恒温烘干48 h至恒重,烘干后的样品用粉碎机粉碎(<0.5 mm),装入棕色磨口瓶,用于测定叶片的全C、全N和全P含量,其中植物有机碳含量采用重铬酸钾-外加热法测定、全氮含量采用半微量凯氏定氮法测定、全磷含量采用碱溶-钼锑抗比色法测定[25]。
1.3 数据处理
数据统计分析在SPSS 16.0软件下完成,正态分布性检验采用K-S检验(one sample Kolmogorov-Smirnov test)方法。首先对植物叶、枝及根的C、N、P含量及其化学计量比数据进行以10为底的对数转换,使其符合正态分布,再求算其算术平均值。变异系数(cofficient of variation,CV)用公式CV=标准偏差/平均数×100%计算得出。不同器官,不同月份下数据变量的差异运用One-Way ANOVA分析,LSD进行方差分析。采用GLM模型中的双因素方差方法分析不同季节和不同器官对植物C、N、P含量及其化学计量比的影响。植物各器官间不同化学计量参数相关性分析采用Peason相关分析。
2 结果与分析
2.1 侧柏各器官C、N、P含量及其化学计量比
侧柏不同器官间(叶、枝、根)C、N、P含量(图1)及其化学计量比存在显著性差异(图2)。其中,叶、枝、根(0—10 cm)、根(10—20 cm)C含量平均值分别为(446.68±9.46) g/kg、(461.58±8.00) g/kg、(414.97±25.83) g/kg、(417.89±27.97) g/kg,相同生长季节下各器官间C含量差异显著,均表现为枝最大,叶次之,根最小;N含量平均值分别为(14.28±1.68) g/kg、(6.57±0.63) g/kg、(9.26±1.13) g/kg、(8.05±1.26) g/kg,相同生长季节下各器官间N含量差异显著,均表现为叶>根(0—10 cm)>根(10—20 cm)>枝; P含量平均值分别为(1.28±0.31) g/kg、(0.72±0.11) g/kg、(0.40±0.08) g/kg、(0.39±0.06) g/kg,相同生长季节下各器官间P含量差异显著,均表现为叶最大,枝次之,根最小。C∶N平均值分别为31.76±4.39、70.98±7.91、45.50±6.46、53.19±9.61,相同生长季节下各器官间C∶N差异显著,均表现为叶>根(10—20 cm)>根(0—10 cm)>叶;C∶P平均值分别为369.93±97.05、653.78±98.75、1087.80±301.81、1099.20±213.58,相同生长季节下各器官间C∶P差异显著,均表现为根最大,枝次之,叶最低;N∶P平均值分别为11.50±1.64、9.21±0.96、23.81±4.81、20.99±4.01,相同生长季节下各器官间N∶P差异显著,均表现为根最大,叶次之,枝最低。
2.2 侧柏各器官C、N、P含量及其化学计量比的动态变化
侧柏各器官的C、N、P含量(图1)及其化学计量比在生长季节均呈现出一定程度的动态变化(图2)。其中,叶C含量436.07—452.55 g/kg,N含量12.05—15.73 g/kg, P含量0.90—1.51 g/kg。枝C含量459.47—464.74 g/kg,N含量5.97—6.94 g/kg,P含量0.60—0.83 g/kg。根(0—10 cm)C含量392.18—435.02 g/kg, N含量8.76—10.04 g/kg,P含量0.32—0.47 g/kg。根系(10—20 cm)C含量397.67—443.87 g/kg,N含量7.85—8.25 g/kg,P含量0.37—0.42 g/kg。各器官中C元素最稳定(变异系数均小于7%),P元素变异性最大(变异系数均超过15%)。各器官C元素含量随生长季节变化均不显著;叶N元素含量随生长季节变化显著,表现出先上升,到达峰值后下降,最后趋于平稳的趋势,而其他器官生长季节内N元素无显著性变化;叶和枝P元素含量随生长季节变化显著,趋势与叶片N元素相似。
叶C∶N比值范围27.77—37.41,C∶P为302.32—503.60,N∶P为10.21—13.49,变异系数分别为14%、26%、14%;枝C∶N比值范围66.56—77.17,C∶P为563.19—771.26,N∶P为8.26—10.01,变异系数分别为11%、15%、10%;根(0—10 cm)C∶N比值范围39.24—48.67,C∶P为867.21—1421.10,N∶P为21.09—30.27,变异系数分别为14%、28%、20%;根(10—20 cm)C∶N比值范围50.86—55.99,C∶P为957.03—1228.91,N∶P为18.72—21.85,变异系数分别为18%、19%、19%。同一器官化学计量比在不同生长季节间均无显著性差异,各器官中C∶N和N∶P较C∶P更为稳定。
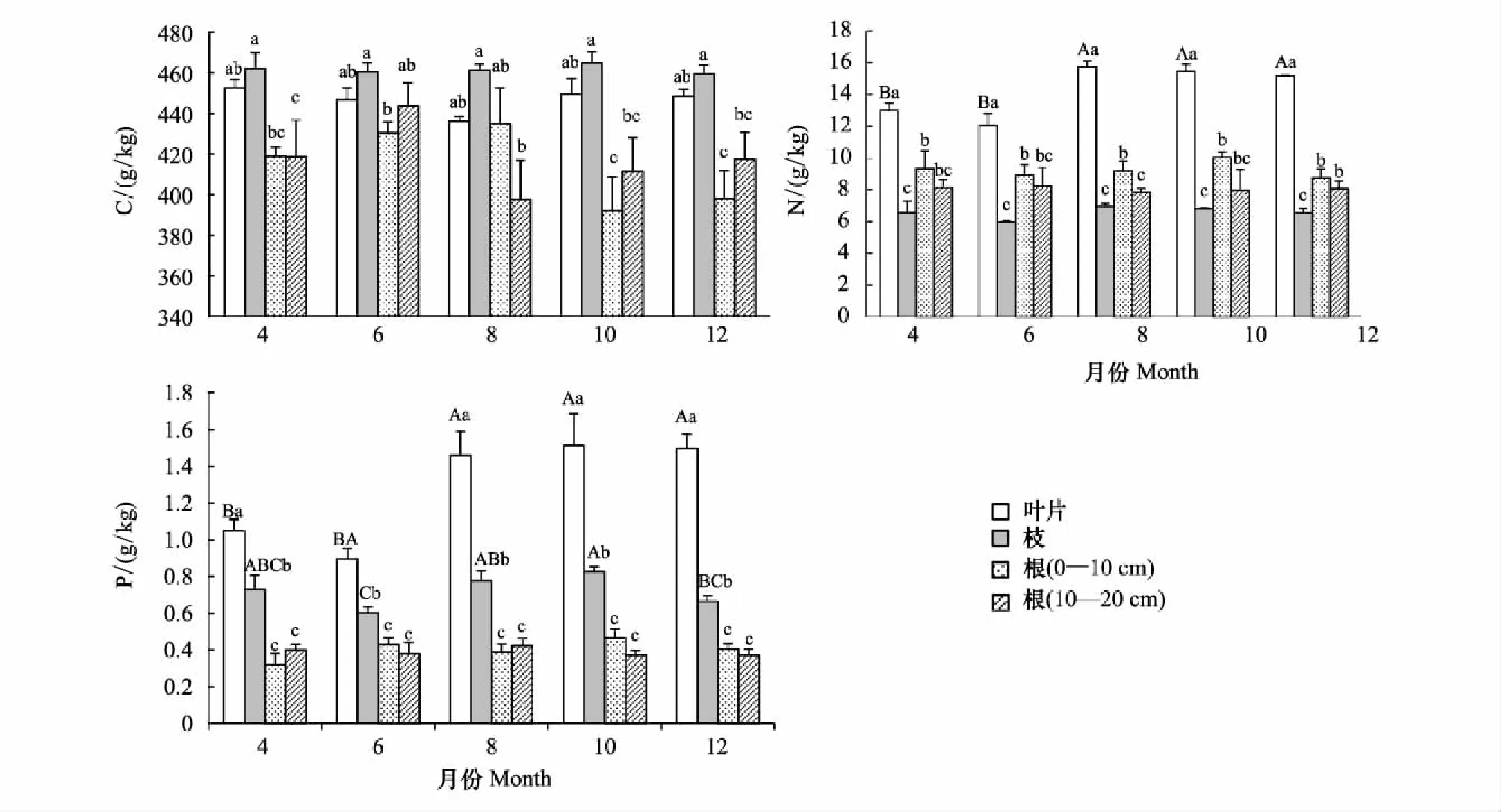
图1 侧柏各器官C、N、P含量及其动态变化(平均值±标准偏差)Fig.1 Seasonal dynamics of C, N, P concentration in different organs of Platycladus orientalis (mean±SD)不同小写字母表示各器官间差异,不同大写字母表示各生长季节间差异(P<0.05)
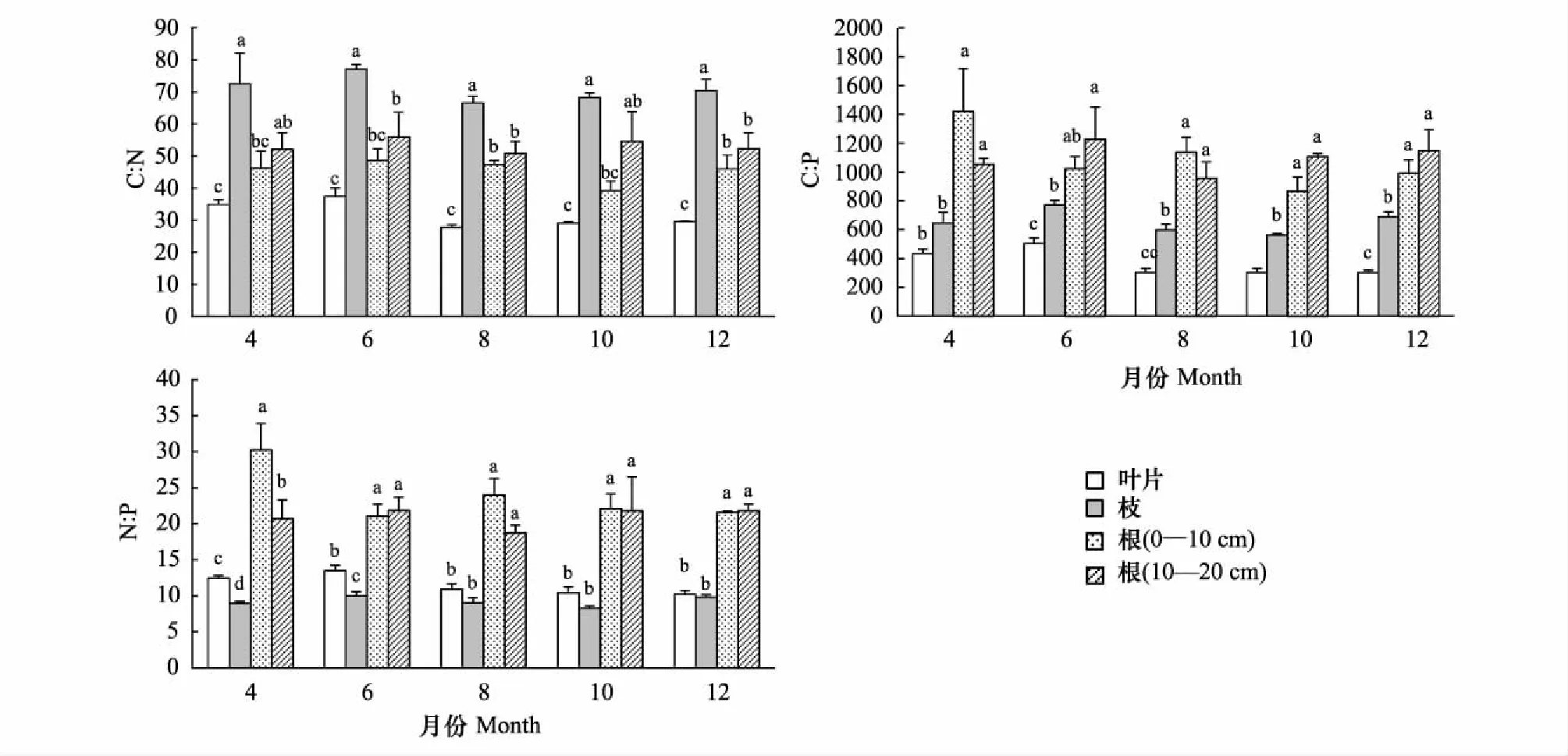
图2 侧柏各器官C∶N、C∶P、N∶P含量及其动态变化(平均值±标准偏差)Fig.2 Seasonal dynamics of C∶N, C∶P, N∶P ratio in different organs of Platycladus orientalis (mean±SD)
2.3 C、N、P含量及其比值间相关性
通过SPSS 16.0 统计分析软件对侧柏植株总体C、N、P含量及其化学计量比值进行Person相关分析,结果表明(表1):C、N含量与P含量总体上均呈现极显著正相关(P<0.01),相关系数分别是0.402和0.762,而C、N之间相关系数不明显(P>0.05),这在一定程度上反映出N、P在植物体内存在较高的耦合度。C∶N与P呈现极显著负相关(P<0.01),这主要是因为N作为C∶N的分母,N越大,C∶N越小,而N和P又正相关,所以C∶N与P呈现显著正相关;C∶P与N呈现极显著负相关(P<0.01),与C∶N呈现显著正相关(P<0.05)。作为C∶P的分子,C与C∶P理论上应为极显著正相关,然而结果表明C∶P与C为极显著负相关,这说明在侧柏中的C∶P变化主要由P来决定;N∶P与C和P均呈现显著负相关(P<0.01),与N不存在显著相关性(P>0.05),这说明在侧柏中N∶P的变化主要由P变化决定。

表1 C、N、P含量及其化学计量比之间的相关系数
*,相关系数显著水平为5% (P<0.05);**,相关系数显著水平为1% (P<0.01)
2.4 侧柏各器官间C、N、P含量及化学计量比相关性
侧柏各器官C、N、P含量相关性多数未达到显著性水平(表2),仅有叶与枝P元素含量显著相关;器官间化学计量比的相关性多数也未达到显著性水平,仅有叶与枝C∶P比值显著相关。

表2 侧柏各器官间碳(C)、氮(N)、磷(P)含量及化学计量比的相关关系
2.5 侧柏C、N、P含量及其化学计量比的整体变异分析
通过生长季节和不同器官对侧柏C、N、P含量及其化学计量关系影响的一般线性模型分析(GLM)发现:不同器官对C、N、P含量及其化学计量关系的影响均达到极显著水平(P<0.05);生长季节对侧柏N含量存在显著影响(P<0.05),对P含量存在极显著影响(P<0.01),而对其他化学计量指标影响不显著;不同器官与生长季节间的交互作用只对P含量存在极显著影响(P<0.01)。相对于生长季节以及生长季节和不同器官交互作用而言,器官对侧柏各化学计量的影响更为显著(表3)。
表3季节与器官对侧柏C、N、P含量及其计量比影响的一般线性模型(GLM)分析
Table3Generallinearmodel(GLM)analysisofeffectsofseasonsandorgansonC,NandPconcentrationsandtheirratiosofPlatycladusorientalis
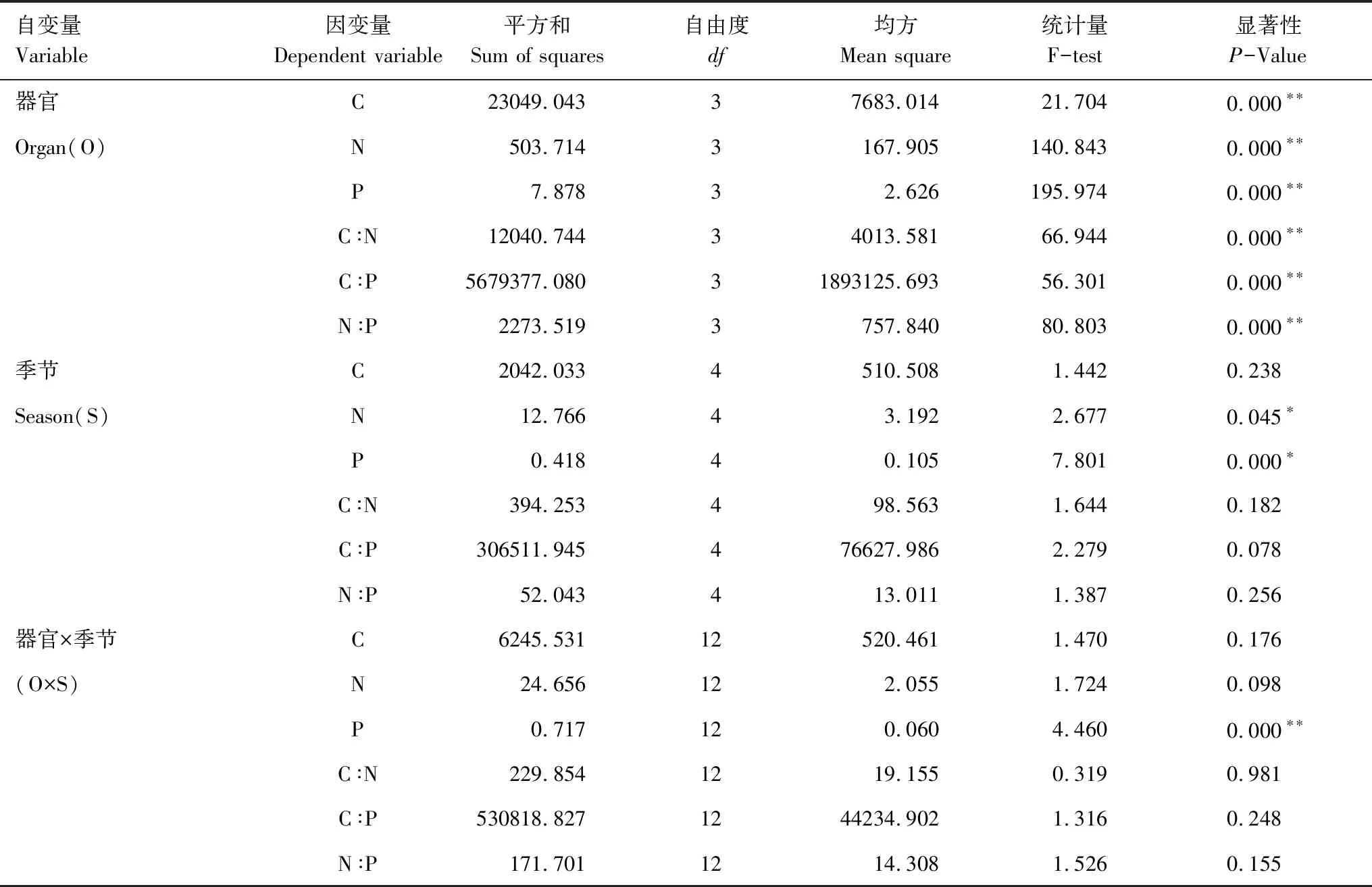
自变量Variable因变量Dependent variable 平方和Sum of squares自由度df均方Mean square统计量F-test显著性P-Value器官C23049.04337683.01421.7040.000∗∗Organ(O)N503.7143167.905140.8430.000∗∗P7.87832.626195.9740.000∗∗C∶N12040.74434013.58166.9440.000∗∗C∶P5679377.08031893125.69356.3010.000∗∗N∶P2273.5193757.84080.8030.000∗∗季节C2042.0334510.5081.4420.238Season(S)N12.76643.1922.6770.045∗P0.41840.1057.8010.000∗C∶N394.253498.5631.6440.182C∶P306511.945476627.9862.2790.078N∶P52.043413.0111.3870.256器官×季节C6245.53112520.4611.4700.176(O×S)N24.656122.0551.7240.098P0.717120.0604.4600.000∗∗C∶N229.8541219.1550.3190.981C∶P530818.8271244234.9021.3160.248N∶P171.7011214.3081.5260.155
*,P<0.05;**,P<0.01
3 讨论
3.1 侧柏各器官化学计量及其整体变异分解
目前森林生态系统化学计量学的研究内容基本上是以植物叶片为研究对象[26]。与已有研究成果对比发现(表4)。
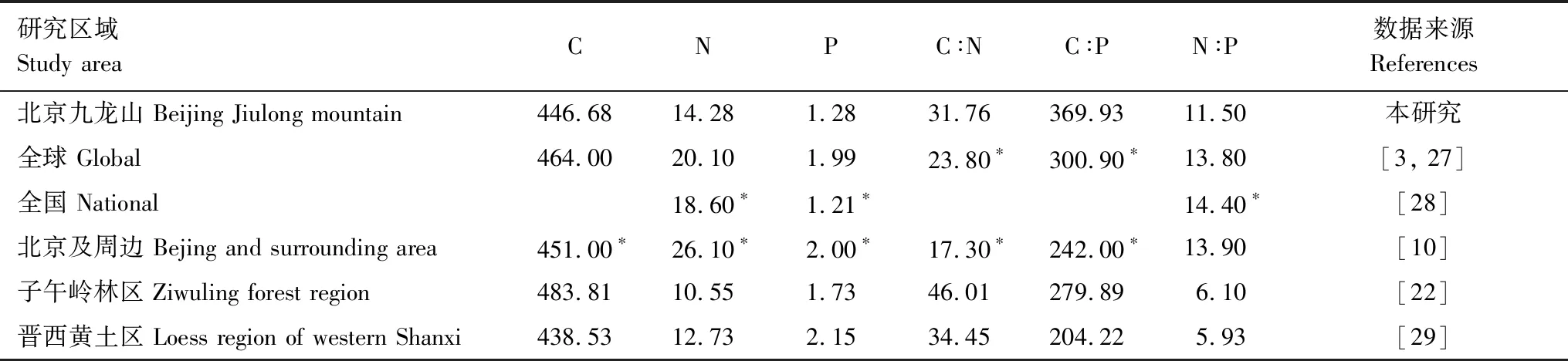
表4 侧柏叶片C、N、P含量及其化学计量比与其他已有研究结果的对比
*, 几何平均值
本研究中侧柏叶片C含量为446.68±9.46 g/kg,落在国际上公认的植物平均C含量45%—50%区间内[30],与晋西黄土区侧柏叶片C含量相近,而略低于子午岭林区侧柏叶片C含量。侧柏叶片N含量为14.28±1.68 g/kg,低于全球、全国及北京周边范围内叶片N含量,而高于两个黄土区域侧柏叶片N含量。这一方面因为不同生活型叶片养分含量具有明显差异,与落叶树种和阔叶树种相比,常绿树种和针叶树种往往具有较低的N、P含量[31-32],侧柏属于常绿针叶树种,叶片N含量相对其他树种偏低;另一方面,在研究对象均为侧柏的情况下,对比发现侧柏叶片N含量在三地年均降雨量基本相近的情况下随研究区域年均气温增大而增大,即本研究年均气温(11.8℃)大于晋西黄土区(10.0℃)和黄土高原子午岭林区(7.4℃)。“温度-植物生理假说”(TPPH)认为,植物在低温下会提升自身元素含量来补偿低温的光合速率[27],显然本研究并不符合此假设,这是因为植物体摄取的营养元素来源于土壤,其体内N和P元素含量与土壤的N和P可给性有关[33]。本研究中侧柏叶片P含量为1.28±0.31 g/kg,与全国陆地植被P平均含量(1.21 g/kg)相近,而低于全球植被P平均值,这是因为与世界其他地区相比,我国陆地生态系统缺磷的现象更为明显[34]。与黄土高原两个地区的侧柏相比,本研究中侧柏叶片P含量偏低,这可能是因为叶片P含量会随着平均气温的降低极显著的增加,也会随着经度增大而表现出降低的趋势[30,35]。本研究中侧柏叶片C∶N和C∶P均表现出与N和P含量相反的趋势,这是因为植被间C含量差异性不大,而C∶N和C∶P的相对大小更取决于N和P含量的高低。本研究区及黄土高原区域的侧柏叶片N∶P均小于全球、全国及北京周边地区植物叶片N∶P平均值,这说明与其他植被相比侧柏更大程度上受到N元素的限制;与黄土高原区域相比本研究中侧柏叶片N∶P比值较高,说明本区域内叶片中N元素相对充足,这可能与土壤中N、P的含量密切相关。
由于本研究所采集样品均在同一小地点,取样地点环境的空间异质性可以忽略不计,这进一步突出了器官和生长季节对植物自身化学计量的影响。对不同器官和生长季节的侧柏C、N、P含量及其化学计量比影响的一般线性模型分析显示(表3),侧柏化学计量不仅与器官类型有关,在不同生长季节也表现出较大的差异性。其中,C、C∶N、C∶P和N∶P的变异主要受不同器官的影响;N的变异主要受不同器官和生长阶段的影响;P的变异受不同器官、生长阶段以及两者的交互作用的影响;总体而言,侧柏C、N、P含量及其化学计量比主要受到不同器官的影响,器官对C、N、P含量及其化学计量比均达到了极显著水平(P<0.01),这进一步说明侧柏器官分化过程中各器官对元素的吸收利用具有特异性。侧柏N、P元素的变异同时受到生长季节的影响,除了植物自身生物学特性的原因,还与生长季节中温度、降雨等环境因子变化有关,夏季高温多雨,冬季低温干旱,影响了侧柏对N和P的吸收利用。本研究发现,侧柏作为多年生的常绿针叶树种,其化学计量特征在一定程度上受到了生长季节的影响,但相较之下侧柏枝条在整个生长季节中C∶N,C∶P和N∶P化学计量特征变异性均最小,且植物样品相对容易获取,可以作为侧柏不受生长季节影响的化学计量特征,以用于生态系统问题的分析。
3.2 侧柏器官间化学计量的差异与关联
本研究中侧柏不同器官(叶、枝、根)C、N、P含量及其化学计量比存在显著性差异,这种差异不仅受到植物基本生理过程需求的影响,还会受到器官间组织结构和功能分化的影响[9]。叶片是植物同化和代谢的主要器官,植物在生长阶段会将大量养分集中传送给叶片以满足植物的生长需求[36],而枝和根作为养分的吸收和输送通道,较少储存养分,因此叶片中N(14.28±1.68 g/kg)、P(1.28±0.31 g/kg)两种营养元素含量最高。枝作为支撑和疏导器官,主要由木质素、纤维素等富含C的多糖物质组成,这一结构性质决定其C浓度较高,因此在侧柏叶、枝、根中,枝的C含量(461.58±8.00 g/kg)最高,与已有研究结论一致[37-38]。C∶N和C∶P分别为枝和根最大,这主要是由于不同器官间C元素含量差异不大,影响C∶N、C∶P值的主要因素是N、P的含量[27],而枝中N元素和根中P元素含量均明显小于其他器官;叶和枝的N∶P比值均小于14,根(0—10 cm)和根(10—20 cm)N∶P比值均大于18,即相同发育阶段不同器官的C∶N、C∶P和N∶P化学计量特征不同,这与器官的选择性吸收和养分元素分配格局密切相关。赵一娉等[39]在黄土高陵沟壑区的研究发现森林生态系统乔木层平均C、N、P含量显著低于叶片水平,叶片不能全面代表乔木层整体养分含量情况,这是由于叶片与其他器官(枝、干、根)化学计量参数不同而引起的,与本文研究结果一致。N∶P是衡量生物体营养状况和判断植物群落受养分限制情况的重要指标,根据当N∶P>16表示P限制,N∶P<14表示N限制的判断标准[40],说明华北石质山区侧柏在生长季节里更多受到N元素的限制。目前对植物体限制性元素的判断多采用叶片为研究对象,这是因为叶片是植物的光合器官,也是最能反映植物生长状况的器官,但叶片并非唯一、最全面的判断标准,更多情况下需要拓展至其他器官便于综合性的判断,这在后期研究中需要有所突破。此外,N∶P临界值的阈值受到研究区域、生态系统以及植被类型等众多因素的影响[41],且一般在肥沃的土壤和某种具有较高养分含量的物种中使用N∶P比值进行养分限制性判断应当谨慎,相关养分限制诊断指标的敏感性和适应性因研究对象不同而存在差异[34],目前施肥实验是确定N或P存在限制作用及N∶P临界值的最佳办法[42]。
植物各器官由于养分储存及功能差异性导致同一植物不同器官间的C、N、P化学计量存在显著差异,但器官间的C、N、P浓度密切相关,且不同器官对养分的利用具有一定相关性[43]。以往更多基于大尺度的研究表明,植物不同器官间功能性具有一致性,即不同器官间N、P含量和N∶P一致相关,且这种相关不随物种、土壤等因子的变化而变化[44-45]。在种群和物种水平上,研究表明温带优势草本植物间N、P含量以及N∶P在各器官之间一致呈显著正相关[11]。本研究中叶与枝的P元素含量以及C∶P比值呈现显著正相关,其他器官间化学计量相关性不明显(表2)。这表明叶与枝之间的养分利用效率是最紧密联系的,这是因为实验所采集到的枝、叶位于同一枝干上,枝作为叶最相邻的养分输送通道,其汲取和吸收的养分是同步的[46]。周红艳等[2]研究发现单叶蔓荆各器官的化学计量相关性主要集中在地上部分,其中尤以枝条和匍匐茎之间表现明显。叶片和根作为植物地上和地下最重要的营养器官,在功能上联系紧密,颇受关注。Yuan等[47]发现陆地植物根与叶N∶P相似,但叶片N、P含量绝对值大于根系N、P含量绝对值。本研究中叶与根化学计量未达到显著性相关,一个可能是因为土壤与根系直接接触,植物通过根系从土壤中吸收和利用有效的N、P,土壤理化特性对根系生态化学计量特征产生重大影响[48],另一个可能的原因是尺度效应,在小尺度上植物生境条件相对一致,种内个体间功能性状因变异幅度较小而关联不明显[49]。
3.3 侧柏各器官化学计量的季节动态
本研究中侧柏各器官的C、N、P含量呈现出一定程度的动态变化,其中C在各器官的含量高且相对稳定(变异系数均小于7%),N、P含量较低且变异系数均较大。原因可能是C的转化主要通过植物光合作用,C是构成植物骨架的基本结构物质,且为植物新陈代谢、生长发育和繁殖等生理活动提供能源的物质,需求量大,所以在植物体内含量高且变异小[37]。叶片中N元素以及叶片和枝的P元素含量均随生长季节变化显著,表现出先上升,到达峰值后下降,最后趋于平稳的趋势。这是因为叶片作为主要的光合器官能够合成大量的蛋白质和核酸,在生长初期,植物叶片生长速度缓慢,细胞分裂能力一般,所需形成的蛋白质和核酸较少,因此对N、P的选择吸收较少;在生长旺季时期,需要大量的蛋白质和核酸来满足植物逐渐增长的生长速率,从而对N、P的选择性吸收较多;在生长末期,叶片生长基本停止,对叶片N、P营养元素的需求又略有降低并逐渐趋于平稳。对草本[50-51]和灌木[52]的相关研究认为,在植物生长最旺盛的时候对N、P元素的需求最大,但由于叶片生物量迅速增加,植物对营养的吸收赶不上细胞膨胀的速率,致使各器官元素被“稀释”,最终表现为N、P元素含量下降,与本文得出结论部分上不一致,这可能是因为相对于草本和灌木而言,针叶树侧柏属于慢生树种,生长周期长,叶片生长速率相对缓慢,即使在一年中的生长旺季,N和P元素也不会因细胞分裂的“稀释作用”而降低,这一现象在同为针叶树的落叶松研究中也得到了印证[12]。
本研究中侧柏各器官C∶N、C∶P及N∶P化学计量随生长季节变化均存在一定变异性,总体而言,C∶N和N∶P较C∶P更为稳定。一方面是因为C元素相对稳定,C∶N、C∶P的季节变异主要由N和P元素决定,而P元素的变异性大于N元素,所以C∶P变异大于C∶N的变异;各器官N∶P比值相对稳定,说明N和P在植物体具有相对一致性(r=0.762**),但N∶P的变化主要取决于P的变化,这是因为N∶P比值与N元素相关性不明显,而与P元素极显著负相关(r=-0.687**)。叶与枝的C∶N、C∶P比值在温度偏低的月份相对较高,这是因为温度能够影响植物叶片的N、P元素含量,低温降低了土壤微生物活性,从而降低土壤中有机物的分解和养分释放速度;此外低温还会阻碍养分元素的运输和植物对养分元素的更新[43,53]。根系(0—10 cm)C∶N、C∶P比值4月均较高,这是因为4月份温度相对较低,根系生理活动刚刚开始,对土壤中N、P等营养元素的吸收处于起步阶段,供应相对不足,因此导致低温环境下植物根系养分含量偏低而C∶N、C∶P较高的结果。研究还认为较高的C∶N和C∶P同时代表对N、P的利用率较高,以往研究也证实了植物在养分元素比较短缺的情况下,往往具有较高的养分利用效率和再吸收率,是对贫瘠环境状态的一种生存策略[54-55],本研究中侧柏在低温生长季节中更易发生养分元素限制和短缺的情况,因此,无论是地上部分的枝叶、还是地下部分的根系均可能通过提高N、P利用效率的方式来满足自身养分的需求[56]。器官生态化学计量学特征随季节更替而不断变化,研究认为一次性采样,阶段性的采样不能够将植物的生态化学计量学特征真实的反应出来,全面的、跨时空的采样将更加科学、合理[50,57],这一方面是由于植物自身的生物学特征造成;另一方面是由于植物不同生长阶段所处温度、降雨等环境因素不同,例如:雨水冲刷造成植物叶片N、P元素的流失,土壤水分影响土壤有效养分的释放与转移等[52]。
植物在漫长的进化过程中,为适应环境的变化形成了多样的生活史对策,当外界环境或者种内关系发生变化时,植物为了适应养分限制情况,从而调节不同器官中的养分含量变化及化学计量比值,其生存策略和方式也将发生相应变化。针对幼龄侧柏人工林C、N、P生态化学计量特征的季节变化规律,建议在幼龄侧柏经营管理过程中,理想条件下可以在N、P元素需求量达到峰值之前适当添加N肥和P肥,尤其是限制性元素N素的添加,以促进林分快速健康生长。本研究对侧柏不同器官的C、N、P生态化学计量生长季节变化进行了较为深入的探讨,但实际上“植物体-凋落物土壤”连续体构成了一个密不可分的系统,后期研究中需要在此基础上进一步分析凋落物和土壤的化学计量才能够更全面的揭示养分元素的传递与调控机理。此外,全球变化导致陆地植被元素平衡和计量指标发生重新匹配,有序开展侧柏生态化学计量对气候变化(氮沉降、干旱、温度升高等)的响应和适应机制以及持续的定点观测是今后的研究重点。

