云南省艾滋病患者分离新生隐球菌的药物敏感性检测与分析
樊红丽,高 丽,毛小琴,张 米,李正伦,杨翠先
(1. 云南省传染病专科医院/艾滋病关爱中心检验科,云南 昆明 650301; 2. 昆明理工大学医学院,云南 昆明 650500; 3. 云南省第一人民医院检验科,云南 昆明 650032)
截至2017年底,云南省累计报告存活人类免疫缺陷病毒(HIV)感染者和艾滋病患者98 878例,居全国前五。隐球菌性脑膜炎常感染免疫力低下人群,尤其是艾滋病患者,其抗真菌治疗效果差,是艾滋病患者死亡的主要原因之一[1]。在较长的抗真菌治疗过程中(平均周期为12个月),隐球菌对抗真菌药物会产生耐药,从而导致治疗失败[2]。因此,临床治疗需要实验室的体外药物敏感性报告作为依据。不同地区药敏折点是有差异的[3],目前,云南地区新生隐球菌常用药物药敏折点情况未见报道。对本院2007年8月—2018年7月艾滋病患者标本中分离的新生隐球菌菌株进行药物敏感性检测,并分析其报告,以期为本地区新生隐球菌的药物敏感性折点建立提供数据。
1 对象与方法
1.1 菌株来源 304 株新生隐球菌全部分离自云南省传染病医院住院艾滋病患者标本,患者来自云南省的16个地州市。同一患者相同标本分离的新生隐球菌均进行药敏检测,经比较检测结果相同,仅纳入一次检测结果进行统计分析,同一患者不同标本分离的新生隐球菌均纳入研究。质控菌株为克柔假丝酵母菌ATCC 6258 和近平滑假丝酵母菌ATCC 22019。
1.2 菌株培养及复核鉴定 将-80℃保存的临床分离的新生隐球菌菌株置于20℃复苏24 h,使其恢复繁殖活力。在无菌条件下,将其转种至沙保罗(SGC)培养基上,25℃孵育培养48~72 h,形成肉眼可见的菌落,然后进行菌种复核鉴定。复核鉴定由本院微生物室工作人员参照全国临床检验操作规程第四版要求[4],即根据菌落生长特征、镜下形态以及生化反应,结合VITEK 2 YST 卡进行菌种鉴定。
1.3 药敏试验 采用Thermo Fisher公司的真菌药敏板进行药敏试验,即比色微量稀释法,每块药敏板都包被有适当稀释浓度的抗真菌药物和显色剂。在药敏板中,各抗真菌药物及浓度范围分别为5-氟胞嘧啶0.06~64 μg/mL,泊沙康唑0.008~8 μg/mL,伏立康唑0.008~8 μg/mL,伊曲康唑0.015~16 μg/mL,氟康唑0.012~256 μg/mL,两性霉素B0.12~8 μg/mL。实验严格按照试剂盒说明书加样后,在非CO2培养箱培养72 h 读取结果。根据颜色改变目视观察抑制微生物生长的抗真菌药物的最低抑菌浓度(minimum inhibitory concentration,MIC)。实验同时检测克柔假丝酵母菌ATCC 6258和近平滑假丝酵母菌ATCC 22019进行质量控制。
1.4 结果判读 药物敏感性判断参照全国临床检验操作规程第四版[4]推荐的假丝酵母菌药物敏感性判断标准。
1.5 统计学处理 应用SPSS 19.0 统计软件对6种抗真菌药物的MIC50、MIC90和MIC 几何均数进行分析。
2 结果
2.1 标本来源 共收集2007年8月—2018年7月云南省传染病医院住院艾滋病患者标本分离的新生隐球菌304株,标本来源见表1。骨髓中检出隐球菌的11例患者中,在治疗的不同时期,有5 例曾在患者血液中检出,2 例曾在患者脑脊液中检出,4例仅在骨髓中检出。
表1304株新生隐球菌标本来源分布
Table1Distribution of specimen sources of 304 strains ofC.neoformans
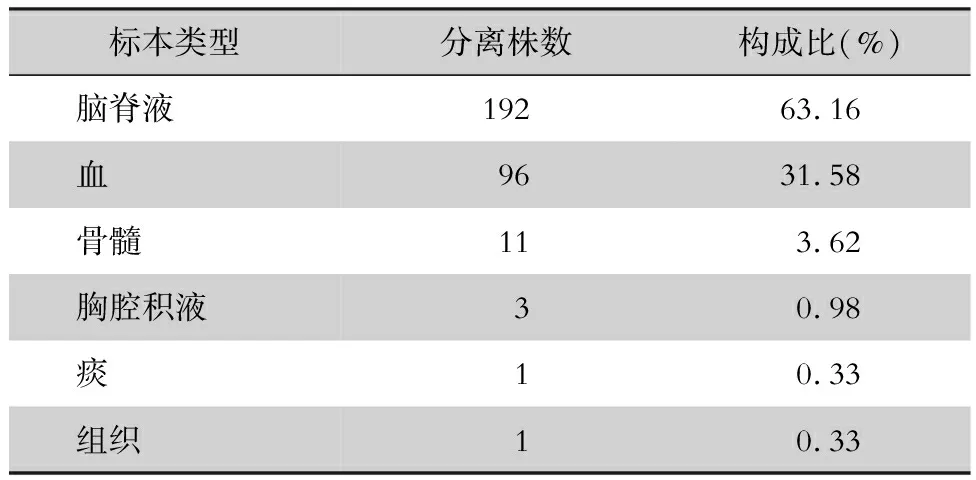
标本类型分离株数构成比(%)脑脊液19263.16血9631.58骨髓113.62胸腔积液30.98痰10.33组织10.33
2.2 抗真菌药物的敏感性
2.2.1 6 种常用抗真菌药物对新生隐球菌的MIC 值 药敏试验结果显示,304株新生隐球菌对唑类抗真菌药物(除氟康唑外)MIC均<1 μg/mL,多烯类的两性霉素B MIC≤4 μg/mL,氟康唑及5-氟胞嘧啶的MIC≤32 μg/mL。见表2。
2.2.2 5 种抗真菌药物对新生隐球菌的敏感性分析 未发现对伊曲康唑和氟康唑耐药的菌株。详见表3。
表26种抗真菌药物对新生隐球菌的MIC 值(μg/mL)
Table2MIC values of 6 kinds of antifungal agents againstC.neoformans(μg/mL)

抗真菌药物MIC范围MIC50MIC90MIC几何均数5-氟胞嘧啶0.5~32242.32泊沙康唑0.015~0.50.120.250.09伏立康唑0.008~0.250.030.060.039伊曲康唑<0.015~0.50.060.120.053氟康唑0.12~32483.28两性霉素B0.12~4110.75
表3304株新生隐球菌对5种抗真菌药物的药敏结果[%(株)]
Table3Antifungal susceptibility of 304 strains ofC.neoformansto 5 antifungal agents (%[No. of isolates])
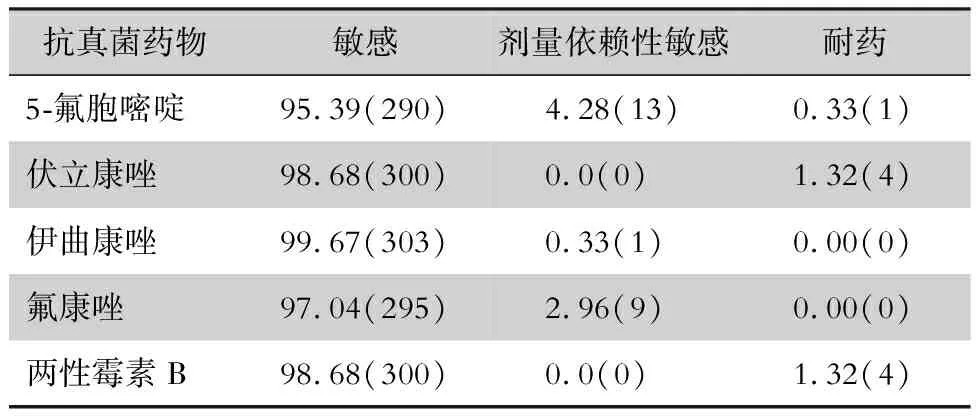
抗真菌药物敏感剂量依赖性敏感耐药5-氟胞嘧啶95.39(290)4.28(13)0.33(1)伏立康唑98.68(300)0.0(0)1.32(4)伊曲康唑99.67(303)0.33(1)0.00(0)氟康唑97.04(295)2.96(9)0.00(0)两性霉素B98.68(300)0.0(0)1.32(4)
注:泊沙康唑由于无体外药敏试验解释,在此不进行判断
3 讨论
新生隐球菌属条件致病菌,随呼吸经肺部侵入人体,由血液播撒至脑及脑膜,也可侵犯皮肤、骨和关节。该菌的发病与免疫力低下,尤其是HIV 感染有密切的关系。本研究中,检出新生隐球菌的标本类型以脑脊液和血液为主,占94.73%,其次为骨髓(11例,占3.62%)。据报道,新生隐球菌在广西[5]、云南[6]以及长沙[7]地区艾滋病患者骨髓标本中的检出率为2%~2.65%,与本研究结果基本一致。而在非艾滋病患者中[8-10]尚无骨髓检出新生隐球菌的报道,可能与艾滋病患者免疫力低下,新生隐球菌更易侵犯骨髓所致,提示艾滋病患者可联合采集脑脊液、血液和骨髓标本进行培养,以提高新生隐球菌的检出率。
在艾滋病合并隐球菌性脑膜炎的患者中,治疗初始阶段就使用两性霉素B 的患者,较初始时不使用此药治疗的患者死亡风险更低[11]。因此在艾滋病合并隐球菌感染的临床路径中,治疗首选药物推荐两性霉素B 和5-氟胞嘧啶[2]。本研究中两性霉素B对304 株新生隐球菌的MIC 范围为0.12~4 μg/mL,MIC50和几何均数(1 μg/mL 和0.75 μg/mL)均高于国内外的部分小样本文献[12-15]报道,如华东地区(96 株,MIC50为0.25 μg/mL,几何均数为0.302 μg/mL)[9],上海(35 株,MIC50为0.125 μg/mL,几何均数为0.26 μg/mL)[16],美国和日本(26 株,MIC50为0.0625 μg/mL)[17]。本研究的结果与国内[7-8]和国外[10,18-19]等检测样本量均大于100株的MIC50和几何均数结果较一致。Espinel-Ingroff等[20]对全球3 590株新生隐球菌进行药敏研究,结果显示,两性霉素B的MIC为2 μg/mL的菌株占0.95%(34株),MIC为4的菌株占0.084%(3株),与本次研究结果相近,提示扩大新生隐球菌药敏实验的样本量,能更全面地反映新生隐球菌对抗真菌药物的敏感性。在本研究中,有4株新生隐球菌两性霉素B 的MIC≥2 μg/mL,其中有1株为4 μg/mL,属罕见情况,因此对此4株菌抗真菌药物药物敏感性进行了复检,复检与初检结果一致。出现此种情况可能与艾滋病患者播散性新生隐球菌的复发率高,反复使用两性霉素B 治疗有关,提示高耐药株出现可能是无药物选择压力下的一种宿主反应[3]。
在本研究中,氟康唑、5-氟胞嘧啶、伏立康唑、泊沙康唑和伊曲康唑的MIC50、MIC90和几何均数均稍低于非HIV 感染性新生隐球菌有关研究[8-9]结果,与亚洲多中心的研究[21]结果一致,氟康唑、5-氟胞嘧啶、伏立康唑、泊沙康唑和伊曲康唑对艾滋病患者分离的新生隐球菌菌株的MIC 值与非艾滋病患者分离的菌株差异无统计学意义,但是艾滋病患者MIC 几何均数均小于非艾滋病患者。
本次研究以假丝酵母菌临床菌株体外药敏试验解释为药敏折点,对新生隐球菌进行判断,5种抗隐球菌药物敏感率均达到95% 以上,伊曲康唑最敏感,敏感率达到99% 以上,远高于相关文献[3,7,9,21]报道。

