腹腔镜辅助低位Ⅰ期直肠癌切除的远端切缘长度对远期预后的影响
罗 斌,贾凌威,胡俊波,冯永东
(华中科技大学同济医学院附属同济医院,湖北 武汉,430030)
腹腔镜下经括约肌间切除术、经肛门全直肠系膜切除术、经前会阴超低位直肠切除术等术式相继应用于低位直肠癌(肿瘤下缘距肛缘≤5 cm)的保肛治疗中,考虑到术后并发症、肛门直肠功能、学习曲线等因素,随着腹腔镜技术的进步,腹腔镜辅助下超低位直肠前切除术仍是目前低位直肠癌保肛治疗的主要术式[1-5]。腹腔镜辅助下超低位直肠前切除术的一大难题是远端切缘长度的选取。远端切缘较短时,由于肿瘤浸润性生长特点,可能出现肿瘤复发,无法达到根治效果;如果远端切缘过长,本就局促的空间内,肠管吻合难度更大,也严重影响了术后患者的肛门功能。全直肠系膜切除、环周切缘状况是影响直肠癌局部复发的重要因素,远端切缘长度在保肛的要求下越来越短,部分学者甚至认为,远端切缘长度与全直肠系膜切除、环周切缘等不同,并不是影响患者预后的关键因素,只需保证远端切缘阴性即可[6-8]。为此,本研究纳入2011年1月至2013年12月华中科技大学同济医学院附属同济医院收治的86例Ⅰ期低位直肠癌患者,根据标本固定后病理报告提示的远端切缘长度进行分组,以探讨其对低位直肠癌根治术后远期预后的影响。
1 资料与方法
1.1 临床资料 本组共86例患者,41例行腹腔镜辅助下腹-会阴联合直肠癌根治术(Miles组),45例行腹腔镜辅助下超低位直肠前切除术,其中24例远端切缘<1 cm+吻合环(A组),21例远端切缘≥1 cm+吻合环(B组)。纳入标准:(1)肿瘤下缘距肛缘≤3~5 cm;(2)术后病理诊断为直肠腺癌;(3)术后病检提示切缘阴性,R0切除;(4)病理分期为T1~2N0M0(第八版AJCC TNM分期标准)。排除标准:(1)有恶性肿瘤病史;(2)合并其他部位恶性肿瘤;(3)≥70岁;(4)急诊手术,内镜下黏膜切除术、内镜黏膜下剥离术、痔疮或肛瘘等手术后,病检提示腺癌再次手术者。
1.2 手术方法
1.2.1 超低位直肠前切除术 患者取截石位,麻醉满意后常规消毒铺巾,常规腹壁做操作孔,置入腹腔镜探查,确定手术方式及切除范围。首先解剖分离乙状结肠系膜,显露并保护输尿管,显露肠系膜下动脉及直肠上动脉。近肠系膜下动静脉或直肠上动静脉根部用钛夹、可吸收夹双重夹闭,清扫血管根部淋巴脂肪组织。游离乙状结肠与侧腹壁粘连,切开侧腹膜。沿结肠系膜根部向下切断结肠系膜,切开腹膜返折,向下游离直肠,切除直肠系膜,保护骶血管及神经。游离直肠至肿块下方1~2 cm,作直肠预切除线(以Endo-GIA切断闭合),距肿块上方10~15 cm处做近端结肠预切除线。经左下腹部5 cm小切口切开入腹,保护切口,将直肠肿块及乙状结肠移出腹腔,切除肠段及其系膜,以EEA吻合器行结肠直肠端端吻合,吻合满意后,经肛放置肛门引流管(过吻合口),经左下腹放置引流管于吻合口旁。根据术中吻合情况,决定是否行末端回肠双腔造口。
1.2.2 Miles 腹腔镜下操作大致同超低位直肠前切除术,但需游离直肠至尾骨尖肛提肌平面,右下腹逐层切开入腹,于乙状结肠中段切断,结肠近端于腹膜外造口,一期开放成形。会阴手术组:再次消毒会阴,荷包缝合关闭肛门口,距肛缘约3 cm环形切开皮肤及皮下组织,显露肛提肌,结扎双侧肛门动脉。将肛门直肠推向前方,于尾骨尖切断尾骨直肠韧带,切开直肠背侧的部分肛提肌,钝性分离,伸入骶骨前间隙,与腹部手术组会合。将远端乙状结肠、直肠拉出切口外,于括约肌外切断游离直肠侧壁、前壁,注意保护尿道,直至将肛管直肠完全切除。仔细止血,生理盐水冲洗盆底,常规间断缝合关闭盆底肛提肌及皮肤切口,骶前放置负压引流管一根、自会阴切口引出。腹部手术组:关闭盆底腹膜,检查腹腔无活动性出血,常规间断关闭腹腔。
1.3 观察指标 观察3组患者5年无瘤生存率、5年总生存率。
1.4 统计学处理 采用SPSS 21.0软件进行数据分析。计量资料满足正态分布者,以(±s)表示,采用方差分析;分类资料以率(%)表示,采用χ2检验或Fisher确切概率法进行分析。生存分析采用Kaplan-Meier法,采用log-rank检验比较两条生存曲线的差异。P<0.05为差异有统计学意义。
2 结 果
3组患者临床资料差异无统计学意义,具有可比性。见表1。Miles组与B组相比,5年无瘤生存率(94.7%vs.94.7%,P=0.794)、5年总生存率(97.1%vs.94.4%,P=0.446)差异无统计学意义;与B组相比,A组5年无瘤生存率(69.6%vs.94.7%,P=0.020)较差,5年总生存率(80.6%vs.94.4%,P=0.042)较差,预后更差。 见图1、图2。
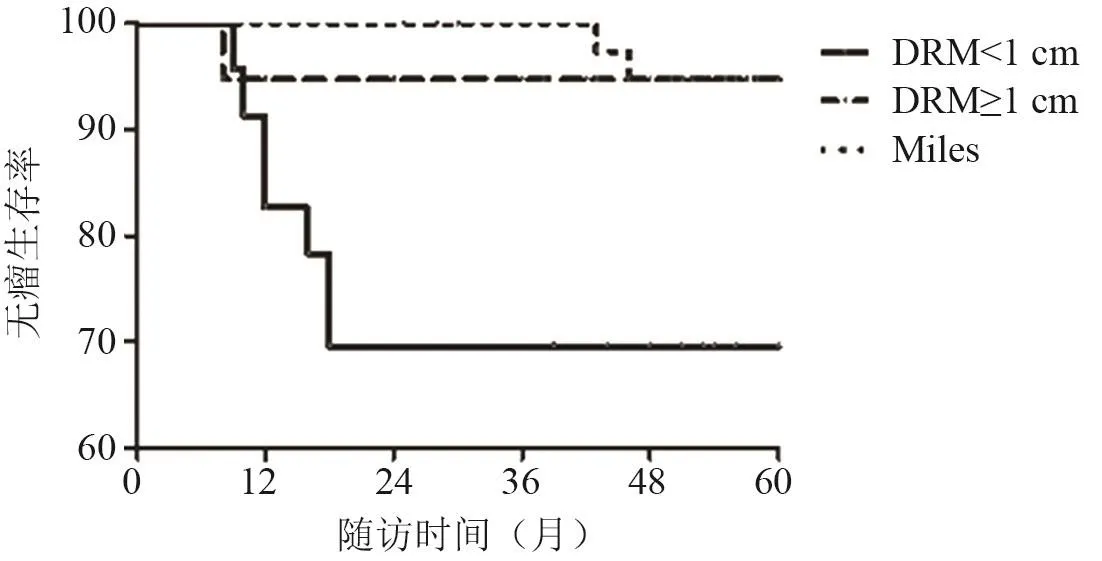
图1 Ⅰ期低位直肠癌的5年无瘤生存率
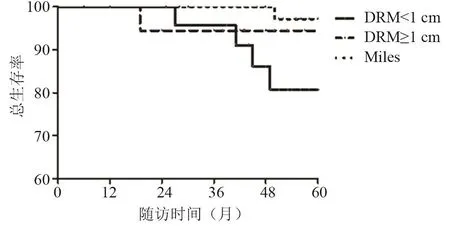
图2 Ⅰ期低位直肠癌的5年总生存率
3 讨 论
肿瘤远端切缘长度一直是横亘于保肛前的一大难题。切缘较短时,由于肿瘤浸润性生长特点,可能出现肿瘤复发,无法达到根治效果。如果远端切缘过长,本就局促的空间内,给肠管吻合带来了极大的挑战,也严重影响了术后患者的肛门功能。为此,学者们不断探索最短的安全远端切缘。
1982年Rognum提出,肿瘤组织向周围正常组织侵袭浸润过程中,肿瘤边缘的正常细胞通常观察不到异形性,但实际上,正常细胞已出现了分子水平的改变,表现为肠管黏膜上皮杯状细胞内的唾液酸黏蛋白的表达量明显增加,硫酸黏蛋白的表达量减少甚至消失,Rognum将已发生分子水平改变的肿瘤旁组织定义为直肠癌旁移行黏膜[9]。1997年刘世信等[10]将肿瘤远端2 cm的肠管黏膜上皮消化后进行流式分析,发现其S期细胞的百分比计数已显著高于近切端的黏膜上皮。2005年丁志杰等[11]对42例直肠癌术后标本中细胞黏附分子CD44v6的表达量进行了分析,发现距肿瘤边缘3 cm甚至5 cm处的肠管黏膜上皮组织内已发生癌基因相关蛋白的异常表达。这些研究从组织学分子学等角度说明癌旁2 cm内的组织与正常组织已存在差异。而一些临床随访研究却发现1 cm的远端切缘已足够安全。
表1 3组患者临床资料的比较(±s)
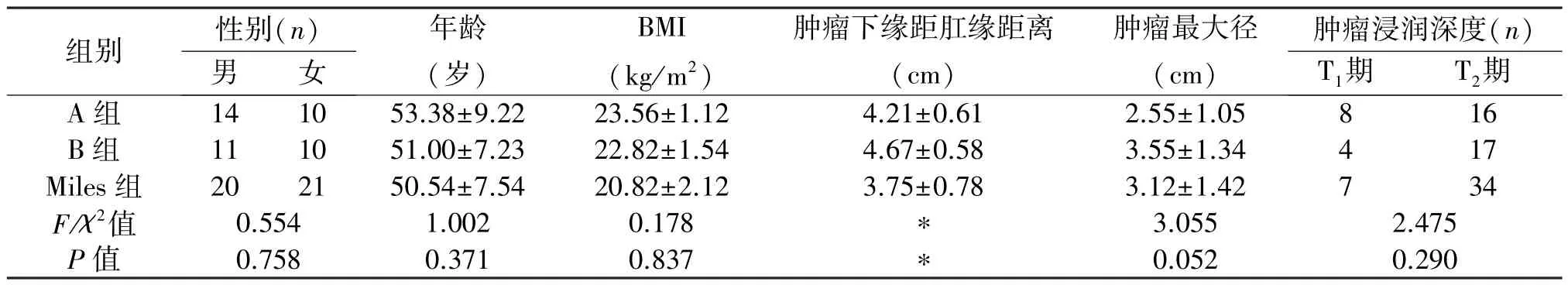
表1 3组患者临床资料的比较(±s)
组别 性别(n)肿瘤浸润深度(n)男 女年龄(岁)BMI(kg/m2)肿瘤下缘距肛缘距离(cm)肿瘤最大径(cm)T1期 T2期A 组 14 10 53.38±9.22 23.56±1.12 4.21±0.61 2.55±1.05 8 16 B 组 11 10 51.00±7.23 22.82±1.54 4.67±0.58 3.55±1.34 4 17 Miles组 20 21 50.54±7.54 20.82±2.12 3.75±0.78 3.12±1.42 7 34 F/χ2值 0.554 1.002 0.178 * 3.055 2.475 P值 0.758 0.371 0.837 * 0.052 0.290
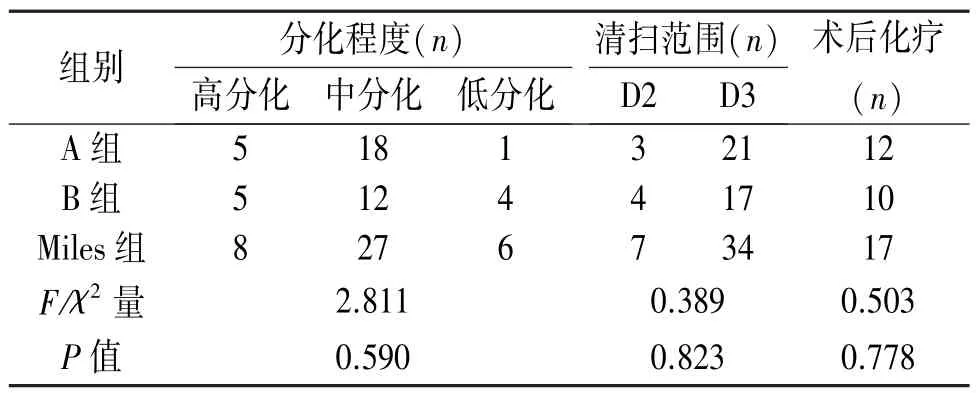
续表1
2009年Leo等[6]发现,远端切缘阳性与阴性患者的生存率、复发率存在显著差异,而远端切缘<1 cm与>1 cm的患者,5年生存率、局部复发率差异无统计学意义。2012年Bujko等[12]发表一项纳入17篇文献的Meta分析,文中提出,对于组织学较好的肿瘤,远端切缘<1 cm甚至<5 mm并不影响局部复发率与5年生存率。2018年Keranmu等[13]发现,远端切缘阳性但吻合环阴性(<5 mm)患者的预后与远端切缘阴性患者相当。此外,随着研究的深入,学者们发现全直肠系膜切除的完整性、环周切缘质量等同样影响直肠癌术后的局部复发[14-17],切除较多肠管的重要性似乎有所下降。
基于上述争议,本研究对腹腔镜辅助低位直肠癌的最短安全远端切缘长度展开了研究。由于上述临床研究均纳入了局部进展期直肠癌病例,因此本研究仅纳入Ⅰ期低位直肠癌患者,由于肿瘤浸润深度浅,全系膜切除及环周切缘阴性可得到充分保证;此外,由于病理分期较早,术后无需放疗,可排除术后放疗对局部复发率的影响。因此,本研究可充分探究远端切缘长度对低位直肠癌术后远期预后的影响。
本研究结果显示,Miles组与B组预后相当,表明腹腔镜辅助下超低位直肠前切除术行超低位保肛是可行的,在保证患者生存质量的同时,提高了患者的生活质量,避免了永久性造口给患者的心理健康及生活工作带来的负面影响。本研究发现,B组预后优于A组,因此,为确保超低位保肛的安全性,降低保肛术后复发转移率,主刀医师必须保证远端切缘长度≥1 cm(标本固定后),因本研究将福尔马林固定后测量的远端切缘长度作为标准,不适用于临床,因此亟需另一项研究,通过对直肠肿瘤标本在不同状态下进行测量,明确变化规律,将安全的病理切缘转化为可被临床医生应用的术中切缘。此外,本研究为单中心的回顾性研究,样本量较少,尚待大样本、多中心的研究证实。

