吲哚菁绿标记近红外荧光腹腔镜胃癌根治术的应用价值评估
魏 猛,陈 成,王立梅,李 真,孙丹平,刘 鹏,于文滨,胡三元
(山东大学齐鲁医院,山东 济南,250012)
在我国,胃癌发病率及死亡率在所有恶性肿瘤中均居前列,并且在世界范围内,我国亦是胃癌发病率最高的国家[1-4]。现阶段,胃癌的总体治疗策略是以外科治疗为主的综合治疗,根治性切除是唯一可达到胃癌治愈效果的治疗手段。胃癌的根治性切除主要包括两方面,一是完整切除胃部肿瘤及彻底的淋巴结清扫,二是消化道重建。前者是影响胃癌患者术后远期生存最主要的因素,而后者则与术后近期安全性密切相关[1,5-9]。随着完全腹腔镜胃癌根治术的推广与普及,其安全性及预后已逐渐成为腔镜外科医师追求的新目标,加之近年功能性腹腔镜技术的开发与应用,功能性完全腹腔镜胃癌根治术应运而生。功能性腹腔镜技术的主要目的是在达到根治性手术的前提下尽可能保留器官功能,进而提高患者术后生存质量[10]。就胃癌根治术而言,精准而完整的肿瘤切除、精确彻底的淋巴结清扫及安全确定的消化道重建是功能性腹腔镜胃癌根治术需要解决的主要问题。较多学者包括我们团队均对功能性腹腔镜胃癌根治术进行了初步探索,通过纳米炭标记指导腹腔镜胃癌根治术中肿瘤的定位及淋巴结清扫,发现纳米炭不仅有助于镜下精准定位肿瘤进而达到完整性切除,更有助于发现并清扫更小的淋巴结,有效提高淋巴结检出率[11-14]。近年发现,吲哚菁绿(indocyanine green,ICG)标记近红外成像荧光腹腔镜系统可实现纳米炭的功能[15-17],还可用于评估消化道重建过程中组织的血供[18],实现胃癌前哨淋巴结导航[10,19-20]。关于ICG在腹腔镜胃癌根治术中的应用我们已进行了初步尝试与探索[21]。本研究旨在系统探讨术前胃镜下ICG标记在近红外腹腔镜胃癌根治术中的肿瘤定位作用及淋巴引流导航效果,并通过术中静脉注射ICG评估其在吻合口血供中的作用,进而对ICG标记近红外荧光腹腔镜胃癌根治术的应用价值进行较全面地评估与探究。
1 资料与方法
1.1 临床资料 本研究回顾分析2017年12月至2019年1月山东大学齐鲁医院胃肠外科收治的经胃镜及病理确诊的87例胃癌患者,其中42例在ICG标记近红外线荧光腹腔镜下完成胃癌根治术(观察组),45例行常规腹腔镜手术(对照组),均由同一组医师行腹腔镜胃癌D2根治术,两组患者临床资料差异无统计学意义,见表1。排除标准:(1)晚期肿瘤局部广泛浸润或远处转移无根治性手术条件;(2)胃食管结合部癌,BorrmannⅣ型胃癌;(3)开腹手术、合并其他脏器切除或腹腔镜手术中转开腹;(4)术前接受放化疗或免疫治疗等内科治疗;(5)因肿瘤复发或残胃癌再次手术;(6)对ICG过敏或碘化物过敏。
1.2 方法
1.2.1 ICG术前标记方法 观察组于术前16~24 h内在胃镜下行ICG溶液标记,标记前充分告知患者及家属,并签知情同意书。ICG溶液配制:选用丹东医创药业有限责任公司生产的注射用 ICG,无菌注射用水完全溶解,配制成1.25 mg/mL ICG溶液。胃镜下在肿瘤边缘与正常胃黏膜交界处分别选取口侧、肛侧及左右两侧4个象限进行黏膜下注射。标记方法:黏膜下“三明治”法标记,即在注射点位斜行刺入注射针至黏膜下,按0.5 mL注射用水(抬举黏膜)+0.5 mL ICG溶液+0.5 mL注射用水(封堵以减少ICG外溢)的顺序进行标记。
1.2.2 术中ICG注射方法及消化道血供评估方法 配制2.5 mg/mL ICG溶液,术中消化道重建完成后,于外周静脉内注射,首先注射3 mL ICG溶液,再注射10 mL生理盐水。吻合口血供评估方法:ICG注射完成后,近红外腹腔镜调整至绿色荧光模式,3~5 min内注意观察吻合口、十二指肠残端及两侧或单侧肠管、胃壁的绿色荧光情况,出现绿色荧光后,不断切换绿色与红蓝色荧光模式继续观察荧光强度。因ICG注射入血后3~8 min内即开始被肝脏代谢,因此需在注射后15 min内完成吻合口、残端及胃壁肠壁血供的评估。根据荧光情况及Sherwinter等[22]报道的评分系统对吻合口血供进行评估。Sherwinter评分系统:注射完成后15 min内,蓝色荧光模式下:(1)1分,无荧光;(2)2分,有斑片状荧光部位(蓝色荧光);(3)3分,荧光完全,且荧光程度均匀(蓝色荧光);(4)4分,荧光完全(蓝色荧光),且局部出现高荧光强度(红色荧光);(5)5分,荧光完全,且整体呈现高荧光强度(红色荧光)。
1.2.3 手术方法 两组均行腹腔镜胃癌D2根治术,观察组术中在近红外线腹腔镜(Stryker公司Pinpoint荧光腹腔镜)绿色荧光模式下用电凝钩标记绿染边缘,并沿绿染边缘进行胃切除,淋巴结清扫过程中不断切换近红外线腹腔镜自然光模式与荧光模式,将荧光显色的淋巴结、明显肿大而不显色的淋巴结所在组别内的淋巴结彻底清扫;对照组施行标准的D2淋巴结清扫。切除标本均送快速病理检查,以确定手术切缘是否阴性。
1.2.4 标本处理 两组标本均由专人在近红外线腹腔镜绿色荧光模式下严格按照“the Japanese Classification of Gastric Carcinoma:3rd English edition”进行淋巴结分检[7],标明所分拣淋巴结所属组别及站别(图1),测量每一枚淋巴结最大直径并记录,分别按组别送常规病理检查。术中用电凝钩沿绿染边缘进行标记,并沿上下边缘切除胃组织,术中或术后用标记笔沿电凝钩标记划线,测量并记录观察组切除胃标本浆膜层绿色荧光边缘(术中电凝钩标记线位置)至肿瘤边缘的距离(垂直于手术切线),见图2。
1.3 统计学处理 采用SPSS 20软件进行数据分析,连续变量采用t检验或Wilcoxon检验,分类变量采用χ2检验或Fisher精确概率法。
2 结 果
2.1 手术情况 观察组患者均在内镜下顺利完成ICG标记,无一例因注射ICG出现毒副作用。两组患者均顺利完成腹腔镜胃癌D2根治术,无一例中转开腹。观察组行全腹腔镜胃癌根治术38例、腹腔镜辅助胃癌根治术4例;对照组行全腹腔镜胃癌根治术40例、腹腔镜辅助胃癌根治术5例;两组相比差异无统计学意义(P>0.05)。观察组中9例患者行根治性全胃切除术,6例行近端胃切除术,27例行远端胃切除;对照组中6例行根治性全胃切除术,5例行近端胃切除术,34例行远端胃切除术;两组手术方式差异无统计学意义(P>0.05)。两组术中出血量、手术时间差异无统计学意义(P>0.05)。术后观察组中4例患者出现并发症,其中切口感染1例,肺部感染3例;对照组中6例患者出现术后并发症,其中消化道瘘2例,切口感染1例,肺部感染3例,两组术后并发症发生率差异无统计学意义(P>0.05)。两组患者术中快速病理检查及术后常规病理检查均提示切缘阴性。见表2。
2.2 淋巴结检获情况 观察组共检出淋巴结1 542枚,对照组检出1 405枚;观察组平均清扫淋巴结数量高于对照组(P<0.05);两检出阳性淋巴结数量差异无统计学意义(P>0.05)。两组第一站、第二站淋巴结清扫总数及阳性淋巴结数量差异均无统计学意义(P>0.05)。观察组检出直径<5 mm的淋巴结数量高于对照组,差异有统计学意义(P<0.05);两组检出直径≥5 mm的淋巴结数量差异无统计学意义(P>0.05)。 见表3。
2.3 ICG标记的肿瘤定位作用 观察组患者ICG标记均顺利完成,无一例出现刺穿浆膜导致标记失败。近红外线荧光腹腔镜荧光模式下发现,标记后ICG由注射点向四周均匀扩散,绿色荧光范围呈椭圆形,肿瘤多位于绿染中央部,术中或术后测量观察组切除胃标本浆膜层绿色荧光边缘(术中电凝钩标记线位置)至肿瘤边缘的距离(垂直于手术切线)并记录。全胃切除患者肿瘤切缘与荧光绿染上切缘距离为3.0~5.3 cm,平均(3.90±0.82)cm;与下切缘距离为3.1~5.6 cm,平均(3.78±0.65)cm。近端胃切除患者肿瘤切缘与荧光绿染上切缘距离为3.1~4.8 cm,平均(3.62±0.66)cm;与下切缘距离为5.3~8.9 cm,平均(6.81±1.91)cm。远端胃切除术患者肿瘤切缘与荧光绿染上切缘距离为5.2~9.7 cm,平均(6.42±2.07)cm;与下切缘距离为3.3~4.8 cm,平均(3.9±0.72)cm。
表1 两组患者临床资料的比较(±s)
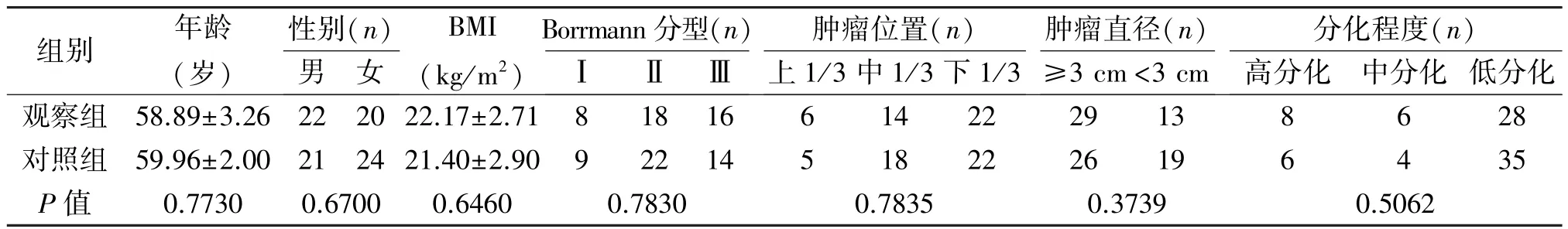
表1 两组患者临床资料的比较(±s)
组别 年龄(岁)性别(n)Borrmann分型(n)肿瘤位置(n)肿瘤直径(n)分化程度(n)男 女BMI(kg/m2)Ⅰ Ⅱ Ⅲ 上1/3中1/3下1/3≥3 cm<3 cm 高分化 中分化 低分化观察组 58.89±3.26 22 20 22.17±2.71 8 18 16 6 14 22 29 13 8 6 28对照组 59.96±2.00 21 24 21.40±2.90 9 22 14 5 18 22 26 19 6 4 35 P值 0.7730 0.6700 0.6460 0.7830 0.7835 0.3739 0.5062
表2 两组患者手术情况的比较(±s)

表2 两组患者手术情况的比较(±s)
组别 手术时间(min)辅助方式(n)手术方式(n)全腔镜 腔镜辅助 全胃 近端胃 远端胃术中出血量(mL)并发症(n)首次通气时间(h)术后住院时间(d)观察组 295.3±35.10 38 4 9 6 27 26.67±6.28 4 62.17±11.37 7.63±1.33对照组 279.4±42.36 40 5 6 5 34 24.17±5.07 6 67.00±9.94 8.25±1.04 P值 0.1297 0.8081 0.4985 0.7631 0.7402 0.4513 0.3119
表3 两组患者术后淋巴结分检情况的比较(±s)
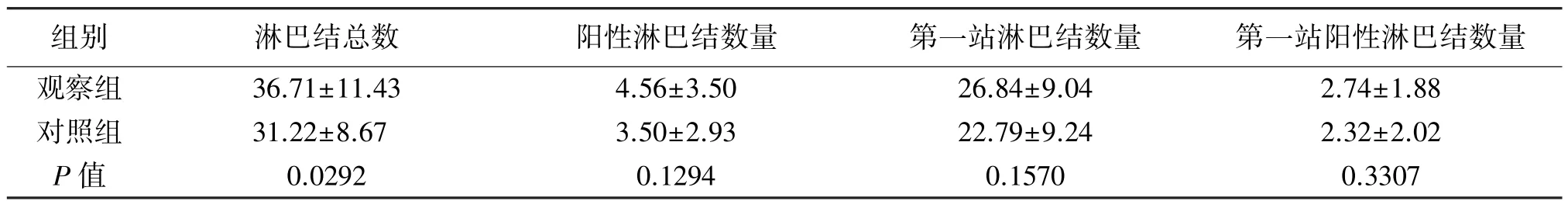
表3 两组患者术后淋巴结分检情况的比较(±s)
组别 淋巴结总数 阳性淋巴结数量 第一站淋巴结数量 第一站阳性淋巴结数量观察组 36.71±11.43 4.56±3.50 26.84±9.04 2.74±1.88对照组 31.22±8.67 3.50±2.93 22.79±9.24 2.32±2.02 P值 0.0292 0.1294 0.1570 0.3307

续表3
2.4 ICG在吻合口血供评估中的作用 观察组患者完成消化道重建后,通过静脉注射ICG溶液在荧光模式下顺利完成吻合口与十二指肠残端血供评估,根据Sherwinter评分系统,吻合口与十二指肠残端血供评分均≥3分(图3)。

图1 术后在荧光腹腔镜荧光模式下分检淋巴结
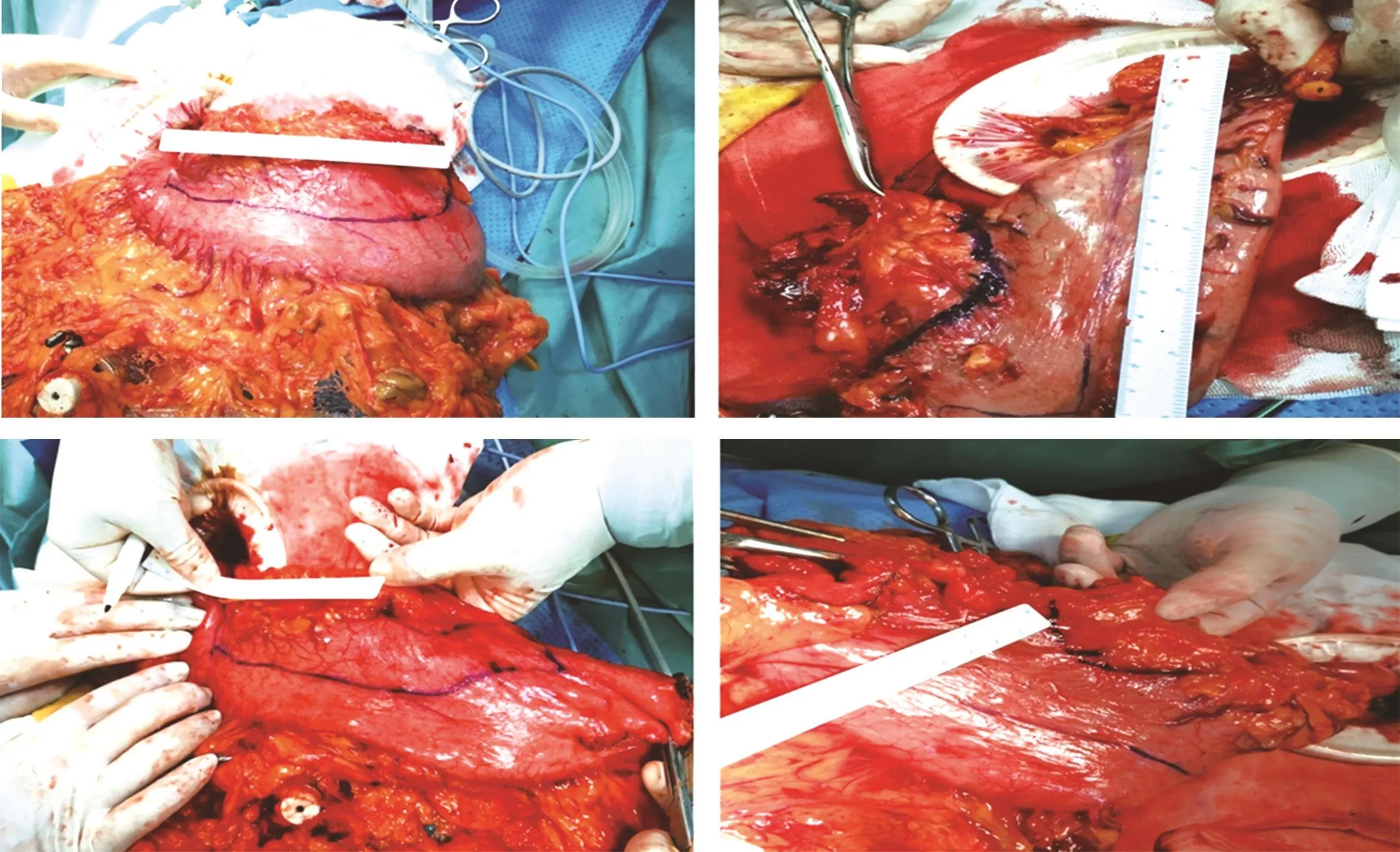
图2 测量浆膜层荧光范围边缘至肿瘤边缘的距离
3 讨 论
本研究回顾性分析了2017年12月至2019年1月山东大学齐鲁医院胃肠外科手术治疗的87例胃癌患者,其中42例在ICG标记近红外线荧光腹腔镜下完成手术,并与45例普通腹腔镜手术患者进行对比,结果显示,ICG标记可显著提高术后淋巴结检出数量,尤其直径<5 mm的淋巴结更具优势。两组术后分检出阳性淋巴结数量差异无统计学意义,表明ICG标记在阳性淋巴结示踪方面与普通腔镜手术无显著差异。此外,术后测量肿瘤切缘与荧光范围边缘距离,结果显示腹腔镜手术中沿ICG荧光边缘切除胃壁是安全、可行的。
不论是开腹手术抑或腹腔镜手术,肿瘤的完整切除及引流淋巴结的彻底清扫是完成胃癌根治术的必备条件[1,5-9]。然而与开腹手术相比,腹腔镜手术由于缺少了手的触觉感对胃部肿瘤的精准定位远不及开腹手术,尤其肿瘤未侵及浆膜时单纯靠肉眼等对肿瘤定位更加困难[6,8,23]。 此外,胃癌根治术中淋巴结清扫数量的多寡与患者的预后密切相关[1,5]。因此,肿瘤精准完整的切除及精确彻底的淋巴结清扫一直是腹腔镜外科医师的努力方向,这也是功能性腹腔镜胃癌根治术所要解决的主要问题[10]。我们团队之前通过研究发现,术前消化内镜下通过纳米炭标记可实现腔镜下肿瘤的精准定位,并可通过纳米炭的淋巴引流示踪指导胃癌根治术淋巴结清扫过程,显著提高了淋巴结清扫数量与完整率[11]。然而我们在对纳米炭的应用中发现,术前纳米炭对胃癌的标记一旦刺穿浆膜,会使镜下整个术野被黑色覆盖,难以分辨组织层次,不仅不能定位肿瘤、示踪淋巴结,还会增加手术难度。为了更好的解决这个问题,我们对ICG标记近红外成像荧光腹腔镜系统进行了尝试[21],通过本研究发现ICG标记近红外成像荧光腹腔镜系统不仅可实现纳米炭的功能,同时标记失败后仅应用荧光腹腔镜的普通模式亦可顺利完成手术而不受影响,避免标记失败增加手术难度。
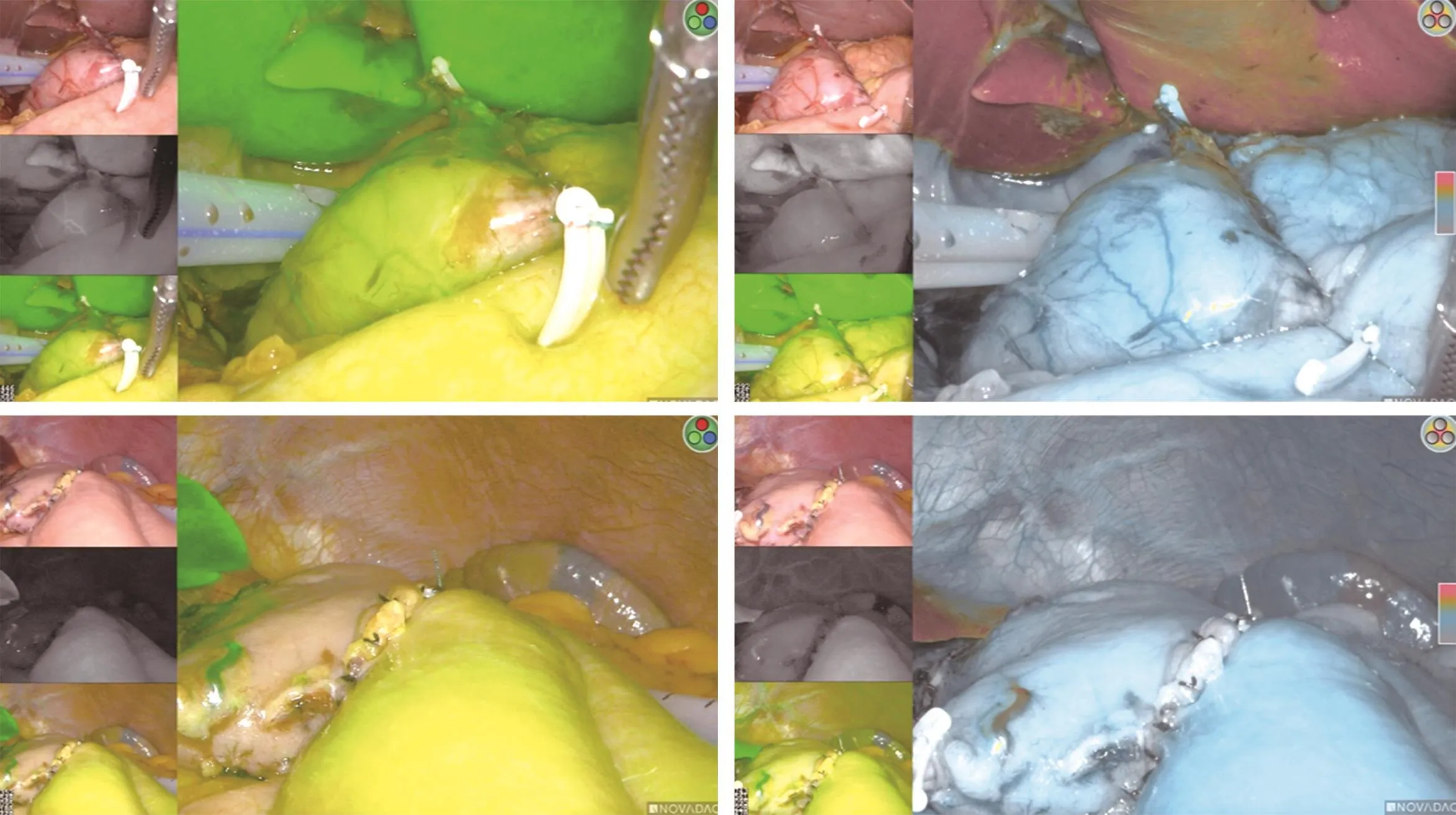
图3 术中静脉注射ICG评估消化道血供的情况
ICG显影技术应用于医学研究最早可追溯至十九世纪六十年代,早期用于评估心脏功能、肝功能等,最近十几年应用于前哨淋巴结示踪导航、组织血供评估等,ICG的应用领域正在逐渐扩展并取得了较好的临床效果。ICG是一种相对无毒副作用的荧光染色剂,其临床应用在1959年即得到了美国FDA的批准,在无过敏反应且低于2.0 mg/kg的浓度下应用无任何毒副作用。其主要由肝脏分解代谢并经胆道系统排出体外,半衰期为3~4 min[24-27]。随着近年ICG标记近红外线成像腹腔镜系统的出现,ICG标记在腹腔镜外科手术中的应用越来越广泛,其应用主要包括两大方面:一是静脉内注射,用于评估组织血供,此技术在腹腔镜结直肠癌等手术中已得到广泛应用,而在胃癌根治术中的应用鲜有报道[18,22]。二是在肿瘤周围局部注射,用于肿瘤定位、淋巴结导航。对于腹腔镜胃癌根治术中淋巴结导航的应用主要集中在前哨淋巴结导航,而对于淋巴引流导航指导淋巴结清扫的应用报道较少[15-17]。ICG局部注射后一部分与组织中的白蛋白结合而存留在局部,通过荧光腹腔镜观察局部荧光情况进而定位肿瘤,另一部分ICG逐渐被淋巴系统吸收并与淋巴管内白蛋白结合,并随淋巴管引流至淋巴结,最终回流至血液系统,在肝脏内分解代谢;淋巴液的回流速度缓慢加之淋巴结的存在,使淋巴系统对ICG的转运速率很慢,因此ICG可在淋巴系统内存在较长时间,这也是 ICG应用于淋巴引流导航的原理[28]。本研究中,观察组均顺利完成ICG标记及术中静脉注射,无一例患者出现ICG相关毒副作用,并且均顺利完成术中定位肿瘤、引流淋巴结标记及重建消化道的血供评估,这也是国内首次对ICG标记在功能性腹腔镜胃癌根治术中较为完整的应用评估。
胃癌的淋巴引流是多向且复杂的,加之胃周复杂的血管分布,使得有效的淋巴结清扫难度、风险均较高[1,6],单纯靠肉眼直视下识别、依靠经验清扫可能导致清扫不彻底,尤其小的淋巴结往往会有遗漏。本研究发现,术前内镜下ICG标记后,术中通过荧光模式将荧光显色的淋巴结及明显肿大而不显色的淋巴结所在组别内的淋巴结彻底清扫,可显著提高术后淋巴结检出数量,这与Kwon等[15]的报道是一致的。并且淋巴结被荧光绿染后,较容易与周围血管、脂肪及胰腺区分,清扫更彻底、更安全。但值得注意的是操作过程中需不断切换荧光模式与常规模式,通过荧光模式识别出绿染的淋巴结,而清扫过程需在常规模式下进行,这是因为在荧光模式下往往对血管识别不清楚,清扫淋巴结过程中损伤血管造成不必要出血的风险更高。术后通过测量清扫淋巴结直径发现,对于直径≥5 mm的淋巴结的清扫两组无明显差别,而对于直径<5 mm的淋巴结的清扫,ICG标记更有明显的优势,这可能是因为小的淋巴结与周围脂肪组织较难区分,普通腹腔镜下对于小淋巴结的识别比较困难,凭经验清扫往往会造成遗漏。通过对比两组患者术后分检出的阳性淋巴结数量发现,ICG标记在阳性淋巴结清扫方面与普通腔镜手术无显著差别,这表明ICG对于阴性、阳性淋巴结的示踪是无差别的;此外,我们还发现,术中在荧光模式下部分肿大淋巴结并未绿染,而这些肿大淋巴结中往往阳性比例较高,这可能系引流至肿大淋巴结的淋巴管中存在癌栓造成淋巴管阻塞,从而使ICG无法引流至此所致。因此在腹腔镜胃癌根治术清扫淋巴结过程中,ICG示踪只能用来指导与辅助淋巴结的清扫,而不能单纯依赖淋巴结是否染色决定清扫程度。
腹腔镜胃癌根治术中肿瘤的精准定位对于肿瘤的完整切除至关重要,并且精准的定位更有助于术者合理的选择手术方式。而腔镜手术由于缺少了手触觉的直接感知,尤其未侵及浆膜的胃癌,仅靠肉眼识别与手术器械的感觉往往难以精准定位。更重要的是临床实践中,术者根据切缘距离选择行全胃切除术或胃大部切除术[1,6],对术后并发症发生率及生活质量具有深远影响。因此术前在消化内镜下行纳米炭[11]、钛夹等标记肿瘤,对于术中肿瘤的精准定位是十分必要的。本研究发现,术前通过消化内镜下对肿瘤边缘口侧、肛侧及左、右两侧4个象限进行标记,术中可精确定位肿瘤,荧光范围呈沿胃纵轴分布的椭圆形,肿瘤多位于绿染范围的中央位置。根据各胃癌诊疗指南[1,5-7],局限型胃癌胃切缘距肿瘤应>3 cm,浸润型胃癌胃切缘距肿瘤边缘应>5 cm。胃食管结合部癌食管切缘距肿瘤边缘应>3 cm,切缘可疑时应行术中快速病理检查;肿瘤侵犯幽门管时,十二指肠切缘距肿瘤边缘应>3 cm。本研究中沿ICG荧光范围边缘切除胃组织,并且术后测量肿瘤边缘与荧光范围各边缘的距离发现,上或下切缘与肿瘤边缘的距离均超过胃癌根治术切除胃组织范围的标准[1,5-7],更重要的是术中我们沿荧光范围边缘切除胃组织后送检术中快速病理及术后常规病理检查,均得到切缘阴性的结果。这表明术前ICG标记不仅可精确定位肿瘤,更能指导腹腔镜胃癌根治术的切除范围,因此根据ICG荧光范围确定手术切除范围可在保证完整切除肿瘤的前提下避免过度扩大手术范围,这可能在术者选择切除方式时发挥至关重要的作用。
除了完整切除肿瘤、彻底清扫淋巴结外,胃癌根治术的另一重要环节是消化道重建。消化道重建直接影响围手术期消化道瘘的发生,而影响重建效果的因素中最重要的是重建消化道的血液供应,因此术中及时发现消化道血供不足并加以纠正是避免术后出现消化道瘘最有效的方法[1,5-6,8]。ICG注射入血后迅速与血中白蛋白、脂蛋白结合,使ICG无法透过血管壁而蔓延至血管外,并随血液循环快速扩散至全身,最终在肝脏内分解代谢,其在血液中的半衰期为3~5 min,这也是ICG用于评估组织血液灌注的原理[25,27]。本研究通过术中静脉注射ICG在腹腔镜荧光模式下对消化道血供进行评估,并通过Sherwinter评分系统对组织血供进行量化,结果显示观察组重建后消化道评分均≥3分,术后无一例发生消化道瘘,表明胃癌根治术中应用ICG评估重建后的消化道血供是可靠的,并且术中Sherwinter评分≥3分可作为评估消化道重建确定性的参考指标之一,可有效避免术后消化道瘘的发生,吻合口血供评分情况对于评估消化道重建的确定性具有一定的指导意义,这与Huh等[18]的研究结果一致。
综上所述,ICG标记近红外线荧光腹腔镜胃癌根治术是安全、可行的,其淋巴结示踪作用在指导淋巴结清扫方面具有显著优势,并且更精细、彻底的清扫淋巴结,对术后患者精确的临床病理分期、进一步治疗方案的选择及预后判断均具有重要的指导意义。术前ICG标记不仅可在腹腔镜胃癌根治术中精确定位肿瘤,并可指导术者确定手术切除范围,选择更为合理的手术方式,实现功能性腹腔镜所要求的在保证肿瘤完整切除的前提下尽可能保留器官功能,进而提高患者术后生存质量,使患者获益更多。此外,术中静脉注射ICG评估重建后消化道血供可有效避免术后消化道瘘的发生,提高围手术期安全性。作为功能性腹腔镜技术的重要一员,ICG标记近红外荧光腹腔镜胃癌根治术的临床应用值得期待。本研究是我们对ICG标记近红外荧光腹腔镜在胃癌根治术中应用价值的初步探讨,也是对功能性腹腔镜技术的进一步探索,尚存有不足之处,我们会在以后 的临床与研究工作中进行更为深入的探究。

