BOP1对胃癌BGC823细胞迁移和侵袭的影响
张 娜,孔德润
胃癌是最常见的恶性胃肠癌之一,而我国是胃癌发病率最高的地区之一[1]。胃癌患者死亡的主要原因是胃癌细胞的转移和侵袭,通常在出现明显症状时多已发生转移[2],且患者术后五年生存率很低。了解胃癌病程进展和转移的分子机制对胃癌的早期诊断和治疗非常重要。
增殖阻断蛋白1(block of proliferation 1,BOP1)基因由Pestov et al[3]于1998年从小鼠cDNA文库中克隆出的一种基因,其序列高度保守,位于人类8q24.3[4],属于WD40蛋白家族[3],与Pescadillo同源蛋白1(pescadillo homologue 1,PES1)和WD重复蛋白12(WD repeat domain 12,WDR12)形成稳定的复合物PeBow Complex,参与核糖体60S亚基的成熟过程。目前研究[4-7]发现,BOP1的异常表达与多种恶性肿瘤的发生、转移和侵袭有关。然而,BOP1与胃癌之间的相关性研究却鲜有报道。本实验以胃癌细胞BGC823作为模型,siRNA特异性结合BGC823细胞BOP1的mRNA并将其沉默,研究BOP1对胃癌细胞转移和侵袭能力的影响。实验检测了BOP1在人胃癌组织和细胞中的表达,并通过siRNA瞬时转染抑制BGC823细胞中BOP1的表达,探讨BOP1对胃癌细胞转移和侵袭能力的影响。
1 材料与方法
1.1材料
1.1.1病例资料 收集安徽医科大学第一附属医院2017年4月~2018年3月接受胃癌根治术的60例患者肿瘤组织和邻近的非肿瘤组织。所有标本都在液氮中快速冷冻并储存在-80 ℃冰箱中。每位患者均获得知情同意书,研究方案已获伦理委员会批准。手术前患者未接受过化疗、放疗或其他相关的抗肿瘤治疗。人正常胃黏膜上皮细胞GES1和胃癌细胞BGC823均购自美国模式培养物集存库(American type culture collection,ATCC)。
1.1.2主要试剂 转染试剂DharmaFECTTMTransfection Reagent购自美国Dharmacon;siRNA购自中国吉玛公司;TRIzol试剂购自美国Invitrogen公司;反转录试剂盒购自日本Takara公司;BCA蛋白浓度测定试剂盒购自上海碧云天生物技术研究所;Anti-BOP1抗体、兔抗人GAPDH购自美国Abcam公司;辣根酶标记山羊抗兔IgG购自北京中杉金桥生物技术有限公司;Transwell小室购自美国Corning公司;基质胶(Matrigel)购自美国BD Biosciences公司。
1.2方法
1.2.1细胞培养 胃黏膜上皮细胞GES1和胃癌细胞BGC823在10%胎牛血清(FBS)、1%青霉素和链霉素的RPMI-1640培养液中,37 ℃下在含有5% CO2的湿润培养箱中孵育,当这些细胞汇合80%~90%时进行传代培养。
1.2.2实时定量荧光PCR 采用TRIzol法提取组织和细胞总RNA,反转录试剂盒反转录为cDNA。PCR循环扩增,GAPDH作为内参照。BOP1上游引物:5′-GAGTATGCGGAGGACAGCTC-3′,下游引物:5′-TGCTCATCCGTCAGTCTCAG-3′;内参GAPDH上游引物:5′-GGACCTGACCTGCCGTCTAG-3′,下游引物:5′-GTAGCCCAGGATGCCCTTGA-3′。运用2-ΔΔCt法计算相对mRNA表达量。每次实验重复3次。
1.2.3Western blot 用含2%磷酸酶抑制剂混合物和1% PMSF的RIPA裂解液在冰上提取组织和细胞总蛋白。蛋白样品通过BCA法测定浓度并稀释至相同浓度。将各组蛋白质样品与蛋白上样缓冲液彻底混合后,将其在100 ℃下煮沸10 min以使蛋白质变性并加入到SDS-PAGE中进行电泳分离。浓缩分离后的蛋白移至PVDF膜上并用5%脱脂奶粉封闭1.5 h。 在 4 ℃孵育一抗过夜,并用TBST清洗后再室温孵育二抗(1 ∶2 000)1 h,TBST清洗4次(8 min/次)后显影印迹。应用自动凝胶成像系统采集图像。
1.2.4转染实验 收集对数生长期的BGC823细胞铺在6孔板中过夜。将5 μl siRNA和195 μl不含血清的培养基混合液与5 μl DharmaFECTTM 转染试剂和195 μl不含血清的培养基混合液各放置5 min后,再把这两份混合液混合孵育20 min后加入6孔板中。实验选用3条BOP1-siRNA分别为siRNA-1、siRNA-2和siRNA-3,用1条无任何靶基因的siRNA作为阴性对照(negative control,NC),用1条GAPDH-siRNA作为阳性对照(positive control,PC),不做任何处理作为空白对照(blank control,BC),实验共分为6组,具体基因序列见表1。转染48 h和72 h后,分别用Real-time PCR和Western blot法检验基因沉默效率。选择具有最高沉默效率的BOP1-siRNA用于划痕、Transwell小室迁移和侵袭实验。
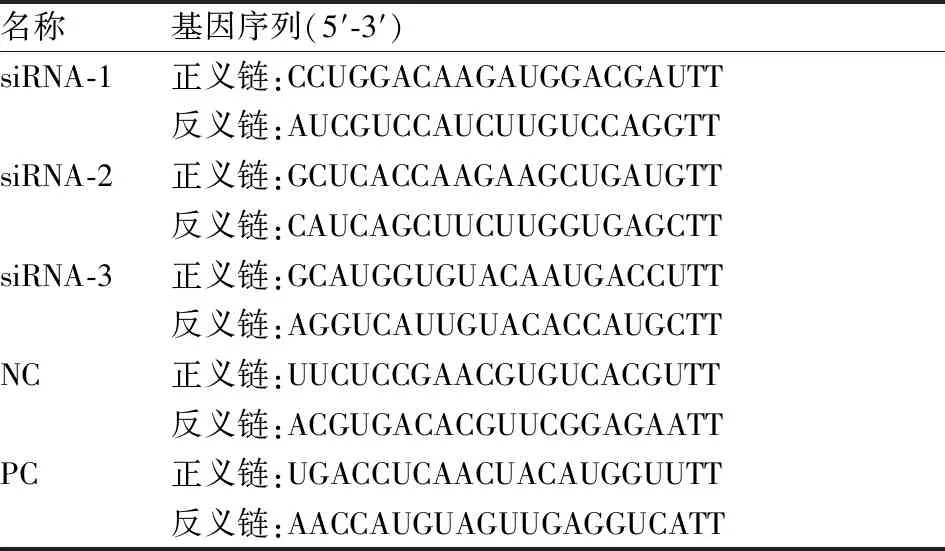
表1 小干扰RNA基因序列
1.2.5划痕实验 将细胞铺在6孔板上并生长至80%~90%融合换无血清培养基培养24 h后,使用P-200一次性吸头,将相同尺寸的划痕施加于细胞单层,并用PBS洗涤两次以除去细胞碎片。分别在0、24和48 h的划痕时间点观察和拍照以监测伤口愈合过程,并收集图像数据以分析实验结果。实验重复3次。
1.2.6Transwell迁移实验 收集细胞并用PBS洗涤两次。将600 μl含有15% FBS的RPMI-1640培养液加入Transwell的下室,并将200 μl细胞浓度为5×105个/ml的待测细胞加入到上室中。培养36 h后,用棉签去除上室中的基质胶,并用4%多聚甲醛溶液将黏附于Transwell小室膜下的表面细胞固定30 min。然后风干,再用0.1%结晶紫溶液染色15 min,求其平均值。实验重复3次。
1.2.7Transwell侵袭实验 将基质胶(Matrigel)和无血清培养基按1 ∶8稀释并混合,在Transwell细胞培养室中包被50 μl稀释的Matrigel。于37 ℃的培养箱中固化并放置一旁,其余的实验步骤同迁移实验。实验重复3次。

2 结果
2.1胃癌组织及邻近正常胃组织中BOP1的表达水平如图1所示,Real-time和Western blot检测胃癌组织及癌旁正常胃组织中BOP1 mRNA及蛋白的表达。GraphPad Prism 6分析显示,胃癌组织中BOP1 mRNA(t=2.990,P<0.05,图1A)及蛋白(t=4.900,P<0.01,图1B)的表达水平高于癌旁组织。
2.2BOP1在GES1及BGC823细胞中的表达水平与胃黏膜上皮细胞GES1相比,胃癌细胞BGC823中BOP1 mRNA和蛋白的表达水平分别为1.5倍和1.8倍。BOP1 mRNA(t=8.667,P<0.01,图2A)和蛋白(t=19.68,P<0.01,图2B)在胃癌细胞BGC823中的表达显著高于胃黏膜正常细胞GES1。见图2。
2.3siRNA靶向沉默BOP1基因的表达效果如图3所示,按照DharmaFECTTMTransfection Reagent说明书转染胃癌细胞BGC823,通过Real-time PCR和Western blot法检测BC组、si-NC组、si-GAPDH组、siRNA-1组、siRNA-2组和siRNA-3组mRNA和蛋白表达水平情况。检测结果显示:si-GAPDH组GAPDH mRNA和蛋白表达水平显著低于其他组。转染48 h后si-RNA组中BOP1的mRNA(F=2 484,P<0.01,图3A)及蛋白(F=1 533,P<0.01,图3B)表达水平低于BC组、si-NC组和si-GAPDH组,其中siRNA-2组最明显。选择具有最高沉默效率的siRNA用于后续伤口愈合、Transwell小室迁移和侵袭实验。
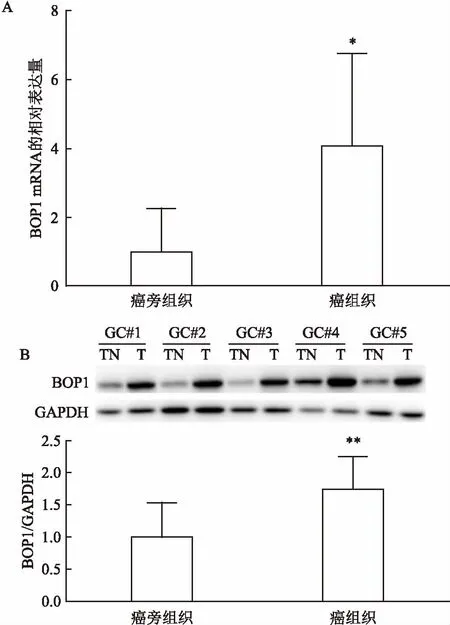
图1 胃癌组织和邻近正常胃癌旁组织中BOP1 mRNA和蛋白的表达水平
2.4沉默BOP1基因对细胞迁移的影响在胃癌细胞BGC823沉默后,进行伤口愈合实验。如图4所示,BC组、si-NC组、si-BOP1组细胞划痕愈合率在24 h的平均数分别为(39.63±5.84)%、(44.11±4.84)%、(18.66±2.98)%,在48 h的平均数分别为(70.60±3.94)%、(64.94±3.31)%、(26.34±3.40)%,si-BOP1组的细胞划痕愈合率在24 h 和48 h组明显低于BC组和si-NC组,表明划痕24 h 和48 h后 si-BOP1组的迁移能力与BC组和si-NC组相比明显降低(F=50.02,P<0.01;F=274.5,P<0.01)。
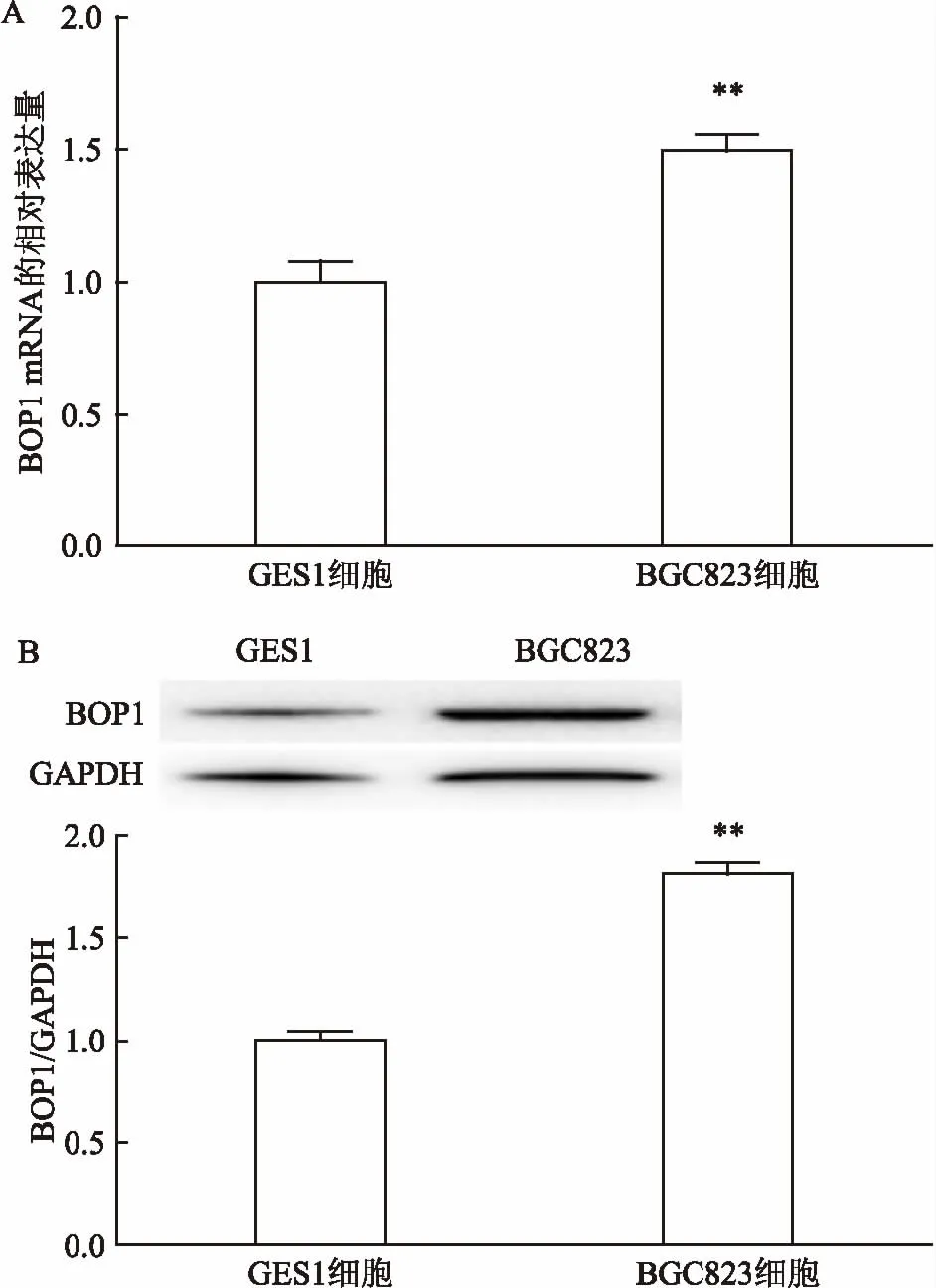
图2 GES1细胞和BGC823细胞中BOP1 mRNA和蛋白的表达水平
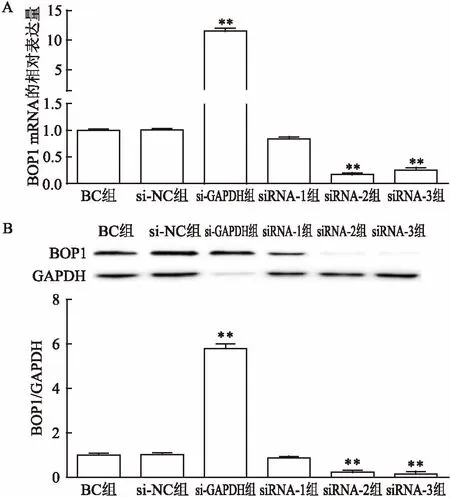
图3 转染前后各组BGC-823细胞中BOP1 mRNA和蛋白的表达水平
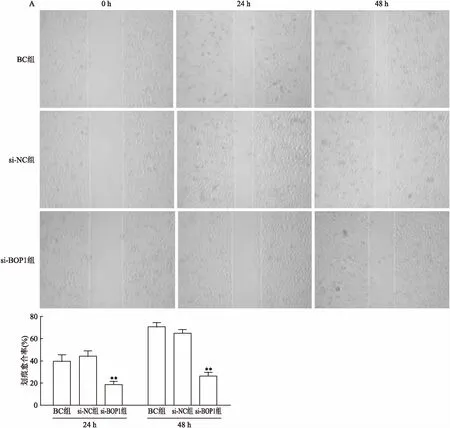
图4 沉默BOP1基因对BGC823细胞迁移的影响
2.5沉默BOP1基因对细胞迁移和侵袭的影响用沉默后的胃癌细胞BGC823做Transwell迁移实验,如图5所示,BC组、si-NC组、si-BOP1组穿透Transwell基底膜的细胞数的平均数分别为(573.50±23.05)、(555.80±32.12)、(88.83±28.52),si-BOP1组穿透Transwell基底膜的细胞数显著低于BC组和si-NC组,表明si-BOP1组的迁移能力与BC组和si-NC组相比明显降低(F=572.2,P<0.01)。
Transwell侵袭实验用于分析沉默胃癌细胞BGC823中穿过基底膜的细胞数量的差异。如图5所示,BC组、si-NC组、si-BOP1组细胞侵袭穿过小室底膜的细胞数的平均数分别为(604.30±29.53)、(618.00±41.96)、(115.80±27.18),BC组和si-NC组细胞侵袭穿过小室底膜的细胞数明显高于si-BOP1组的细胞数,表明si-BOP1组的侵袭能力与BC组和si-NC组相比明显降低(F=436.9,P<0.01)。
3 讨论
恶性肿瘤的侵袭和转移是一个复杂而持续的过程,涉及多种机制,其严重影响患者生命和治疗效果[8]。虽然手术治疗、化疗和放疗可以大大提高胃癌患者的生存率,但胃癌的早期症状并不典型,大多数患者在晚期被诊断为淋巴结/远处转移或复发[9]。因此,对于胃癌早期病变指标的探究和寻找胃癌细胞迁移和侵袭能力影响因素的研究尤为重要。
已有研究指出,BOP1在大肠癌[4-5]、肝细胞癌[6]和小鼠骨肉瘤模型中[7]过表达,与肿瘤的发生发展密切相关。BOP1基因位于8q24.3,而8q24位点与多种肿瘤关系密切[10-11]。BOP1又是核糖体RNA前体向成熟RNA转变的关键分子,而核糖体合成异常在肿瘤恶性转化和进展中发挥关键作用[12]。BOP1可促进结肠直肠癌[5]和肝癌[6]中肿瘤细胞的转移,与肿瘤细胞的迁移和侵袭密切相关。因此,本研究旨在探讨BOP1在胃癌中的表达和作用。
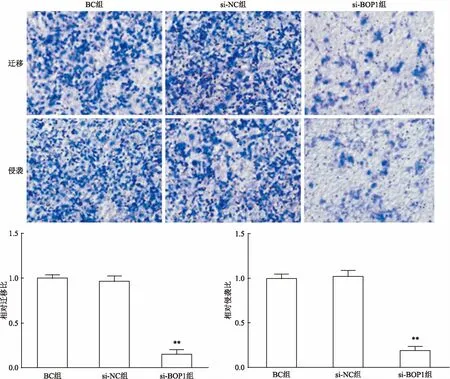
图5 BOP1沉默对BGC823细胞迁移和侵袭的影响 结晶紫染色×100
术后胃癌患者手术标本检测结果显示BOP1在胃癌组织中mRNA和蛋白的表达水平明显高于癌旁组织。siRNA是一种可以结合RNA诱导的沉默复合物(RISC)并用Argonaute 2( RISC的催化核心)解开siRNA双链,转录后沉默目的基因的小干扰RNA[13]。在本实验中,BGC823细胞中BOP1基因的表达被siRNA干扰;通过划痕24 h组和48 h组与对照组相比较的实验结果发现,BOP1沉默组BGC823细胞迁移能力显著下降,提示沉默BOP1基因具有抑制胃癌细胞BGC823迁移能力的功能;同时,Transwell迁移实验和侵袭实验显示BOP1沉默组的迁移和侵袭能力显著低于对照组。上述结果表明沉默BOP1基因显著降低了胃癌细胞BGC823迁移和侵袭的能力。提示BOP1可能在胃癌细胞的转移和侵袭中具有重要作用。上皮间质转化(epithelial-mesenchymal transition, EMT)是恶性肿瘤发生、转移和侵袭过程中的关键媒介,其与胃肠道恶性肿瘤的发生发展关系密切[14]。EMT是一个复杂的过程,需要细胞黏附和形态的广泛变化以及信号通路的激活。Chung et al[6]研究发现BOP1敲低的细胞中EMT的表型明显消退,而上皮标志物(E-钙粘蛋白,细胞角蛋白18和γ-连环蛋白)的上调和间充质标志物的下调提示BOP1可能是诱导EMT 的上游分子并激活RhoA鸟苷三磷酸酶(GTP酶)促进肿瘤细胞的迁移和侵袭。Qi et al[5]证明Wnt /β-连环蛋白靶基因BOP1等过表达可降低结肠直肠癌(CRC)EMT发生的细胞黏附分子E-钙粘蛋白(E-cadherin)的表达,促进CRC细胞的迁移。E-钙粘蛋白可以通过螯合β-连环蛋白(beta-catenin)与LEF(淋巴增强因子)/ TCF(T细胞因子)结合激活经典的Wnt/β-catenin信号通路[15]。提示BOP1可能激活经典的Wnt/β-catenin信号途径,降低细胞相关黏附分子的表达,从而促进肿瘤细胞的迁移和侵袭。

