矢车菊素-3-O-葡萄糖苷对H2O2诱导细胞氧化损伤的保护作用
,,, ,,
(吉林医药学院 基础医学院病原生物学教研室,吉林 132013)
当体内活性氧(reactive oxygen species,ROS)的产生超出机体自身的清除能力,会造成ROS大量累积,机体正常的氧化/还原平衡状态遭到破坏,导致蛋白质、脂质、核酸等生物大分子物质氧化损伤和功能紊乱,影响机体正常代谢过程,这一系列异常应激状态称为氧化应激。天然植物中抗氧化活性成分常被用作食品抗氧化剂,这类天然抗氧化剂能够协助机体抵抗ROS引起的氧化损伤,这一过程与调节抗氧化信号通路、激活Ⅱ相解毒酶以及上调内源性抗氧化物质有关[1]。研究表明,当细胞受到外源或内源氧化刺激时,产生的ROS会激活多条信号通路[2]。核转录相关因子2(Nrf2)是调控抗氧化应激相关通路的关键转录因子,正常生理状态下,Nrf2与Kelch样ECH相关蛋白1(Keap1)以二聚体的形式存在于细胞质中,当细胞处于氧化应激状态时,二者解离,Nrf2进入细胞核并与抗氧化反应元件(ARE)结合,参与某些细胞保护性蛋白的表达,如Ⅱ相解毒酶和抗氧化酶类,从而保护细胞对抗氧化应激损伤[3-4]。
花青素又名花色素、花色苷,是一类具有抗氧化活性的水溶性天然化合物,广泛存在于紫色和红色的水果与蔬菜中,具有重要的生理功能和良好的开发利用前景[5-6]。花青素因其良好抗氧化活性且含量丰富,常被用作功能食品原料。花青素的苷元、糖苷配体种类较多,目前已鉴定出自然界中的花青素有550余种,蔬菜和水果中的矢车菊素占50%[7,8]。矢车菊素-3-O-葡糖苷(Cyanidin-3-O-glucoside,C3G)是最普遍和研究最多的花青素之一,对预防人类多种慢性病具有潜在作用[9]。矢车菊素可通过多种途径清除自由基,并且其还原力及抗氧化能力优于其他花青素提取物。
本研究采用过氧化氢(H2O2)体外诱导人胚肾293(HEK-293)细胞损伤,建立HEK-293细胞氧化应激模型,基于细胞活力水平、ROS、丙二醛(MDA)水平考察C3G对细胞的保护作用,并探讨其可能作用机制。
1 材料与方法
1.1 材料与仪器
人胚肾(HEK-293)细胞 中国科学院上海生命科学研究院细胞资源中心;矢车菊素-3-O-葡糖苷(≥ 98%) 中国药品生物制品检定所;DCFH-DA荧光染料 美国Sigma公司;DMEM培养基、PBS缓冲液、FBS胎牛血清、非必需氨基酸、青霉素-链霉素 美国Gibco公司;MTS试剂盒、PCR试剂盒 美国Promega公司;反转录试剂盒和SYBR染料 日本Takara公司;MDA、SOD、CAT、GSH-Px试剂盒 南京建成生物工程研究所;抗体KEAP1、NFE2L2、GAPDH、二抗 武汉博士德生物工程有限公司。
Synergy HT多功能酶标仪 美国BioTek公司;MiniBIS Pro凝胶成像系统 以色列DNR公司;SDS-PAGE电泳仪、转膜仪、PCR仪 美国Bio-Rad公司;HF90二氧化碳培养箱 上海力申科学仪器有限公司;FV1000激光扫描共聚焦显微镜 日本Olympus公司。
1.2 实验方法
1.2.1 细胞培养 采用含有10% FBS,1%青霉素-链霉素和1%非必需氨基酸的DMEM培养基培养HEK-293细胞,细胞接种后在37 ℃、5%二氧化碳培养箱中培养24 h。
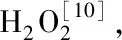
1.2.3 C3G对H2O2诱导损伤细胞活力的影响 试验设三个组(6个平行/组),分别为对照组、H2O2损伤组和C3G保护组。接种细胞悬液密度为6.0×104个/mL,80 μL/孔,培养24 h;保护组加10 μL 1.25、5、20 μmol/L的C3G(终浓度),对照组和损伤组补充10 μL DMEM培养基,培养12 h;损伤组和保护组加入H2O210 μL/孔(终浓度0.4 mmol/L),对照组补充10 μL DMEM培养基,孵育6 h后检测OD值,计算细胞活力[11]。
1.2.4 MTS法测定细胞活力 按1.2.2、1.2.3方法孵育完成的细胞置于96孔板中,每孔加入20 μL MTS[11],在37 ℃、5% CO2环境培养1 h,采用多功能酶标仪检测490 nm处的吸光度(OD)值。以对照组为100%,计算公式如下:
细胞活力(%)=(A损伤组-A空白组)/(A对照组-A空白组)×100
1.2.5 细胞ROS测定 试验分组同1.2.4(24孔板,3个平行/组),细胞接种密度为5.0×104个/孔,H2O2孵育结束后弃去培养基,清洗2次,加入含有10 μmol/L DCFH-DA的空白培养基37 ℃孵育20 min,PBS清洗3次后置于激光扫描共聚焦显微镜下收集荧光图像,酶标仪读取荧光值,激发/发射波长488/525 nm[12]。以对照组为1按如下公式计算相对ROS含量:
相对ROS含量=(F损伤组/保护组-F空白组)/(F对照组-F空白组)
1.2.6 细胞MDA水平测定 试验分组同1.2.4(3个平行/组),细胞以1.0×106个/孔的密度接种于6孔板,H2O2孵育结束后弃去培养基,各孔加入500 μL含有PMSF的裂解液冰浴裂解10 min,收集裂解液4 ℃下1000 r/min 离心5 min,收集上清液,根据试剂盒测定各组蛋白和MDA含量。
1.2.7 Western Blot法检测细胞Nrf2和Keap1的蛋白表达 细胞悬液接种密度5×106个/10 cm培养皿,接种体积8 mL/培养皿,分组与加样操作同1.2.4(加样体积1 mL),PBS稀释至2 mg/mL,加入loading buffer和DTT于沸水浴加热5 min,上样量20 μg/孔,12% SDS-PAGE胶电泳,然后将蛋白转至PVDF膜,5%脱脂奶粉室温封闭1 h;1∶1000比例稀释一抗,4 ℃孵育过夜,TBST清洗后以1∶4000比例稀释二抗,室温孵育1 h[11];TBST清洗后ECL显色,成像系统采集Nrf2,Keap1和GAPDH的蛋白图像,采用密度分析软件Image J对蛋白条带图像进行定量分析。
1.2.8 qRT-PCR法检测细胞Nrf2和Keap1的mRNA表达 Trizol提取总RNA,测定RNA和DNA含量,将RNA含量调整一致,试剂盒去除DNA,然后反转录成cDNA,进行基因扩增,反应条件[13]:95 ℃、3 min,95 ℃、15 s(40 cycles),51.6 ℃(Nrf2)或58 ℃(Keap1)、20 s,72 ℃、30 s;在NCBI上下载Nrf2、Keap1和GAPDH全序列,采用DNAMAN找出基因片段,Primer Premier 5设计引物,Nrf2引物序列(F:3′-GACTCTACCACTGTTCCCAA-5′,R:3′-CCATTC TTATTTCACCGACG-5′);Keap1引物序列(F:3′-TTCAAGCCGCAGTTGCTCA-5′,(R:3′-TTAGTCA CCAGCGGGACG-5′);GAPDH引物序列(F:3′-CCTTCTACCACTACCCTA-5′,R:3′-TTTGACAC CGCACTACC-5′)。
1.3 数据处理
结果以“平均值±标准差”表示;通过One Way ANOVA法进行统计学分析确定各组间的差异显著性,分析结果概率值小于0.05被认为差异显著,具有统计学意义(不同字母表示p<0.05);SPSS 21.0软件用于数据分析。
2 结果与分析
2.1 C3G对H2O2诱导损伤细胞活力的影响
HEK-293细胞是一种永生化的正常细胞,与癌细胞相比其具有更接近体内正常细胞的生理特性,能够真实反映氧化应激状态。H2O2是一种稳定的自由基来源,是建立氧化应激模型常用的诱导剂之一[14]。外源性H2O2可以穿过细胞膜,引起ROS的产生和积累,并结合细胞内金属离子,造成DNA和线粒体损伤,甚至导致细胞死亡[15]。如图1所示,0.4 mmol/L H2O2处理后细胞活力下降为53.8%±3.4%。与H2O2损伤组相比,1.25~20 μmol/L C3G保护组的细胞活力显著增加(p<0.05),分别提高到63.2%±2.5%、69.4%±3.8%、77.2%±5.1%。结果表明1.25~20 μmol/L C3G孵育后能明显提高氧化应激细胞活力,呈浓度依赖效应,C3G能抑制H2O2诱导的HEK-293细胞氧化损伤,对细胞有保护作用。相关研究表明,矢车菊素能抵抗过氧化氢自由基[16],Lee等[17]也通过H2O2诱导胰腺β-细胞氧化损伤,并且考察了C3G对氧化损伤细胞活力影响,结果表明C3G提高了损伤细胞的细胞活力,说明C3G对氧化应激诱导的胰腺β-细胞具有保护作用,这与本试验结果是一致的。
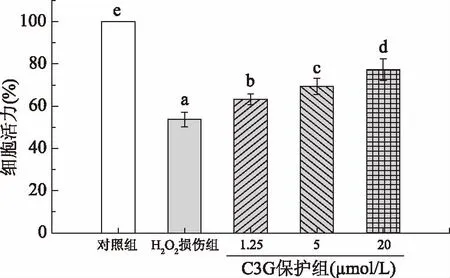
图1 C3G对HEK-293细胞的保护作用Fig.1 Protective effect of C3G on HEK-293 Cells注:图中标注的不同字母表示组间差异显著,p<0.05,图2~图5同。
2.2 C3G对HEK-293细胞ROS水平的影响
ROS如过氧化物、过氧化氢、羟基自由基等,能够损伤核酸、蛋白质、脂质以及其它生物大分子。细胞调控ROS水平的能力能够反映细胞所处的氧化还原状态,ROS产生和消除的不平衡导致ROS大量累积,是导致细胞氧化应激的一个重要因素。如图2A所示,对照组的绿色荧光强度较弱,说明对照组细胞内活性氧水平比较稳定,氧化还原处于平衡状态;而经H2O2诱导的氧化损伤组其荧光强度增强;与H2O2损伤组相比,不同浓度C3G预处理的细胞荧光强度逐渐减弱。由图2B可知,H2O2损伤组ROS相对量显著提高,增加到近2倍(p<0.05),经过C3G预处理的细胞ROS相对含量随浓度增大呈依赖性降低(p<0.05),但均高于对照组,可见C3G预处理可以显著抑制由H2O2引起的ROS产生和累积,但无法使细胞恢复到未损伤前的正常状态。相关研究表明花青素提取物能清除过量产生的ROS自由基,从而减轻由氨基甲酸乙酯诱导的HepG2细胞毒性作用[18]。本试验发现,C3G预处理H2O2诱导的氧化应激损伤细胞后,其ROS水平呈浓度依赖性降低,说明H2O2诱导后细胞内产生大量自由基,ROS大量累积,C3G预处理后ROS相对含量显著降低,这与Lee等[17]关于C3G能清除细胞内活性氧的试验结果是一致的,说明C3G可以通过抑制ROS产生和累积从而抑制HEK-293细胞氧化应激损伤。还有类似研究表明,C3G通过靶向ROS,减轻棕榈酸引起的内皮细胞功能紊乱,从而可以预防由氧化应激引起的几种疾病[19]。这些研究都说明了C3G抑制HEK-293细胞氧化应激损伤的部分作用机制是通过清除/抑制细胞ROS而实现的。

图2 C3G对HEK-293细胞ROS水平的影响Fig.2 Effects of C3G on the generation of ROS in HEK-293 cells.注:A:激光共聚焦显微镜采集的DCF荧光图像;B:由DCFH-DA荧光探针计算出的ROS相对含量。
2.3 C3G对HEK-293细胞MDA水平的影响
细胞的MDA水平可以用来评价脂质过氧化损伤情况。一些体外研究表明花青素发挥抗氧化作用不仅依赖于清除自由基,而且与激活和改善细胞内生抗氧化系统有关[20]。如图3所示,对照组MDA水平较低,约为(4.8±0.3) nmol/mg protein,说明正常细胞的氧化还原状态比较稳定,脂质过氧化程度很低,但H2O2处理后MDA水平显著提高到(16.6±1.0) nmol/mg protein(p<0.05),与此相比,不同浓度C3G预处理后细胞MDA水平显著降低(p<0.05),并随C3G浓度增大而呈浓度依赖性降低(13.6~8.7 nmol/mg protein)。有研究表明桑葚中提取的C3G能抑制脂质过氧化反应[17],同样的,本研究发现C3G预处理后细胞MDA水平呈浓度依赖性降低,说明C3G能显著降低过氧化氢自由基诱导的MDA升高,通过抑制细胞内脂质过氧化的产生和累积从而改善细胞氧化损伤。相关研究也同样证明了C3G能够通过降低MDA水平来保护细胞抗氧化应激[13,19,21]。
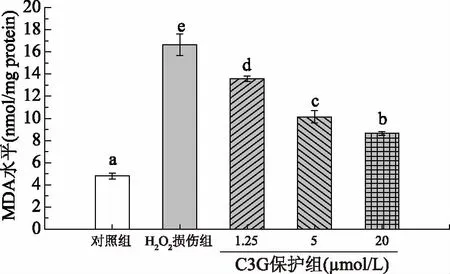
图3 C3G对HEK-293细胞丙二醛(MDA)水平的影响Fig.3 Effects of C3G on MDA level in HEK-293 Cells
2.4 C3G对HEK-293细胞Nrf2/Keap 1通路的调节作用
食物中的外源抗氧化物质能抑制或减轻ROS引起的氧化损伤,在维持体内的氧化还原平衡中发挥显著作用,目前,以信号通路为靶点的抗氧化应激研究是其机制研究中的热点。如图4A和4B所示,H2O2损伤组Nrf2的mRNA表达量大于对照组,但结果不显著(p>0.05),而蛋白表达量显著高于对照组(p<0.05);1.25~20 μmol/L C3G处理后,Nrf2的mRNA表达量显著增大(p<0.05),并且呈浓度依赖性升高,同样,蛋白表达量也呈现显著的浓度依赖性升高趋势。
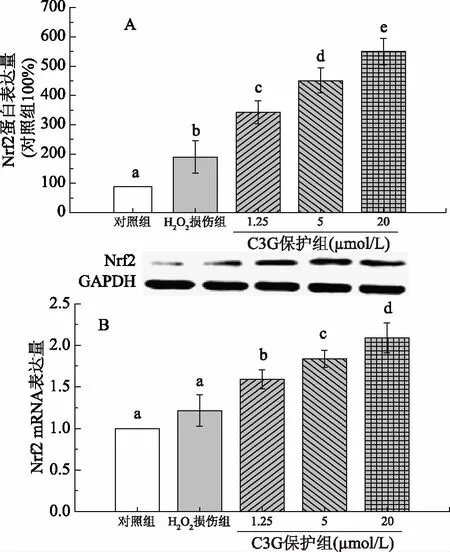
图4 C3G对HEK-293细胞Nrf2表达的影响Fig.4 Effects of C3G on protein and mRNA expressions of Nrf2 in HEK-293 Cells
如图5A和5B所示,与对照组相比,H2O2损伤组Keap1的mRNA表达量略有降低,结果并不显著(p>0.05),H2O2损伤组Keap1的蛋白表达量显著低于对照组(p<0.05);1.25 μmol/L C3G处理后,Keap1的mRNA表达量下调不明显,5和20 μmol/L C3G处理后,Keap1的mRNA表达量显著低于H2O2损伤组(p<0.05),1.25~20 μmol/L C3G预处理后Keap1蛋白表达量较对照组显著下调,但1.25与5 μmol/L组间的mRNA和蛋白表达量差异均不显著(p<0.05)。有研究表明某些多酚类化合物和黄酮类化合物也可能激活一些细胞内信号通路,如Nrf2通路,调节抗氧化酶的表达和活性,以延长细胞防御反应[22-24]。通过本试验发现,C3G呈浓度依赖性地上调HEK-293细胞中Nrf2的mRNA表达和蛋白表达,说明C3G可能是通过促进Nrf2表达从而提高抗氧化酶类的活力,进而抑制细胞氧化应激损伤。Speciale等[13]的体外试验同样表明,C3G能通过激活Nrf2通路来保护人体内皮细胞,从而激活抗氧化和解毒酶,对抗氧化应激。此外,本试验发现C3G可以浓度依赖性地下调Keap1的mRNA表达和蛋白表达,说明C3G可能通过下调Keap1表达促进Nrf2与Keap1解离,使更多释放的Nrf2进入细胞核与ARE结合启动抗氧化相关基因表达,从而抵抗H2O2诱导的氧化应激损伤。相关研究还表明,桑葚花青素提取物有助于恢复HepG2细胞的氧化还原状态,通过靶向MAPKs和Nrf2通路减轻过氧化氢诱导的细胞毒性[22],其部分作用机制与本试验结果是一致的。
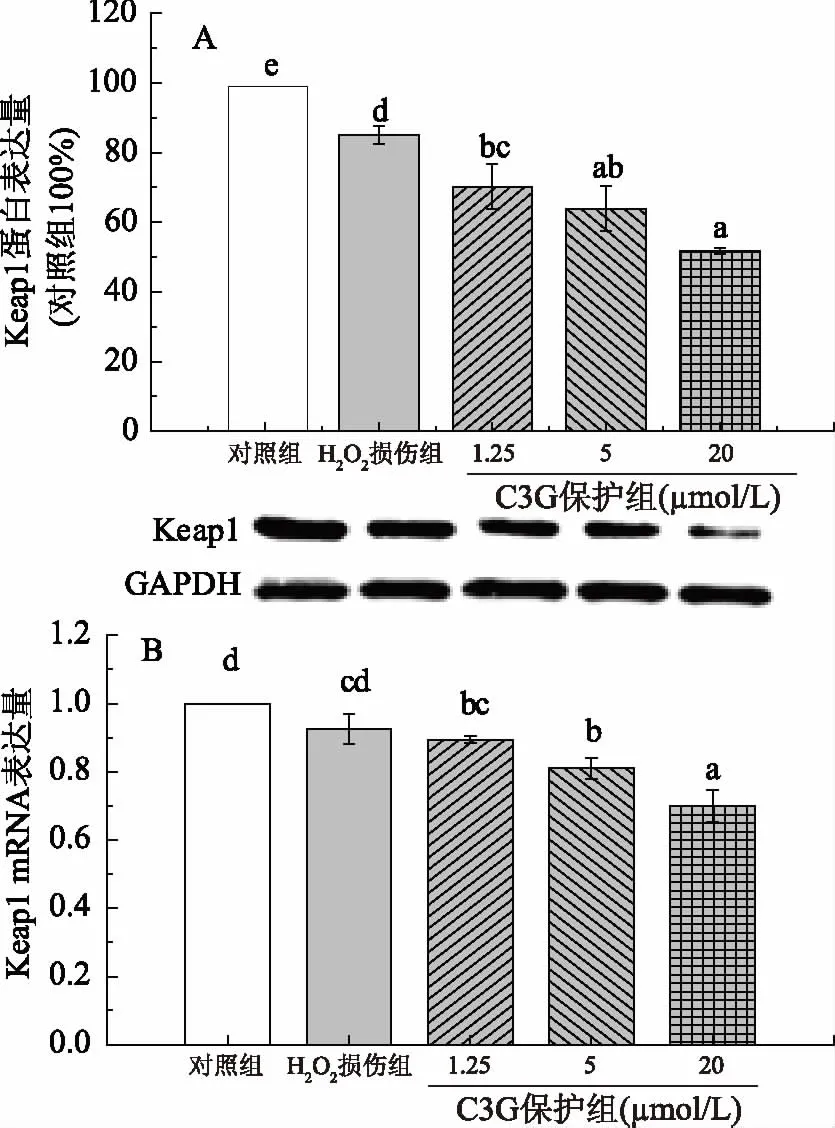
图5 C3G对HEK-293细胞Keap1表达的影响Fig.5 Effects of C3G on protein and mRNA expressions of Keap1 in HEK-293 Cells
3 结论
本研究结果表明,矢车菊素-3-O-葡萄糖苷具有细胞保护作用,并且其保护作用与促增殖无关,C3G可通过降低ROS和MDA水平抑制HEK-293细胞氧化损伤,其可能是通过激活Nrf2/Keap1信号通路、调节抗氧化相关基因实现的抗氧化应激作用。氧化应激是一个涉及多条信号通路及相关蛋白的复杂病理过程,所以除Nrf2/Keap1以外,是否还有其它通路参与了C3G抑制氧化应激过程还需进一步研究。本研究为C3G的抗氧化活性研究提供了一定参考,为植物源性食品的应用提供了一些理论依据。

