响应面优化羊肚菌多糖提取工艺及抗氧化性
,,,,
(山西大学生命科学学院,山西太原 030006)
羊肚菌(Morchellaesculenta)是一种野生真菌。口感脆嫩,美味可口,含有人体所需的必需氨基酸,受到国内外消费者的喜爱[1]。羊肚菌药用价值最早记录于《本草纲目》,主要用于治疗积食、咳嗽等症状[2]。现代研究表明,真菌多糖具有较好的生物活性[3],羊肚菌多糖更是因其具有抗疲劳[4]、抗肿瘤[5]、抗氧化[6]、抗菌活性[7]、抑制癌细胞增殖[8]等诸多作用成为研究热点。
目前,羊肚菌多糖的研究主要集中在菌丝体[9]与发酵液[10],对子实体研究较少。多糖提取工艺包括水提醇沉法[11]、酶法[12]、超声波萃取法[13]、超临界流体萃取法[14]、膜分离技术[15]等。明建[16]用水提醇沉提取羊肚菌多糖,最高得率为4.96%,用Sevag法脱蛋白,脱除次数多且多糖保留率低。Xu等[17]比较超声波法、微波法、超声波协同微波法三种方法对羊肚菌多糖得率的影响,超声波协同微波法效果最好,最高得率为7.53%,且超声波法优于微波法。晁红娟等[18]提出生物酶具有专一性、高效性、反应温和等优点,在毛竹提取过程中,添加纤维素酶,可以促进多糖溶出,提高得率。酶法提取羊肚菌多糖的研究还未见报道。
为提高羊肚菌多糖得率,进行抗氧化活性性质的研究,本实验以山西省安泽县[19]野生羊肚菌(Morchellaumbrina)子实体为原料,对常见的生物酶进行筛选,利用超声波辅助提取多糖,通过响应面法优化提取工艺,并对初步纯化后的多糖进行抗氧化能力研究,以期为羊肚菌在功能食品中的开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
野生羊肚菌子实体 山西省安泽县;纤维素酶(3 U/mg)、果胶酶(40 U/mg)、木瓜蛋白酶(6000 U/mg) Sigma公司;其它试剂均为分析纯。
JS30-230多功能搅拌机 浙江苏泊尔股份有限公司;AL204电子天平 梅特勒-托利多仪器有限公司;SB-5200DT超声波清洗仪 宁波生物科技股份有限公司;SHB-III循环水式真空泵 郑州长城科工贸有限公司;HRHS24电热恒温水浴锅 青岛海尔医用低温科技有限公司;SP-2000UV型紫外分光光度计 上海光谱仪器有限公司;SC-3614离心机 安徽中科中佳科学仪器有限公司。
1.2 实验方法
1.2.1 野生羊肚菌子实体多糖的提取工艺流程 羊肚菌子实体→干燥(40 ℃、6 h)→粉碎过80目筛(羊肚菌粉末)→酶解→超声波提取→灭酶(95 ℃、15 min)→离心(4500 r/min、15 min)→取上清液→浓缩→4倍体积无水乙醇醇沉过夜[20]→离心(4500 r/min、15 min)→沉淀溶解(蒸馏水)→定容→多糖脱蛋白→多糖脱色素→粗多糖。
1.2.2 不同酶的选取 取4份1.00 g羊肚菌粉末,1、2、3组分别加入0.01 g纤维素酶、果胶酶、木瓜蛋白酶,第4组不添加酶作为对照。相同条件下提取,比较不同酶对羊肚菌多糖得率的影响。
1.2.3 羊肚菌多糖的测定
1.2.3.1 标准曲线的制备 苯酚-硫酸法[21]测定多糖含量,葡萄糖(0.1 mg/mL)作为标准品,吸光度A为横坐标,浓度C为纵坐标,得标准曲线方程:C=0.0733A-0.0014,R2=0.9944。
1.2.3.2 样品多糖含量的测定 提取的多糖按照1.2.3.1的方法测定吸光度,得率计算见式(1)
W(%)=(C×V×N×10-3/M)×100
式(1)
式中:W为多糖得率,%;C为多糖浓度,mg/mL;V为定容体积,mL;N为稀释倍数;M为样品质量,g。
1.2.4 酶解条件的优化
1.2.4.1 单因素实验 准确称取1.00 g羊肚菌粉末,固定酶解温度50 ℃、超声功率200 W、超声温度50 ℃,固定酶用量0.8%,酶解pH4.0,酶解时间60 min,超声时间30 min,料液比20∶1 mL/g,考察不同羊肚菌粉末与水的液料比(10∶1、15∶1、20∶1、25∶1、30∶1 mL/g)、酶用量(0.2%、0.4%、0.6%、0.8%、1.0%)、酶解pH(3.2、3.6、4.0、4.4、4.8)、酶解时间(20、40、60、80、100 min)和超声时间(10、20、30、40、50 min)对羊肚菌多糖得率的影响。
1.2.4.2 Plackett-Burman实验 Plackett-Burman 试验设计在单因素实验基础上,以多糖得率为响应值,从多个影响因素中筛选出影响多糖得率显著的因素[22-24]。实验因素及水平取值见表1。

表1 Plackett-Burman 实验因素及水平Table 1 Factors and levels of Plackett-Burman experiment
1.2.4.3 响应面试验设计 根据Plackett-Burman实验结果,选取液料比、酶解pH、酶解时间3个因素设计响应面,对多糖提取条件进行优化。实验因素及水平编码如表2所示。

表2 响应面设计的因素和水平Table 2 The factors and levels of response surface design
1.2.5 羊肚菌多糖脱蛋白
1.2.5.1 蛋白含量的测定 考马斯亮蓝法测蛋白含量[23],以吸光度A为横坐标,牛血清白蛋白浓度C为纵坐标,得标准曲线方程C=0.146A-0.0103,R2=0.9901。
1.2.5.2 脱蛋白方法选择
a:TCA法:取一定量多糖溶液,加入等体积的TCA溶液,振荡10 min,4 ℃下静置30 min,4500 r/min离心15 min,测定上清液蛋白含量、多糖含量。
b:酶法:取一定量多糖溶液,加入2%木瓜蛋白酶,50 ℃酶解30 min,灭酶,冷却,4500 r/min离心15 min,取上清液测定蛋白含量、多糖含量。
c:酶+TCA法:酶法脱蛋白后取上清液,再通过TCA法脱蛋白,取上清液测定蛋白含量、多糖含量。

式(2)
蛋白脱除率(%)=(脱蛋白前蛋白含量-脱蛋白后蛋白含量)×100/脱蛋白前蛋白含量
式(3)
1.2.6 羊肚菌多糖脱色方法的确定
1.2.6.1 脱色过程指标检测 多糖溶液脱色前为橙黄色,根据互补色原理[24],选择450 nm波长处测定吸光度。
1.2.6.2 脱色方法选择
a:H2O2法:参考文献[25]并有所改进:取10 mL多糖溶液,用氨水调节pH7.0,加入0.5 mL 30% H2O2溶液,45 ℃下脱色至颜色不变,测定吸光度,计算脱色率、多糖保留率。
b:活性炭法:取10 mL多糖溶液,加入1 g活性炭,恒温振荡2 h,过滤,取滤液测定吸光度,计算脱色率、多糖保留率。
c:AB-8大孔吸附树脂法[26]:选用静态吸附法,将10 g预处理树脂放入200 ml的三角瓶,加10 mL多糖溶液,恒温振荡2 h,振荡结束后,取滤液测定吸光度,计算脱色率、多糖保留率。
脱色率(%)=(脱色前吸光度值-脱色后吸光度值)×100/脱色前吸光度值
式(4)

式(5)
1.2.7 抗氧化能力的测定 分别选择由0、0.2、0.4、0.6、0.8、1.0 mg/mL的羊肚菌多糖及VC进行抗氧化实验。
1.2.7.1 DPPH自由基清除能力 参考Ma等[27]的方法并加以改动,吸取2 mL多糖溶液,加入2 mL 0.2 mmol/L DPPH溶液,混匀,暗处反应30 min,517 nm处测定吸光度。对照组用无水乙醇代替DPPH,空白组用蒸馏水代替多糖溶液。VC作为阳性对照。DPPH自由基清除率计算见公式(6)。
式(6)
1.2.7.2 羟自由基清除能力 向试管中加入1.00 mL 9 mmol/L FeSO4、1.00 mL 9 mmol/L水杨酸-乙醇溶液,分别加入1 mL多糖溶液、1 mL 8.8 mmol/L H2O2,在室温下反应30 min,510 nm波长处测定其吸光度,对照组用蒸馏水代替水杨酸,空白组用蒸馏组代替多糖溶液[28]。VC作为阳性对照。羟自由基清除率计算见公式(7)。
式(7)
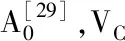
式(8)
1.3 数据统计分析
采用Excel 作图,Minitab 17软件设计Plackett-Burman实验,利用Design-Expert 8.0.6软件进行响应面设计及优化分析。
2 结果与分析
2.1 不同酶处理羊肚菌多糖得率
由图1可知,同等提取条件下,加酶可以提高多糖得率,纤维素酶组多糖得率为6.85%,这是因为纤维素酶可以有效地破坏细胞壁[30],使多糖溶出。果胶酶组、木瓜蛋白酶组比空白组高,但得率低于纤维素酶组,所以本实验选用纤维素酶酶解。
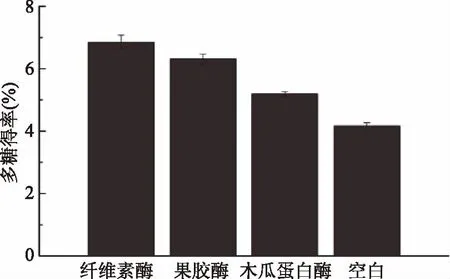
图1 不同酶对羊肚菌多糖得率的影响Fig.1 Effects of the different enzymes on the yield of polysaccharides
2.2 单因素实验结果
2.2.1 液料比对多糖得率的影响 如图2所示,多糖得率随着液料比的增加而先增加后降低。液料比为20∶1 mL/g时,多糖得率最高。这可能是因为液料比较小时,多糖与其它物质结合紧密,不能充分溶出[31];液料比超过20∶1 mL/g,多糖得率降低,这可能是大量的提取剂不利于提取体系的传热和传质[32]。因此选择20∶1 mL/g为最佳液料比。
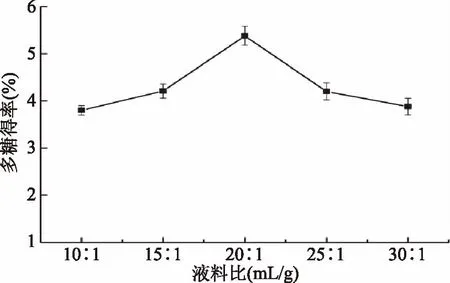
图2 液料比对羊肚菌多糖得率的影响Fig.2 Effects of liquid-solid ratio on yield of polysaccharides
2.2.2 酶用量对多糖得率的影响 如图3所示,当酶用量从0.2%增至0.8%时,多糖得率增加。酶用量达到0.8%时,多糖得率为4.82%,这可能是因为增大酶浓度增加,酶与底物充分接触,溶解出大量多糖。酶用量大于0.8%,多糖得率有所下降,可能是多糖发生降解[33]。综合考虑,酶用量应选择0.8%。
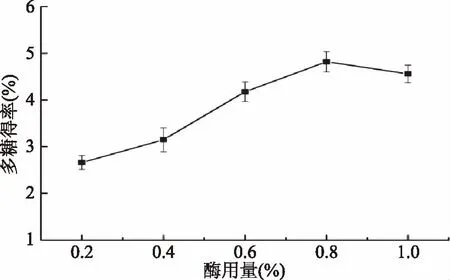
图3 酶用量对羊肚菌多糖得率的影响Fig.3 Effects of enzyme dosage on yield of polysaccharides
2.2.3 酶解时间对多糖得率的影响 酶解时间是影响多糖得率的重要因素,如图4所示,随酶解时间的增加,多糖得率先增加后降低。酶解时间太短,酶与底物不能充分反应,多糖溶出少,而酶解时间过长可能会导致多糖结构被破坏,多糖得率降低。因此选择60 min为最佳酶解时间。
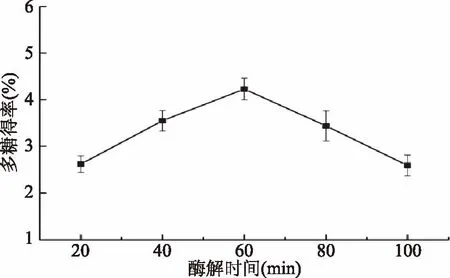
图4 酶解时间对羊肚菌多糖得率的影响Fig.4 Effect of enzymatic hydrolysis time on yield of polysaccharides
2.2.4 酶解pH对多糖得率的影响 由于不同的酶有不同的最适pH范围,调节提取液pH会影响酶的活性[34]。如图5所示,多糖得率随pH的增加先升高后下降,pH为4.0时,多糖得率达到最大值6.74%。在pH3.6~4.4范围内纤维素酶具有较强的活力,可加速羊肚菌细胞壁中纤维素的降解,使多糖溶出、得率增加。因此选择4.0为最适酶解pH。
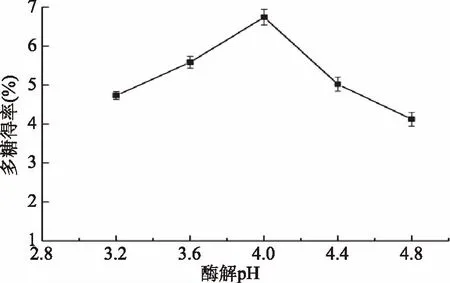
图5 酶解pH对羊肚菌多糖得率的影响Fig.5 Effect of enzymatic hydrolysis pH on yield of polysaccharides
2.2.5 超声时间对多糖得率的影响 如图6所示,超声时间小于20 min,羊肚菌多糖得率随着超声时间的延长而增加。超声时间大于20 min 时,多糖得率下降。超声波处理时间与多糖提取过程密切相关,处理时间短,多糖不能充分溶出;时间太长,导致多糖降解[35]。因此,选择20 min为最佳超声时间。
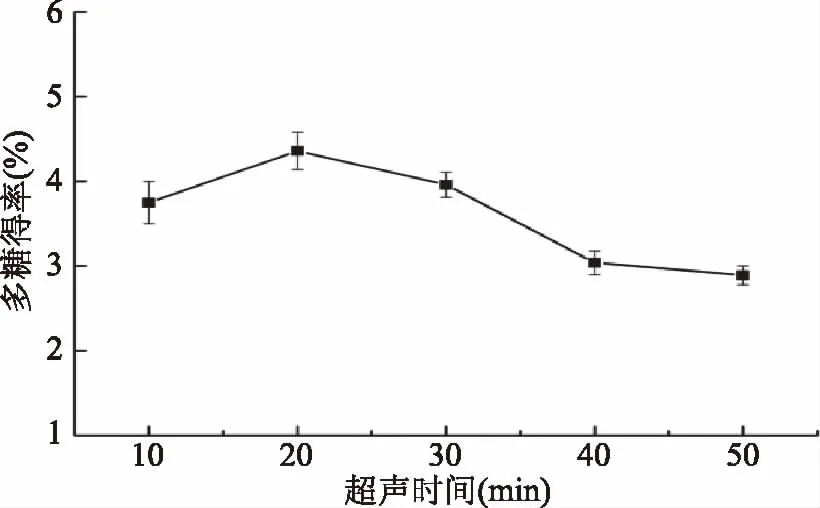
图6 超声时间对羊肚菌多糖得率的影响Fig.6 Effect of ultrasonic time on yield of polysaccharides
2.3 Plackett-Burman试验
本实验选用n=12的PB试验设计模块,对液料比(X1)、酶用量(X2)、酶解时间(X3)、酶解pH(X4)、超声时间(X5)5个因素进行评价,实验设计及结果见表3,显著性检验结果见表4。由表4可见,酶解pH、超声时间两个因素影响显著(p<0.05),料液比影响极显著(p<0.01),故选取影响大的三个因素进行响应面优化,酶用量与酶解时间选取单因素实验最优水平,即酶用量0.8%、酶解时间60 min。
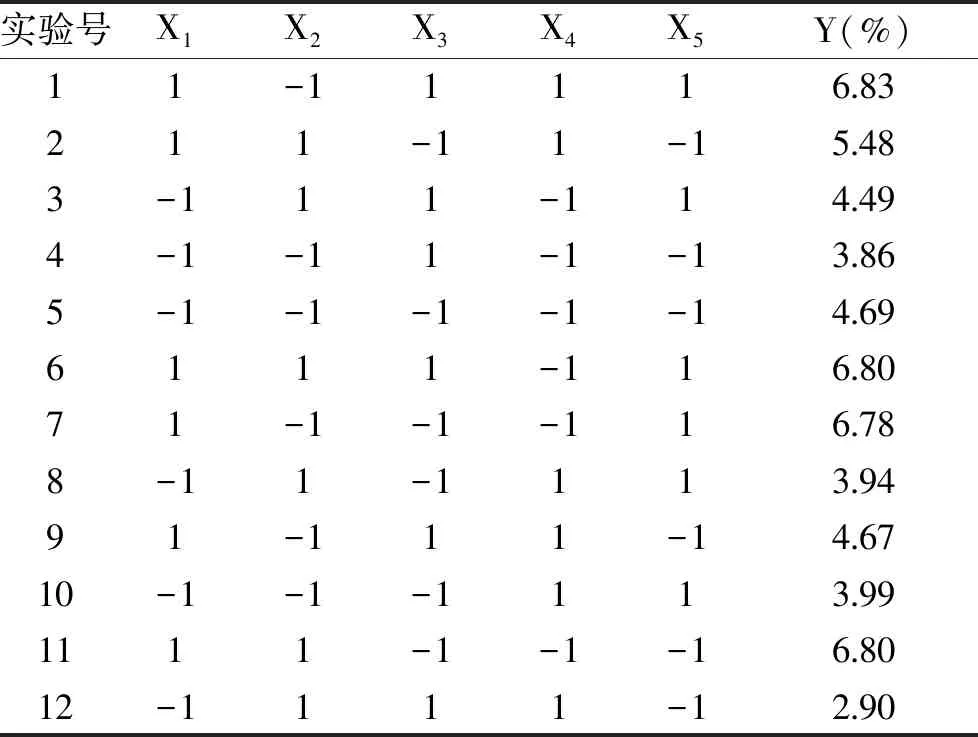
表3 Plackett-Burman试验设计及结果Table 3 Plackett-Burman experimental design and the results

表4 Plackett-Burman试验统计分析Table 4 Statistical analysis of the Plaekett-Burman experimental results
2.4 响应面优化提取羊肚菌多糖工艺
2.4.1 Box-Behnken试验设计及结果 根据单因素和PB试验结果,选取液料比(A)、酶解pH(B)和超声时间(C)为自变量,以多糖得率(Y)为响应值,利用Design-Expert 8.0.6软件进行响应面设计,试验设计方案及结果见表5。
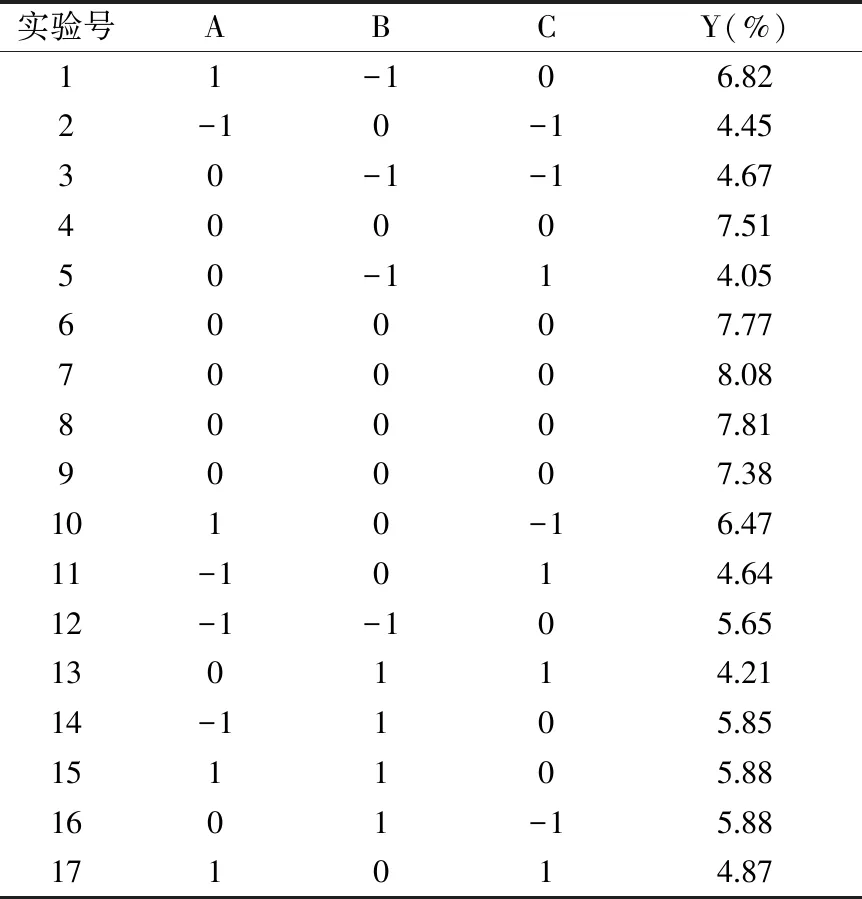
表5 响应面试验设计及结果Table 5 Design and results of response surface
2.4.2 回归模型的建立及方差分析 对表5试验结果进行多元回归拟合,得二次多项式回归模型:Y(%)=7.71+0.43A+0.079B-0.46C-0.29AB-0.45AC-0.26BC-0.63A2-1.03B2-1.97C2。回归模型方差分析结果见表6。回归模型极显著(p<0.01),失拟项不显著(p>0.05);回归方程总决定系数R2=0.9746,表明该模型对实验拟合度较好,可用该模型对实验结果进行预测。影响得率的主次因素为超声时间>液料比>酶解pH。
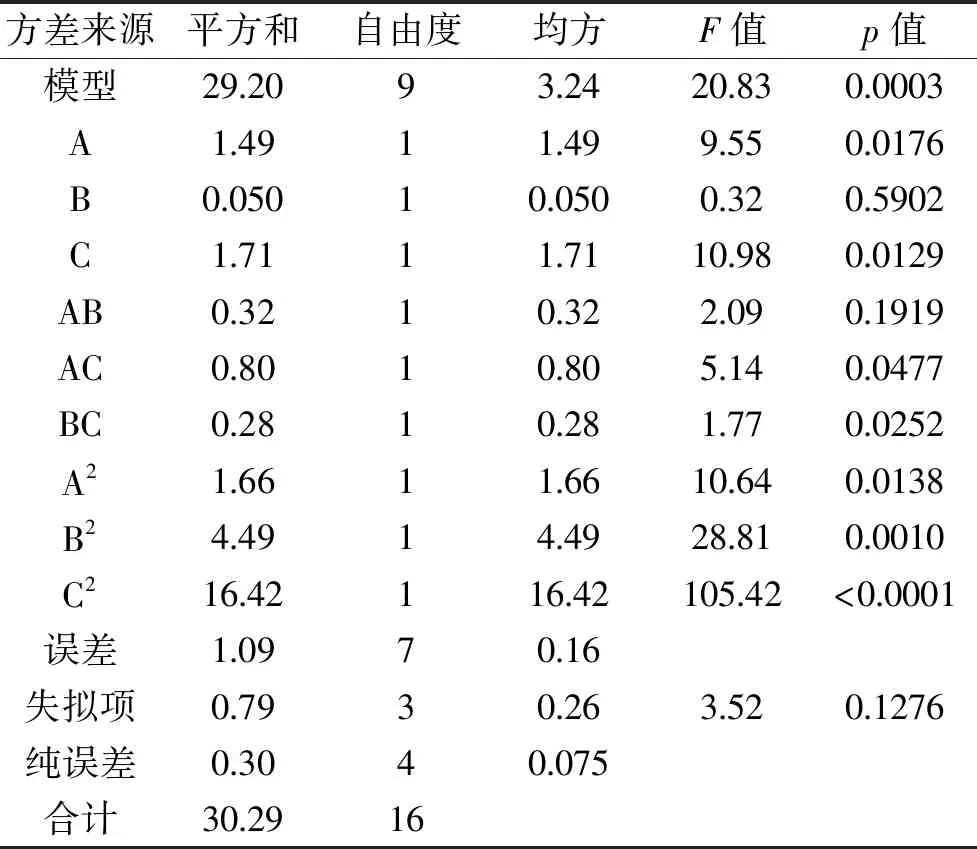
表6 回归模型的方差分析及回归系数的显著性检验Table 6 Variance analysis of regression model and significance test of regression coefficient
2.4.3 响应面的曲面分析 图7直观地给出了各因素交互作用的响应面分析图和等高线分析图。响应面的坡度越大说明该因素对多糖得率影响越强,椭圆形的等高线图说明两因素之间交互作用显著,圆形说明交互作用不显著[36]。由图7可以看出在实验因素水平范围内,存在羊肚菌多糖的最大得率。由图7a可知,酶解pH3.6~4.4、液料比15∶1~25∶1 mL/g范围内,多糖得率先增大后减小。pH4.0、液料比20∶1 mL/g附近值对羊肚菌多糖得率有重要影响。由图7b可以看出,液料比15∶1~25∶1 mL/g、超声时间10~30 min,多糖得率先增大后减小。由图7c可得,酶解pH3.6~4.4、超声时间10~30 min时,多糖得率先增大后减小,pH4.0、超声时间20 min附近值多糖得率最大。
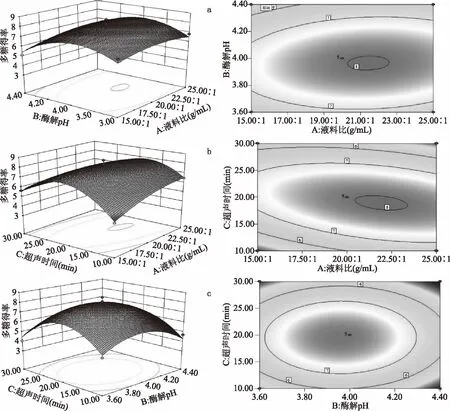
图7 各因素对羊肚菌多糖得率影响的响应面图和等高线图Fig.7 Response surface and contour plots for the effects of cross interactions among factors on extraction rate of polysaccharides注:a:液料比与酶解pH;b:液料比与超声时间;c:超声时间与酶解pH。
2.4.4 确定最优工艺和回归模型的验证实验 通过对回归模型的分析,可以确定羊肚菌多糖提取的最佳条件为:液料比21.84∶1 mL/g、酶解pH3.97、超声时间18.96 min、此时羊肚菌多糖得率为7.83%。为方便操作,将羊肚菌多糖的提取条件修正为:液料比22∶1 mL/g、酶解pH4.0、超声时间19 min。经实验验证,羊肚菌多糖得率为7.79%,该工艺优化效果显著。
2.5 羊肚菌多糖脱蛋白结果
从图8可以看出,TCA法蛋白脱除率为77.27%,多糖保留率为72.62%;虽然酶法脱蛋白,多糖保留率高,但蛋白脱除率低;而TCA法+酶法蛋白脱除率高,多糖保留率低于TCA法[37]。综合考虑,选用TCA法脱蛋白。
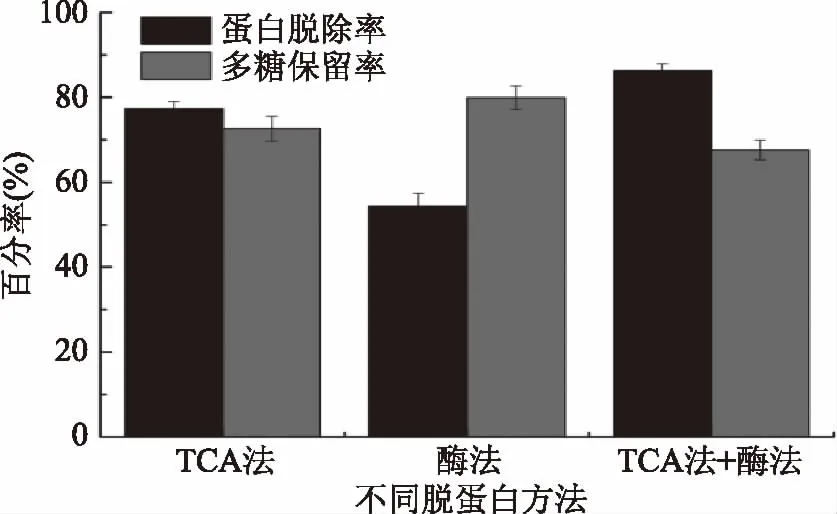
图8 脱蛋白方法对多糖的影响Fig.8 Effects of deproteinization methods on protein removal rate and polysaccharides retention rate
2.6 羊肚菌多糖脱色结果
图9可以看出,活性炭脱色率最低,且杂质不易去除;H2O2法脱色率虽高于活性炭法,但由于其强氧化性,使多糖结构遭到破坏,使多糖保留率最低。AB-8大孔树脂吸附法脱色率84.25%,多糖保留率为95.71%,且不会破坏多糖的生物活性[38]。因此,选用AB-8大孔树脂吸附法对多糖溶液脱色。
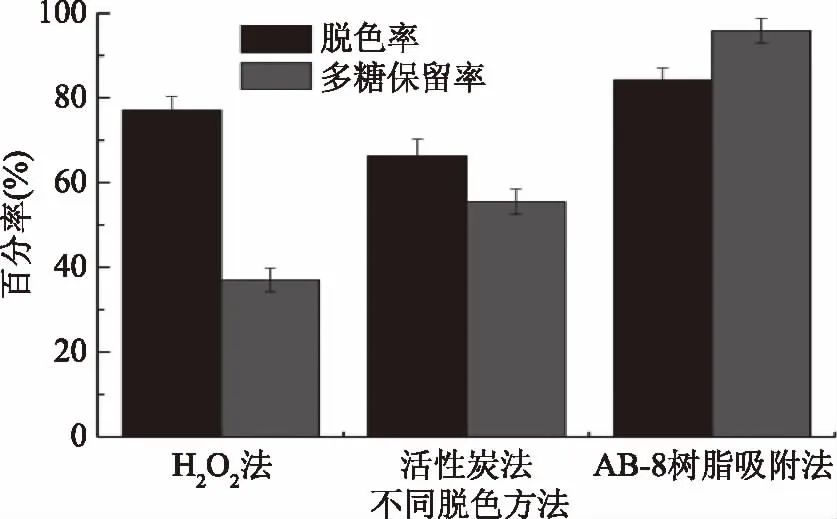
图9 脱色方法对多糖的影响Fig.9 Effects of decolorization methods on decoloraization rate and polysaccharides retention rate
2.7 羊肚菌多糖的抗氧化活性
2.7.1 DPPH自由基清除能力测定结果 从图10可知,羊肚菌多糖和VC清除DPPH自由基的能力随浓度的增加而增强。浓度从0.2 mg/mL增加到1.0 mg/mL,DPPH自由基的清除率从14.61%增加至60.67%;VC的清除率从65.06%增加至94.23%。付立红等[39]从羊肚菌发酵液中提取多糖,当质量浓度为1.30 mg/mL时,对DPPH自由基的清除率为53.22%。综上表明,羊肚菌多糖可以有效地清除DPPH自由基,但效果低于VC。
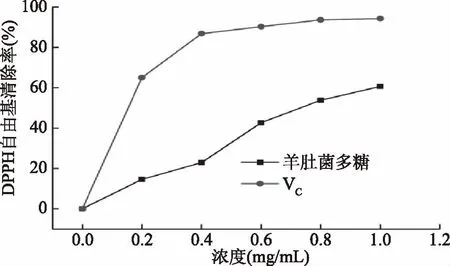
图10 羊肚菌多糖和VC对DPPH自由基的清除能力Fig.10 DPPH free radical scavenging abilities of Morchella esculenta polysaccharides and VC
2.7.2 羟自由基清除能力测定结果 由图11可知,在0~1 mg/mL浓度范围内,羊肚菌多糖与VC对羟自由基的清除能力呈上升趋势,质量浓度为0.2 mg/mL,羊肚菌多糖与VC对羟自由基的清除率分别为34.29%、57.61%;当质量浓度达到1 mg/mL 时,对羟自由基的清除能力分别为70.77%、93.76%。黄俊丽等[40]从松茸里提取多糖,质量浓度为1 mg/mL 时,对羟自由基的清除率仅为59.00%。结果表明,羊肚菌多糖清除羟自由基的能力良好。
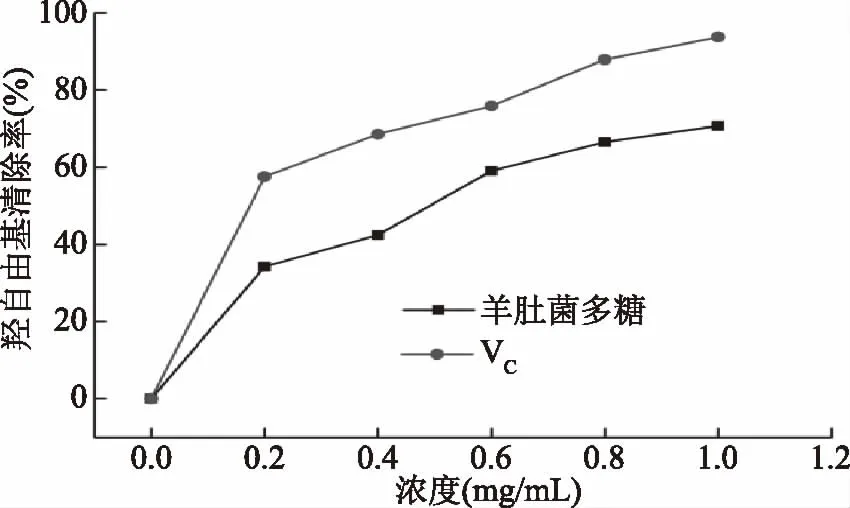
图11 羊肚菌多糖和VC对羟自由基的清除能力Fig.11 Hydroxyl free radical scavenging abilities of Morchella esculenta polysaccharides and VC
2.7.3 超氧阴离子自由基清除能力结果 超氧阴离子自由基是弱氧化剂,本身对身体无害。但是它与羟基分子结合可能会破坏DNA和其他生物分子[41]。由图12可知,羊肚菌多糖与VC对超氧阴离子的清除速度呈现先增加后趋于稳定趋势,浓度在0~0.6 mg/mL的范围内,清除速率变化较快,当浓度大于0.6 mg/mL时,清除率变化缓慢。当浓度为1 mg/mL时,羊肚菌多糖对超氧阴离子的清除率为72.76%。结果表明羊肚菌多糖具有显著的超氧阴离子自由基清除活性(p<0.05)。
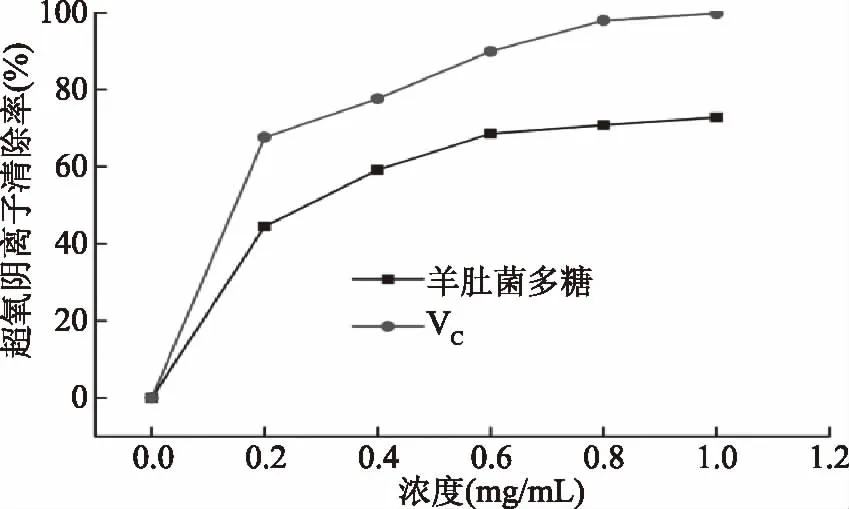
图12 羊肚菌多糖和VC对超氧阴离子的清除能力Fig.12 Superoxide radical scavenging abilities of Morchella esculenta polysaccharides and VC
3 结论
通过单因素实验、Plackett-Burman实验设计以及响应面实验,确定野生羊肚菌子实体多糖提取的最佳工艺参数:液料比22∶1 (mL/g)、酶解pH4.0、酶解时间60 min、超声时间19 min、酶用量0.8%,在此条件下多糖平均得率为7.79%,优化结果比传统热水提取法最佳条件下多糖得率提高了57%,提取时间缩短2/3[16]。采用TCA法可以有效的去除羊肚菌粗多糖中的蛋白质,并保持较高的多糖保留率;AB-8大孔树脂吸附法脱除多糖色素,效果显著,且不会破坏多糖结构[42],是脱色素的有效方法。抗氧化实验结果表明,羊肚菌多糖对DPPH自由基、羟自由基、超氧阴离子自由基均有良好的清除作用。羊肚菌多糖是一种具有利用价值与开发前途的保健品,本实验为羊肚菌子实体的进一步研究利用提供理论依据。

