甜茶苷和甜茶多酚同时提取工艺优化
,,,,*
(1.湖南中医药大学药学院,湖南长沙 410128;2.湖南农业大学理学院,湖南长沙 410128;3.湖南农业大学,兽用中药资源与中兽药创新国家地方联合工程研究中心,湖南长沙 410128)
随着科学技术及社会的发展,人民生活水平不断提高,生活品质不断改善,食品结构发生了显著变化。高热量食品特别是糖类物质的过量摄入引起的肥胖症、糖尿病、龋齿、高血压等疾病已成为一大社会问题,使得人们对新型甜味剂的开发越来越重视。广西甜茶(RubussuavissmusS.Lee)是蔷薇科悬钩子属的一种有刺灌木,含有一种无毒、高糖度、低热能的甜味物质——甜茶苷(Rubusoside),又称甜叶悬钩子苷、甜茶素[1-2]。甜茶苷甜度是蔗糖的300倍,具有降血糖[3]、降血脂[4]、防龋齿[5]等多种功效,在饮料、医药、糖果、护肤品等领域具有广阔的应用前景[6]。此外,甜茶叶中还存在含量较高的多酚类物质[7]。甜茶多酚是高效的抗氧化剂[8],还具有抗过敏[9]、抗菌抗病毒[10]、提高免疫力[11]等多种作用。
目前文献报道的甜茶中活性成分的提取方法主要有有机溶剂提取法、超声提取法、微波提取法和酶解法等[12-15],甜茶中有效成分的提取研究已相对成熟,但多以提取单一成分或一类成分为主,关于甜茶中多种活性成分的同时提取工艺鲜有报道。
本文从资源的综合利用、降低生产成本和适合规模工业生产的角度,选择以水为溶剂同时提取甜茶苷和甜茶多酚,在单因素的基础上,利用响应面法对甜茶苷和甜茶多酚的同时提取工艺进行优化,得到广西甜茶中甜茶苷和甜茶多酚的提取最佳工艺参数,为广西甜茶的开发和综合利用提供理论依据和技术参考。
1 材料与方法
1.1 材料与仪器
广西甜茶干叶 由长沙世唯生物科技有限公司提供;甜茶苷标准品(HPLC>98%) 北京嘉世玉和化工技术研究院;没食子酸标准品(≥98%)、福林酚试剂 上海源叶生物科技有限公司;乙腈(色谱纯) 德国Merck公司;蒸馏水 实验室自制;其余试剂 均为分析纯。
Agilent 1260液相色谱仪 美国安捷伦科技公司;UVmini-1240型紫外可见分光光度计 日本岛津公司;AUW220D型分析天平 日本岛津公司;PL203电子天平 梅特勒-托利多仪器(上海)有限公司;YB-1500A型高速多功能粉碎机 永康市速锋工贸有限公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;KQ5200DE型数控超声波清洗器 昆明市超声仪器有限公司。
1.2 实验方法
1.2.1 甜茶水提液的制备 将甜茶干叶粉碎,过30目筛,称取5 g于250 mL锥形瓶中,加入一定量蒸馏水,置于磁力搅拌器中(100 r/min)于一定温度下搅拌,提取一定时间后,抽滤,收集甜茶水提液。
1.2.2 测定方法
1.2.2.1 甜茶苷的HPLC测定方法 a.色谱条件:选择乙腈-水作为流动相,利用仪器的二极管阵列全波长紫外扫描功能进行扫描后得到的最大吸收值为205 nm,因此选择205 nm为检测波长。检测器:Aglient 1260;色谱柱:Ultimate XB-C18(4.6×250 mm,5 μm);柱温:30 ℃;色谱乙腈和水的体积比为33∶67;流速:1.0 mL/min;检测波长:205 nm;进样量:10 μL。
b.标准溶液配制:精密称取干燥恒重的甜茶苷5 mg,加适量蒸馏水溶解,转移至5 mL容量瓶中,加水稀释至刻度,摇匀,配成浓度为1 mg/mL的甜茶苷标准溶液,4 ℃冰箱保存备用。准确移取甜茶苷标准溶液0.2、0.4、0.6、0.8、1 mL,分别用蒸馏水定容至10 mL容量瓶中,得到浓度为0.02、0.04、0.06、0.08、0.1 mg/mL系列标准溶液,按上述色谱条件测定。以甜茶苷浓度(X)为横坐标,峰面积(Y)为纵坐标绘制标准曲线。
c.含量测定:移取1 mL甜茶苷水提液于25 mL容量瓶中,蒸馏水定容,摇匀。按上述色谱条件进行分析。由标准曲线得到待测液中甜茶苷的质量浓度,并按公式(1)计算甜茶苷提取率。
式(1)
式中:X为待测溶液中甜茶苷浓度(mg/mL);V为样品溶液总体积(mL);N为稀释倍数;M为所取甜茶干粉中甜茶苷的总量(mg)。
1.2.2.2 甜茶多酚的测定方法 a.标准溶液配制:精密称取干燥恒重的没食子酸标准品5 mg,加适量蒸馏水溶解后定容至25 mL容量瓶中,再准确吸取5 mL,加蒸馏水稀释至25 mL,摇匀,配成浓度为0.04 mg/mL的没食子酸标准溶液,备用。准确移取没食子酸标准溶液1、2、3、4、5 mL于25 mL棕色容量瓶中,加入1 mol/L Folin-Ciocalteu试剂2 mL和15% Na2CO3溶液7.5 mL,以蒸馏水定容至刻度,配制成1.6×10-3、3.2×10-3、4.8×10-3、6.4×10-3、8.0×10-3mg/mL系列标准溶液,30 ℃下静置1 h,在波长770 nm处测定吸光度。以甜茶多酚浓度(x)为横坐标,峰面积(y)为纵坐标绘制标准曲线。
b.含量测定:精确吸取甜茶多酚水提液1 mL于25 mL棕色容量瓶中,加入1 mol/L Folin-Ciocalteu试剂2 mL和15% Na2CO3溶液7.5 mL,以蒸馏水稀释至刻度,30 ℃下静置1 h。测定到显色,在波长770 nm处测定吸光度。根据标准曲线计算出甜茶多酚浓度,按公式(2)计算水提液中甜茶多酚提取率。
式(2)
式中:c为水提液中甜茶多酚浓度(ug/mL);v为样品溶液总体积(mL);n为稀释倍数;m为所取甜茶干粉中总多酚的总量(mg)。
1.2.3 甜茶叶中甜茶苷及甜茶多酚的总量的检测 精密称取3份5 g甜茶(30目筛)粉末于250 mL锥形瓶中,加入130 mL蒸馏水,超声提取(水浴温度30 ℃,功率180 W)45 min,提取3次,抽滤得滤液,将滤液合并,按1.2.2测定方法检测滤液中的甜茶苷和甜茶多酚的总量[16]。
1.2.4 甜茶水提单因素实验 甜茶干叶粉(30目),选择液料比为30∶1 mL/g,提取时间为30 min,考察提取温度(10、30、50、70、90 ℃)对甜茶苷和甜茶总多酚提取率的影响;选择提取温度为70 ℃,提取时间为30 min,考察料液比(10∶1、15∶1、20∶1、25∶1、30∶1 mL/g)对甜茶苷和甜茶总多酚提取率的影响。选择液料比为30∶1 mL/g,提取温度为70 ℃考察提取时间(10、20、30、40、50 min)对甜茶苷和甜茶总多酚提取率的影响。
1.2.5 响应面优化实验 以提取温度(A)、液料比(B)和时间(C)为考察因素,以甜茶苷提取率和甜茶多酚提取率为响应值,根据Box-Behnken的设计原理,采用Design-Expert 8.0.6软件分别设计3水平的响应面优化实验。实验的水平编码值见表1、表2。

表1 甜茶苷的响应面实验因素及水平Table 1 Levels and factors used in response surface methodology of rubusoside
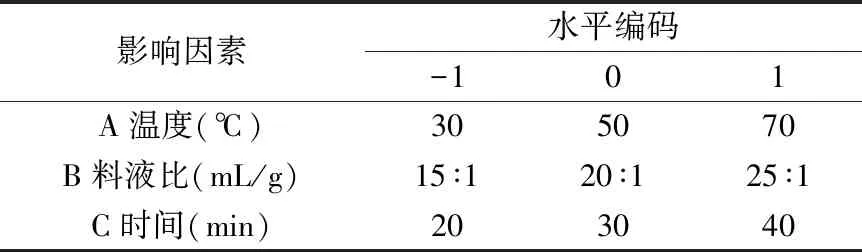
表2 甜茶总多酚的响应面实验因素及水平Table 2 Levels and factors used in response surface methodology of total polyphenols in sweet tea
1.3 数据处理
所有实验数据均为平行三次后取平均值,采用Origin 8.5软件和Design-Expert 8.0.6软件进行实验设计与统计分析。
2 结果与分析
2.1 标准曲线的建立
2.1.1 甜茶苷的标准曲线 采用高效液相色谱法检测水提液中甜茶苷的含量[17],获得甜茶苷标准曲线方程,见公式(3)。
Y=5137.5X+27.01
式(3)
式中:X为甜茶苷质量浓度(mg/mL);Y为所对应的峰面积。相关系数R2=0.999,说明甜茶苷的浓度在0.02~0.1 mg/mL范围内,甜茶苷浓度与峰面积呈良好的线性关系。
2.1.2 甜茶多酚的标准曲线 采用Folin-Ciocalteu比色法测定水提液中甜茶多酚的含量[18]。获得甜茶多酚的标准曲线方程,见公式(4)。
y=0.0999x+0.0952
式(4)
式中:x为多酚质量浓度(以没食子酸计)(mg/mL);y为对应的吸光度;相关系数R2=0.997,说明甜茶多酚的浓度在1.6×10-3~8.0×10-3mg/mL范围内,甜茶多酚浓度与吸光度有良好的线性关系。
2.2 甜茶叶中甜茶苷及甜茶多酚的总量
按照1.2.3提取方法,当提取次数为3次时,甜茶粉末中甜茶苷和甜茶多酚已提取完全,测量5 g甜茶粉末中甜茶苷的总量M为207.5 mg(RSD=0.72%,n=3),甜茶多酚总量m为518.13 mg(RSD=1.23%,n=3)。
2.3 单因素对甜茶苷及多酚提取效果的影响
2.3.1 提取温度对甜茶苷和甜茶多酚提取率的影响 由图1可知,在温度低于70 ℃时,甜茶苷的提取率随温度的升高明显增加;当温度达到70 ℃时,甜茶苷的提取率趋于稳定。因此,选择用70 ℃提取甜茶苷。甜茶多酚的提取率在10~50 ℃时急剧上升,之后下降并趋于平稳。可能原因是在低温范围内随着温度的升高,甜茶多酚在水中的扩散加快;当温度过高时,酚类物质易被氧化,导致多酚提取率反而减少[19]。因此,选择50 ℃为甜茶多酚的提取温度。
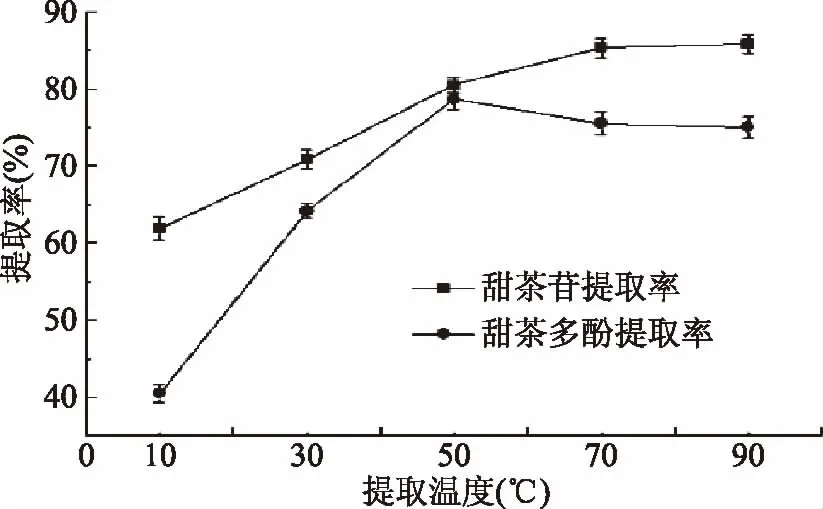
图1 提取温度对甜茶苷和甜茶多酚提取率的影响Fig.1 Effects of extraction temperature on the extraction rate of rubusoside and polyphenols in sweet tea
2.3.2 液料比对甜茶苷和甜茶多酚提取率的影响 由图2可知,在液料比低于25∶1 mL/g时,甜茶苷提取率随着料液比的增加明显增加;当液料比 25∶1 mL/g时,甜茶苷的提取率已达到30∶1 mL/g时的98.8%,即继续增加提取溶剂对甜茶苷的溶出影响不大。从节约生产成本的角度考虑,本文选择液料比为25∶1 mL/g提取甜茶苷。甜茶多酚的提取率随料液比的增大而增加,特别是液料比20∶1 mL/g以下,甜茶多酚提取率随料液比的增大而增加明显;当液料比超过20∶1 mL/g时,甜茶多酚提取率已达30∶1 mL/g时的95.8%,继续增加溶液多酚的溶出的效果不再明显[20];因此,选择20∶1 mL/g为提取甜茶多酚的料液比。
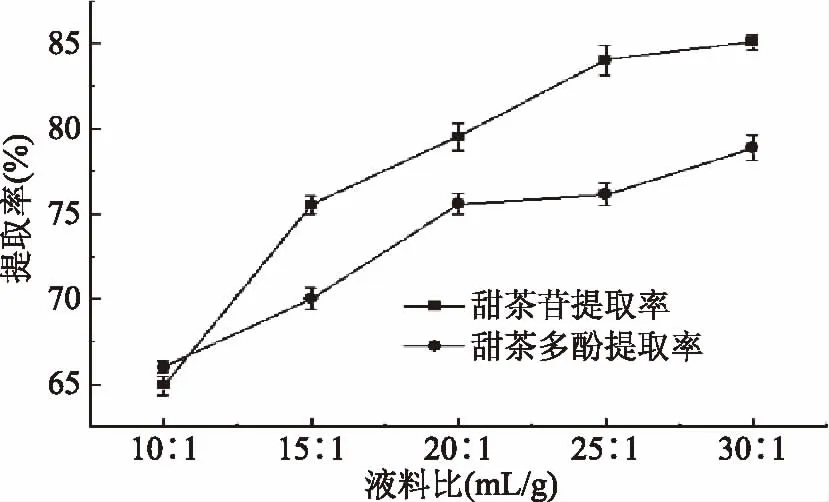
图2 料液比对甜茶苷和甜茶多酚提取率的影响Fig.2 Effects of liquid-material ratio on the extraction rate of rubusoside and polyphenols in sweet tea
2.3.3 提取时间对甜茶苷和总多酚提取率的影响 由图3可知,随着提取时间的增加,甜茶苷的提取率逐渐提高,特别是30 min以下,甜茶苷提取率增加明显。而当提取时间超过30 min时,甜茶苷提取率的曲线变化不明显,这是由于此时甜茶苷已被大部分溶出,继续增加溶液甜茶苷的溶出的效果不再明显。因此,选择30 min为甜茶苷的提取时间。在提取温度为50 ℃时,提取时间30 min以内,水提液中甜茶多酚显著增加(p<0.05);当提取时间超过30 min后,甜茶多酚的提取率反而逐渐降低。这是由于甜茶粉末中的酚类物质在30 min时就已提取完全,随着提取时间的增加,酚类物质受光热等条件的影响被氧化分解,导致结构改变进而含量降低[21],因此选择30 min为甜茶多酚的提取时间。
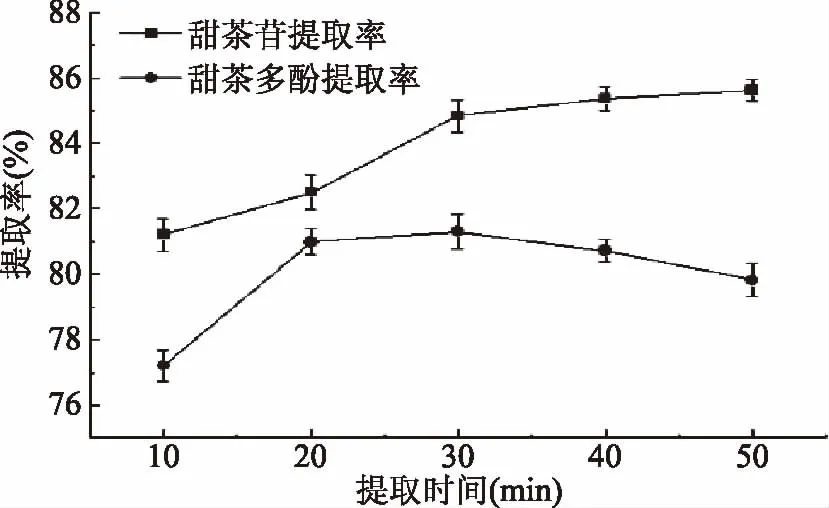
图3 提取时间对甜茶苷和甜茶多酚提取率的影响Fig.3 Effects of extraction time on the extraction rate of rubusoside and polyphenols in sweet tea
2.4 响应面优化甜茶提取工艺
2.4.1 甜茶苷的响应面优化实验结果与分析 响应面实验设计方案及结果见表3。应用Design-Expert.8.0.6软件对所得的实验数据进行方差分析,得到回归模型方差分析结果,见表4;同时拟合得到的二次回归方程为:甜茶苷提取率(%)=88.72+1.42A+2.95B+0.87C-1.19AB-0.26AC-0.36BC-7.13A2-6.03B2-5.21C2。
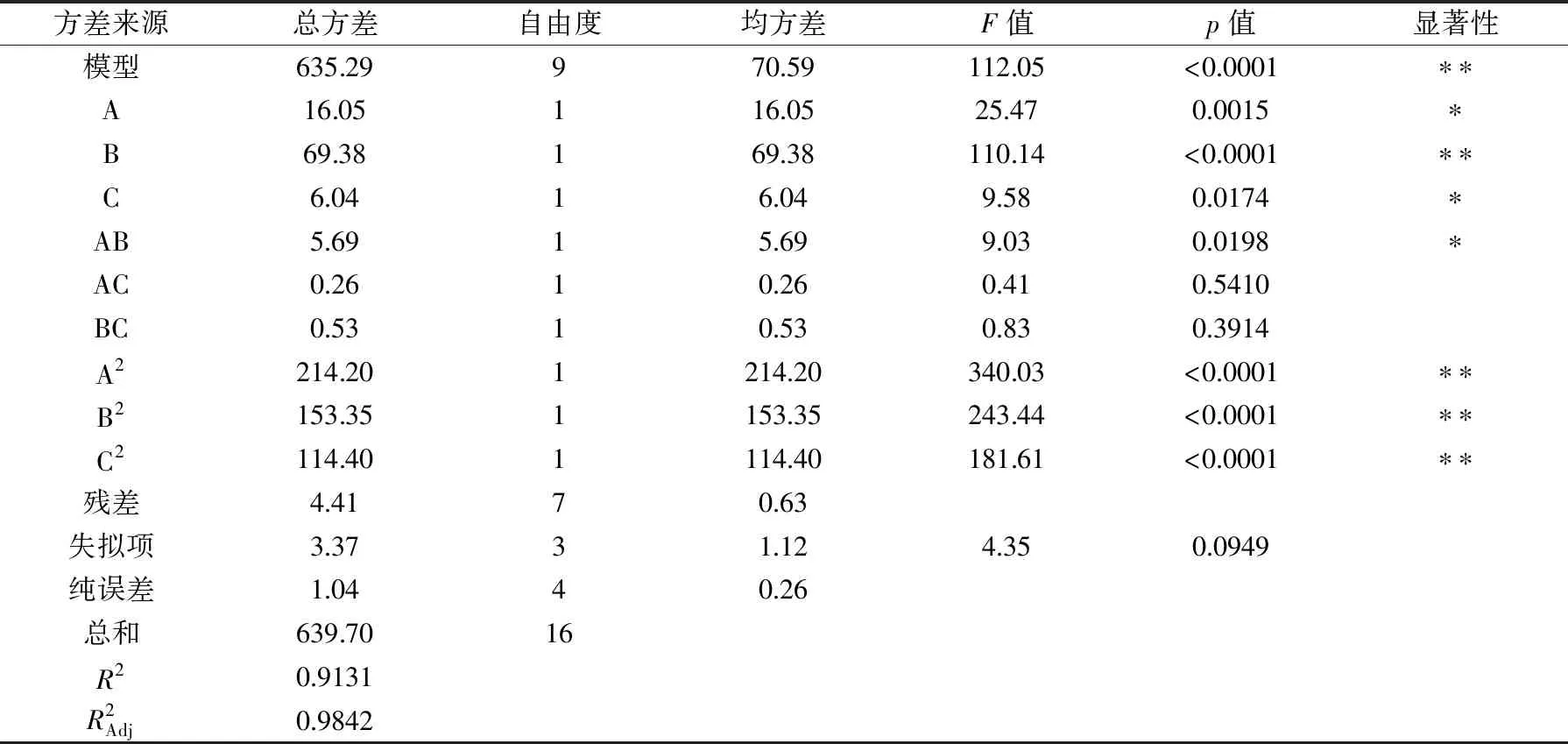
表4 水提甜茶苷的回归模型方差分析Table 4 Analysis of variance of regression model for the extraction of rubusoside
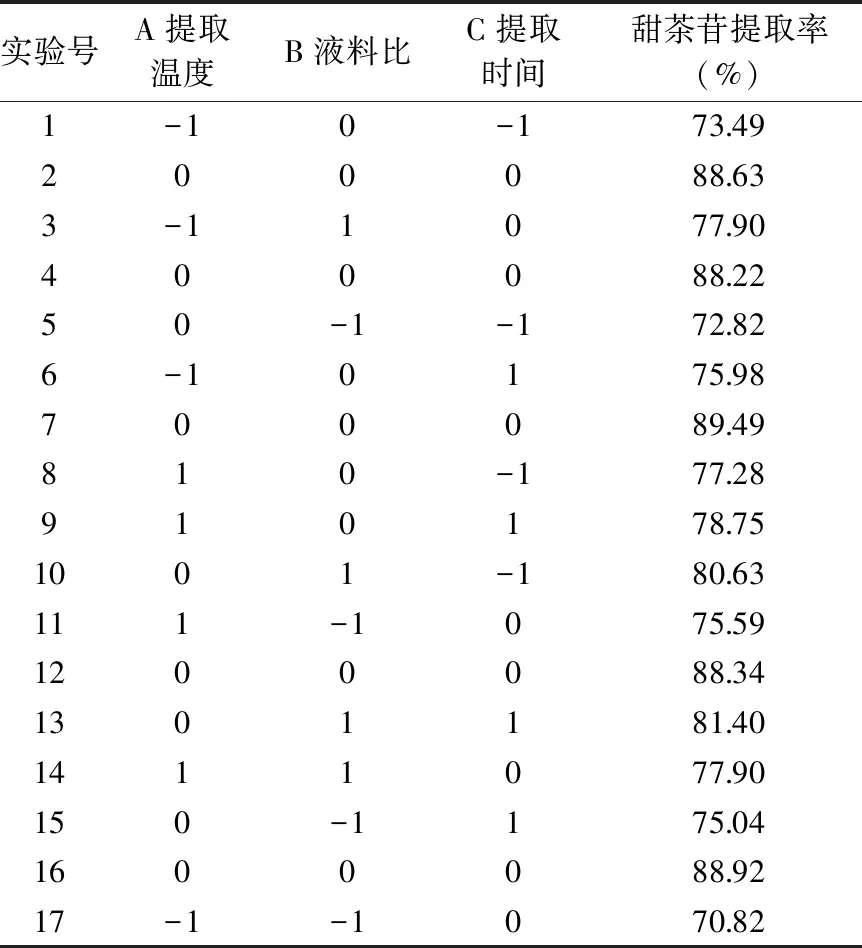
表3 提取甜茶苷响应面实验设计方案与结果Table 3 Experimental design and results for response surface analysis for the extraction of rubusoside
根据回归模型作出两因素交互作用的响应曲面图和等高线图,可以直观的考察因素之间的交互作用对甜茶苷提取率的影响,结果如图4所示。
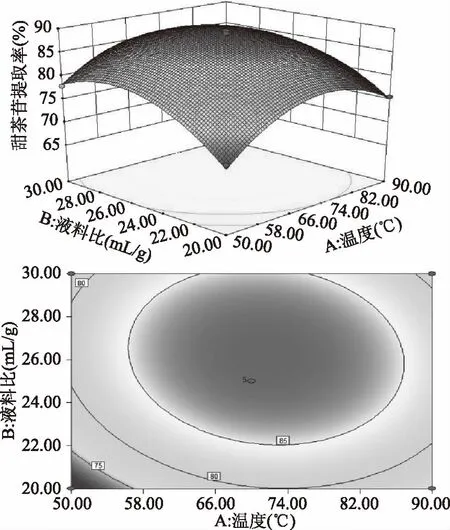
图4 提取温度和液料比对甜茶苷提取率影响的响应面及等高线图Fig.4 Response surface and contour plot showing the interactive effects of temperature and liquid-material ratio on the extraction of rubusoside
响应曲面坡度的陡峭程度反映各因素对响应值的影响程度,等高线的密集形状反映各因素交互作用的显著程度。由图4可知,液料比与提取温度的响应面坡度均陡峭,说明液料比与提取温度对甜茶苷的提取率的影响均显著(p<0.05),液料比的响应面曲线坡度与提取温度相比略陡,表明液料比对甜茶苷提取率的影响高于提取温度;等高线呈椭圆形,表明液料比与提取温度的交互作用显著,上述结论与p值结果一致。
2.4.2 甜茶多酚的响应面优化结果及方差分析 响应面实验设计方案及结果见表5。应用Design-Expert.8.0.6软件对所得的实验数据进行方差分析,得到回归模型方差分析结果见表6;同时拟合得到的二次回归方程为:甜茶多酚提取率(%)=78.26+1.67A+5.21B+0.57C+1.07AB+0.77AC+0.15BC-5.20A2-0.047B2+0.60C2。

表6 水提甜茶多酚的回归模型方差分析Table 6 Analysis of variance of regression model for the extraction of polyphenols in sweet tea
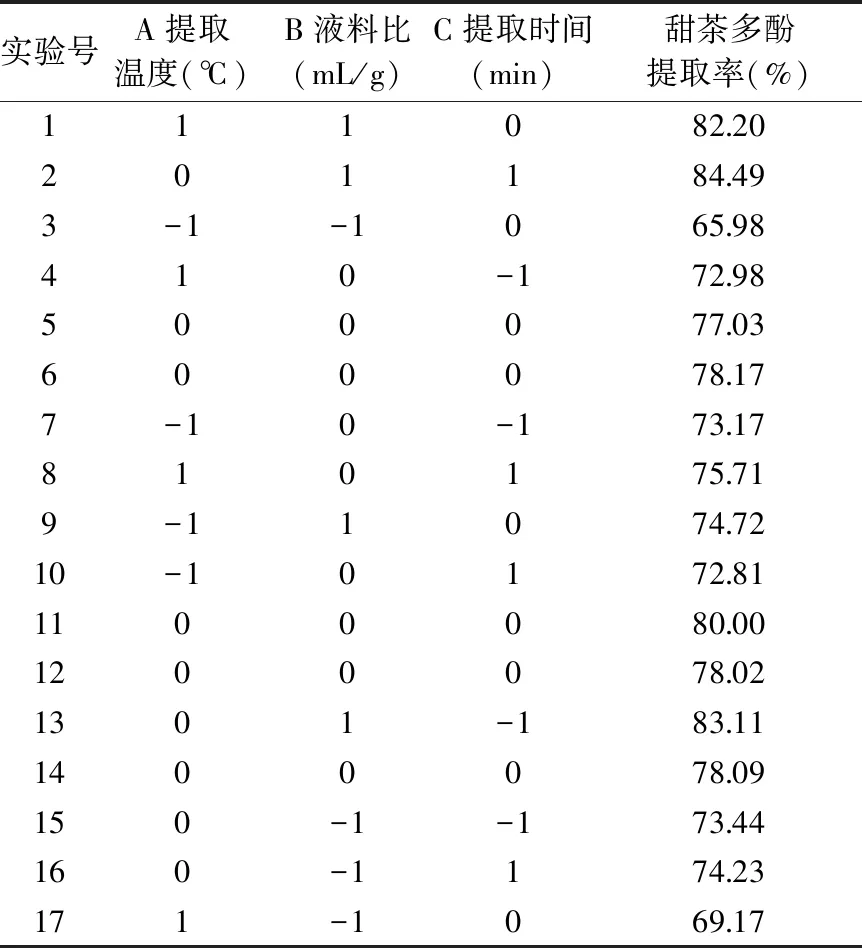
表5 提取甜茶多酚响应面实验设计方案与结果Table 5 Experimental design and results for response surface analysis for the extraction of polyphenols in sweet tea
由表6可知,模型F=2.80,p=0.0003<0.05,说明模型显著;失拟项p=0.2083>0.05为不显著,说明响应曲面设计实验拟合回归方程具有显著意义,该模型可以用于预测甜茶多酚的提取过程。表中一次项A达到显著水平(p<0.05)、B达到极显著水平(p<0.01),二次项A2达到极显著水平(p<0.01),C、B2、C2、AB、AC和BC对甜茶多酚提取率的影响不显著(p>0.05)。由F值可知,三种因素对甜茶多酚提取率的影响次序为B液料比>A提取温度>C提取时间。
2.5 验证实验
通过响应面法优化实验,回归模型预测的甜茶苷水提工艺的最佳条件为:提取温度71.57 ℃,液料比为26.17∶1 mL/g,提取时间为30.73 min。此条件下得到的甜茶苷提取率理论上可达89.15%。考虑到实际操作的可行性,实际工艺条件为:提取温度72 ℃,液料比为26∶1 mL/g,提取时间为31 min。在此条件下,甜茶苷提取率为89.16%(RSD=0.71%,n=3),与模型预测值相符。此时,甜茶多酚的提取率可达80.66%(RSD=1.45%,n=3)。
回归模型预测的甜茶多酚水提的最佳条件为:提取温度57.40 ℃,液料比为24.98∶1 mL/g,提取时间为36.31 min。此条件下得到的甜茶多酚提取率理论上可达84.57%。考虑到实际操作的可行性,改进工艺条件为:提取温度57 ℃,液料比为25∶1 mL/g,提取时间为36 min。在此条件下,甜茶多酚提取率为85.32%(RSD=1.42%,n=3),与预测值基本吻合,说明优化实验方案可行。此时,甜茶苷的提取率可达83.58%(RSD=2.24%,n=3)。
综上,考虑到甜茶的综合利用及能源的节约,选取提取温度为57 ℃,液料比为25∶1 mL/g,提取时间36 min作为提取甜茶活性物质的条件。
3 结论
本文利用甜茶干叶为原料,同时提取甜茶苷和甜茶多酚,采用响应曲面法对甜茶苷和甜茶多酚的提取工艺进行了优化。确定了单独提取甜茶苷的最佳条件为:提取温度72 ℃,液料比为26∶1 mL/g,提取时间为31 min,此条件下甜茶苷提取率达89.16%(RSD=0.71%,n=3),甜茶多酚提取率可达80.66%(RSD=1.45%,n=3)。单独提取甜茶多酚的最佳条件为:提取温度57 ℃,液料比为25∶1 mL/g,提取时间为36 min,此条件下甜茶多酚提取率达85.32%(RSD=1.42%,n=3),甜茶苷提取率达83.58%(RSD=2.24%,n=3)。从甜茶资源的综合利用角度及能源的节约考虑,选择后者作为提取参数。本文通过分别建立数学模型,模型均呈现显著性,具有很好的预测性,为甜茶叶深加工和综合利用提供理论依据和技术参考。

