婴儿豆基粉中低植酸低异黄酮蛋白基料的制备工艺研究
,,,,*
(1.植物蛋白与谷物加工北京市重点实验室,中国农业大学食品科学与营养工程学院,北京 100083;2.北京康得利智能科技有限公司,北京 100074)
大豆含有较为丰富的水溶性蛋白质,主要为球蛋白(94%)和白蛋白(6%),这两种蛋白质与牛乳中的乳清蛋白特性相似,易被婴儿吸收[1]。因此婴儿豆基配方粉是目前市场上被广泛作为牛乳配方粉的替代产品。而婴儿豆基配方粉与乳基配方粉最关键的区别则在于蛋白质基料的不同,目前市面上的几乎都采用大豆分离蛋白(Soy Protein Isolate,SPI)作为豆基婴儿配方粉中的蛋白质基料[2-3]。大豆分离蛋白以豆粕为原料,通过“碱溶酸沉”法制备而得,蛋白含量达90%以上,消化率可达97%以上,富含丰富必需氨基酸[4],是所有植物蛋白粉中的最优蛋白产品,同时还具有营养、方便、价廉的优点。与此同时,现有的豆基配方粉产品中还强化了蛋氨酸、左旋肉碱和牛磺酸等物质,因此其营养素分布也更接近于乳基配方粉,适合大部分婴儿食用[5-6]。
但由于婴儿食用豆基配方粉的历史较短,现缺少相关充足可靠的数据去判断豆基配方粉对人体长期的健康是否会造成影响。而豆基粉中仍存在许多影响其食用安全性的成分,如各类抗营养因子、致敏蛋白和金属Al等。欧洲小儿胃肠营养学会(European Society for Paediatric Gastroenterology,Hepatology,and Nutrition,ESPGHAN)发表的一篇使用婴儿豆基粉的说明中指出:生产商应该致力于减少婴儿豆基粉中胰蛋白酶抑制剂、凝集素、致甲状腺肿的物质、植酸、铝以及植物雌激素的含量[7]。
在影响豆基粉食用安全性的成分中,植酸和异黄酮是对婴儿成长和发育影响最为严重的两种成分。植酸可以螯合食物中的金属离子,形成不溶性复合物,影响机体对矿物质(如钙、铁、锌)的吸收[8-11]。异黄酮类性激素可能会影响婴儿的分泌系统、生殖系统,对将来发育产生影响,婴儿食入较多的异黄酮会还影响其免疫系统、神经行为和甲状腺功能的发育等[12-14]。然而,对现有市售豆基配方粉产品检测发现,市售产品中均含有一定量的异黄酮(307.3±27.8) μg/g和植酸250~300 mg/kg[15-16],而这些成分均来源于配方粉中的蛋白质基料——大豆分离蛋白。因此,要提高豆基配方粉的食用安全性,则需要蛋白生产企业致力于提供安全性更高的婴儿专用大豆蛋白产品。
因此,本研究从创新大豆蛋白制备工艺角度出发,对大豆进行磨浆浸提制浆,再通过酸沉、水洗等工艺获得蛋白产品,研究蛋白制备工艺和关键环节对蛋白提取率、植酸和异黄酮去除率的影响,比较不同加工工艺对蛋白质成分的影响,确定可获得具有更高安全性的蛋白质提取工艺,以提高婴儿豆基粉中蛋白质的食用安全性,为婴儿专用豆基蛋白粉的开发提供基础。
1 材料与方法
1.1 材料与仪器
脱皮大豆、纯净水 市售;考马斯亮蓝G250、金雀异黄素 美国Sigma公司;磷酸氢钠、HCl、NaOH、尿素、丙烯酰胺、FeCl3、CaCl2、NaCl、Na2SO4、浓H2SO4、蒽酮、硫脲等 分析纯,北京化学试剂公司;β-巯基乙醇、牛血清蛋白 美国Amersco公司;D201大孔树脂(φ0.8 cm×10 cm) 天津兴南允能高分子技术有限公司。
PC-180破碎机 广州旭众机械设备有限公司;JYL-350豆浆机 山东九阳小家电有限公司;LXJ-IIB大容量低速离心机 上海安亭科学仪器厂;PP-25 pH计 德国Sartorius公司;90-1磁力搅拌器 上海雷磁新泾仪器有限公司;KQ2200E超声波清洗器 昆山市超声仪器有限公司;FD-1C-50真空冷冻干燥机 北京博医康实验仪器有限公司;SHJ-A水浴恒温磁力搅拌器 金坛市华锋仪器公司;UV1800紫外可见分光光度计、AY220千分之一电子天平 日本SHIMADZU公司;DHG-9140A电热恒温鼓风干燥箱 上海一恒科技有限公司;SHI-III循环水力真空泵 上海亚荣生化仪器厂;QL-901旋涡混合仪 海门其林贝尔仪器制造有限公司。
1.2 实验方法
1.2.1 蛋白浸提液及蛋白粉的制备
1.2.1.1 湿法制备蛋白浸提液及蛋白粉 称取50 g脱皮破碎(过6目筛)大豆于500 mL烧杯中,自来水清洗三遍后再用蒸馏水清洗两遍,加入150 mL蒸馏水在4 ℃条件下浸泡12 h使大豆充分吸水溶胀,滤去多余的水分,再加入20 ℃的蒸馏水,使大豆料液总重量达400 g。转入打浆机中打浆3次,每次40 s,再用120目的尼龙网过滤两次,除渣即得到湿法蛋白浸提液。冻干制粉,即得湿法蛋白粉产品。
1.2.1.2 热烫法制备蛋白浸提液及蛋白粉 称取50 g脱皮破碎(过6目筛)大豆于500 mL烧杯中,自来水清洗三遍后再用蒸馏水清洗两遍,加入150 mL蒸馏水在4 ℃条件下浸泡12 h使大豆充分吸水溶胀,滤去多余的水分。向盛有膨润大豆的400 mL烧杯中,加入150 mL 85 ℃的3‰(w/v)NaHCO3溶液,将烧杯转入85 ℃的恒温水浴中,在大豆与NaHCO3混合料液温度达到(85±2) ℃时计时10 min后取出烧杯,再加入85 ℃的蒸馏水,使大豆料液总重量达400 g。转入打浆机中打浆3次,每次40 s,再用120目的尼龙网过滤两次,除渣即得到热烫法蛋白浸提液。冻干制粉,即得热烫法蛋白粉产品。
1.2.1.3 半干法制备蛋白浸提液及蛋白粉 称取50 g脱皮的破碎(过6目筛)大豆于500 mL烧杯中,自来水清洗三遍后再用蒸馏水清洗两遍,滤去多余的水分。向盛有大豆的400 mL烧杯中加入150 mL 85 ℃的3‰(w/v)NaHCO3溶液,将烧杯转入85 ℃的恒温水浴中,当NaHCO3与大豆混合料液温度达到(85±2) ℃时计时10 min后取出烧杯,再加入85 ℃蒸馏水,使大豆料液总重量达400 g。转入打浆机中打浆3次,每次40 s,再用120目的尼龙网过滤两次,除渣即得到半干法蛋白浸提液。冻干制粉,即得半干法蛋白粉产品。
1.2.2 蛋白粉中可溶性蛋白质含量的测定 将100 mg考马斯亮蓝G250溶解到50 mL 95%的乙醇溶液中,然后加入100 mL 85%的磷酸,加蒸馏水至800 mL过夜搅拌(10 h左右),使G250充分溶解,定容至1 L,然后在室温下用两层定性滤纸抽滤备用。将蛋白粉产品用蒸馏水稀释50倍,吸取稀释液0.1 mL,加入5 mL考马斯亮蓝G250染液,用紫外-可见光分光光度计在595 nm测定吸光值。以牛血清白蛋白制作标准曲线计算蛋白粉样品中的可溶性蛋白浓度。以可溶性蛋白浓度(mg/mL)为y,吸光值为x,得到标准曲线方程:y=0.8615x+0.1139,r=0.999。
1.2.3 蛋白浸提液总固形物含量的测定 称取约15 g左右的石英砂于铝盒中,放入105 ℃烘箱中,烘至恒重,放在干燥器中,冷却至室温,称取其质量(M1)。称取5 g左右的蛋白浸提液加入该铝盒,称取质量(M2)。在105 ℃烘箱中烘干,至连续两次称重质量之差小于0.0002 g。记录最后两次称重平均值(M3),计算蛋白浸提液总固形物含量公式如下:
1.2.4 大豆转化率的计算 大豆转化率为一定质量的大豆制浆后获得蛋白浸提液的固形物质量占到原料大豆质量的百分比。计算大豆转化率公式如下:
大豆转化率(%)=(浸提液得率×固形物含量)×100/原料大豆净重
1.2.5 植酸含量的测定 采用Latta等[17]报道的离子交换比色方法加以改进。将50 g无水硫酸钠溶于500 mL 1%的盐酸溶液,用于样品中植酸的提取。取10 g样品,与50 mL上述的硫酸钠/盐酸溶液混合,室温搅拌2 h。混浊的提取液经过玻璃三角漏斗过滤一次后收集滤液。取10 mL滤液加入30 g/L NaOH和19 mL去离子水,混合后缓慢注入填有0.5 g AX1-G4强碱型阴离子树脂的离子交换柱(Ф 0.8 cm×10 cm)中。树脂先后由15 mL纯净水和15 mL 0.05 mol/L的氯化钠溶液洗脱,弃去洗脱液。最后用0.7 mol/L氯化钠溶液洗脱,流出液体接收并定容于25 mL容量瓶中。5 mL洗脱液与4 mL改进的Wade试剂(0.03%三氯化铁和0.3%磺基水杨酸和混合水溶液)混合,静置20 min于3000 r/min离心10 min后,于500 nm下测定上清的吸光值。用5 mL 0、0.02、0.04、0.06、0.08、0.1 mg/mL的植酸钠标品与Wade试剂,以吸光值为横坐标,以植酸含量为纵坐标,得标准曲线为y=0.9229-1.0525x,r=0.989,并计算样品植酸的含量。
1.2.6 异黄酮含量的测定 称取约1.0 g样品,溶于20 mL的60%乙醇溶液中,震荡提取2 h,过滤,收集滤液备用。准确称取大豆总异黄酮纯化物金雀异黄素10.4 mg,置入50 mL容量瓶中,以95%乙醇溶解,并定容至刻度,摇匀。准确吸取0.05、0.1、0.15、0.2、0.3、0.4 mL标准品溶液分别置于10 mL容量瓶中,并各加1.0 mL 95%乙醇,再加蒸馏水稀释到刻度线,摇匀。以1 mL 95%乙醇加水到10 mL作空白对照,在259 nm处测得吸光值,以测得的吸光值(x)与纯品含量(y)绘制标准工作曲线得y=0.1437x+0.0062,r=0.999。
分别准确吸取样品液0.3 mL置于3只10 mL容量瓶中,按标准曲线制备操作,在259 nm处测定吸光值,计算平均值,按标准曲线的回归方程计算含量,并计算样品的大豆总异黄酮质量分数。
1.2.7 不同pH酸沉条件下蛋白粉的制备 称取100 g脱皮的破碎大豆于500 mL烧杯中,用自来水清洗三遍,再用蒸馏水清洗两遍,滤去多余的水分,向盛有膨润大豆的400 mL烧杯中,将300 mL 85 ℃的3‰(w/v)NaHCO3溶液倒入,接着将烧杯置于85 ℃的恒温水浴中,当NaHCO3与大豆混合料液温度达到(85±2) ℃时,计时10 min后取出烧杯,再将85 ℃蒸馏水和浸泡后的大豆使其总重量达800 g一起转入打浆机中,打浆3次,每次40 s,用120目的尼龙网过滤两次,除渣即得到蛋白浸提液。
待浸提液冷却至室温,用6 mol/L HCl和1 mol/L HCl调节pH,分别调节pH至4.51、5.15、5.50、6.00进行酸沉,4000 r/mim离心5 min,沉淀水洗两次后加水复溶,搅拌均匀,15000 r/min剪切均质5 min,调节蛋白质量分数至3%。冻干后测定植酸及异黄酮含量。
1.2.8 去乳清蛋白粉的制备 蛋白浸提液的制备同1.2.7。待浸提液冷却至室温,用6 mol/L HCl和1 mol/L HCl调节pH,调节pH至5.15进行酸沉,4000 r/mim离心5 min,分别保留0、20%、40%、60%、80%、100%的乳清含量,沉淀水洗两次后加水复溶,搅拌均匀,15000 r/min剪切均质5 min,调节蛋白质量分数至3%。冻干后测定植酸及异黄酮含量。
1.3 数据处理
所有试验均进行重复,结果取其平均值±标准差。实验数据采用Microsoft、Excel和SPSS软件进行分析处理和方差分析,利用Origin 8.0软件进行绘图,通过单因素方差分析对实验数据进行差异显著性分析,当p<0.05时,认为数据间存在显著性差异。
2 结果与分析
2.1 制浆方法对大豆转化率、可溶性蛋白及固形物含量的影响
大豆转化率、可溶性蛋白和固形物含量是体现原料利用率的重要指标。其含量越高,原料利用率就越高。分别比较不同方法的大豆转化率、可溶性蛋白和固形物含量,结果如图1和图2所示。
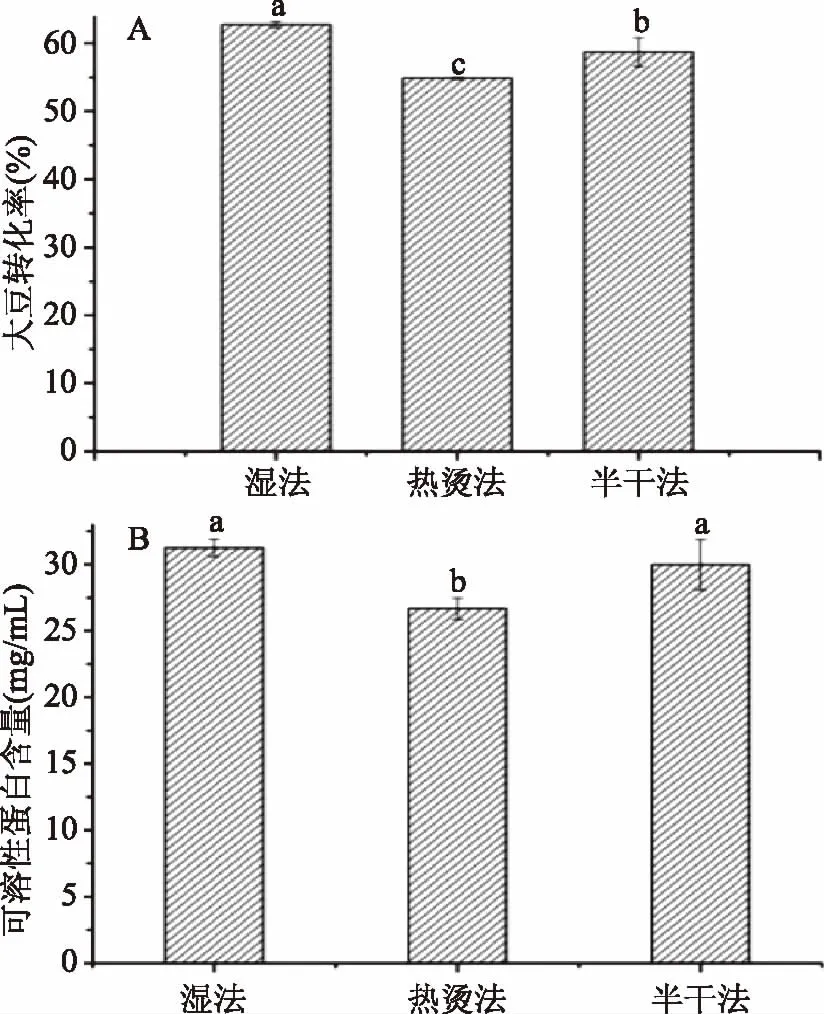
图1 不同方法制备蛋白浸提液大豆转化率和可溶性蛋白含量Fig.1 Yield and soluble protein content of protein extraction solution in different methods注:不同字母表示统计学上差异显著(p<0.05),图2~图5同。
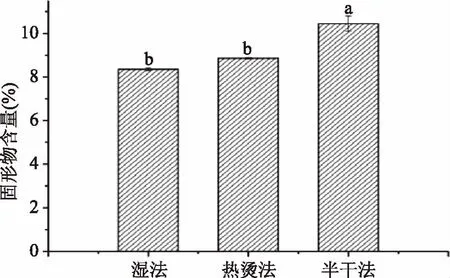
图2 不同方法制备的浸提液固形物含量Fig.2 Solid content of protein extraction solution in different methods
由图1可知,三种方法中,以湿法的大豆转化率含量和可溶性蛋白含量最高,其中大豆转化率比热烫法和半干法分别高了7.89%和4.06%,均表现出显著性差异(p<0.05),可溶性蛋白含量分别高了17.17%和4.27%,与热烫法呈显著差异(p<0.05),但与半干法差异不显著(p>0.05)。热烫法和半干法均采用85 ℃热水磨浆,85 ℃时7S球蛋白发生变性,从而导致浸提液中大粒径粒子蛋白的增加,浸提液整体稳定性降低[18],因此经过后续的过滤环节,大粒子蛋白被截留,其转化率和可溶性蛋白质含量均低于采用冷磨制浆的湿法工艺。此外,热烫法中对大豆浸泡液采用85 ℃的NaHCO3热烫10 min,其7S球蛋白变性程度更剧烈,降低了浸提液的可溶性蛋白粒子含量,因此转化率最低。
如图2,在固形物含量比较中,湿法、热烫法和半干法的固形物含量分别为8.35%、8.86%、10.45%,即湿法和热烫法的固形物含量较半干法制得的浸提液含量低,呈显著性差异(p<0.05)。大豆在浸泡过程中,部分物质和蛋白质会溶出到浸泡液中,并随着浸泡液的废弃而损失[19],而且去皮大豆由于减少了种皮的阻隔,其可溶性固形物成分更容易浸出[20]。而半干法未经过浸泡处理,有效保留了浸泡液中的成分,因此其固形物含量更高。
2.2 制浆方法对蛋白粉中的植酸和异黄酮含量的影响
植酸能与二价或三价的金属离子螯合形成难溶性的植酸盐络合物,从而影响人体对矿物质的吸收[8-11],而较多的异黄酮会对幼年动物的生殖系统、免疫系统、甲状腺发育等造成影响[12-14]。因此本研究对不同制浆方法所得蛋白粉产品的植酸和异黄酮含量进行对比,确定蛋白浸提液最优制备工艺。
从图3可知,三种方法中,湿法和热烫法蛋白粉中的植酸含量均低于半干法蛋白粉植酸含量,差异显著(p<0.05)。这可能是因为前两者都是经过浸泡处理,大豆中的部分游离植酸随着可溶性成分一起浸出,从而导致了植酸含量的降低。而在异黄酮含量方面,热烫法和半干法的异黄酮均高于湿法,但差异不显著(p>0.05)。从处理温度上来说,由于热烫法和半干法都采用了85 ℃的NaHCO3溶液热烫处理,因此又可统称为热磨浆法,而湿法未经过该处理的则可称为冷磨浆法。染料木素和大豆苷元及其各自的糖苷是豆基配方食品中异黄酮的主要存在形式,由于大豆中丙二酰基类化合物具有不稳定性,热烫处理可使之脱去二氧化碳,从而形成乙酰糖苷或糖苷配基,造成大豆苷元的增加[21-22],因此热磨浆法略高于冷磨浆法。
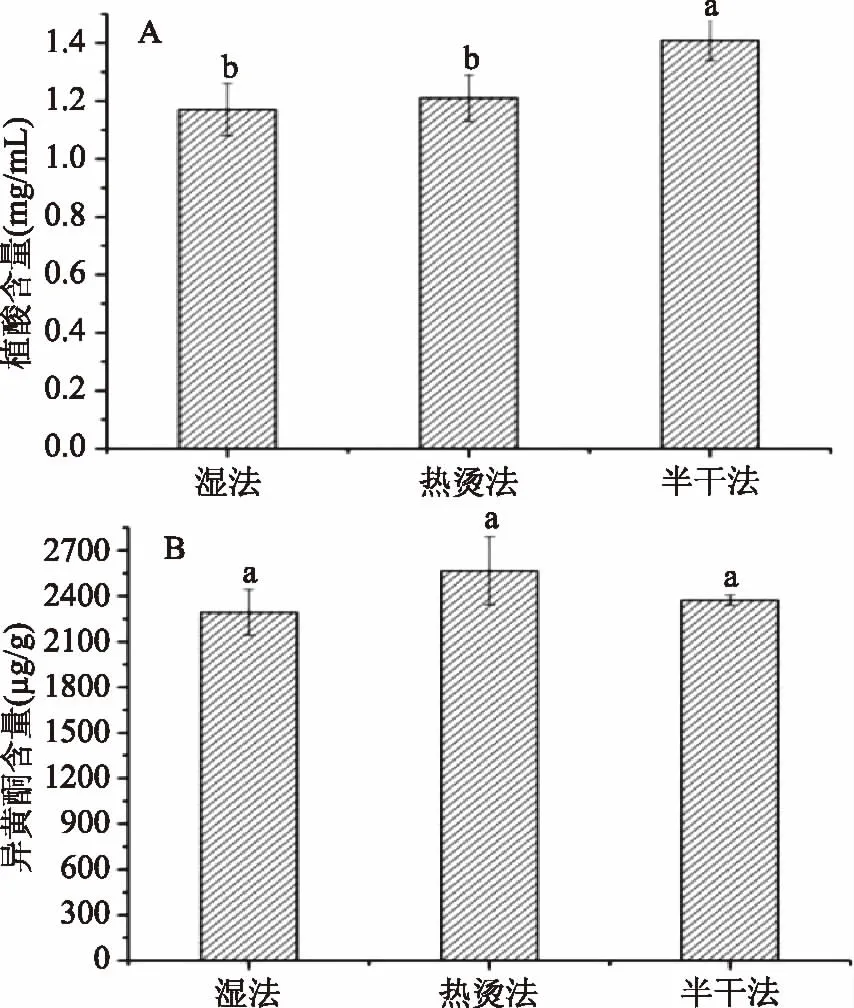
图3 不同蛋白粉制备方法的植酸和异黄酮含量Fig.3 Contents of phytate and isoflavones of protein powder in different preparation methods
浸泡大豆一方面可以使大豆吸水膨胀,便于磨浆;另一方面使大豆组织中的蛋白质等溶质较容易的被提取出来[20]。但随着传统豆制品生产企业的规模化和现代化发展,湿法工艺在工业化中生产中问题越来越突出,如生产耗水大,浸泡设备占地面积大,浸泡时间长等。而半干法未经浸泡,直接在80~85 ℃下热烫对脂肪氧化酶进行灭酶,再进行磨浆处理,且可以钝化脂肪氧化酶、脲酶的活性,同时减少了浸泡的工艺流程,节省了生产时间。而在本研究中,半干法浸提液的大豆转化率、蛋白含量和异黄酮含量居于三者中间。因此综合考虑到生产工艺的连续性和即时性,半干法工艺最简单、耗时最短,选用半干法浸提为蛋白质首选提取方法。
2.3 酸沉条件对蛋白粉植酸和异黄酮含量的影响
从图4A可知,蛋白粉中植酸含量随pH的升高而呈下降趋势。但当pH≥5.15时,植酸的含量无显著差异(p>0.05)。有研究曾发现,在pH高于等电点、接近于5.3的条件下酸沉分离大豆蛋白,可以有效降低大豆分离蛋白中的植酸含量[23-24]。李雯[25]的研究也表明,在pH5.3附近能够有效降低大豆分离蛋白中的植酸含量。
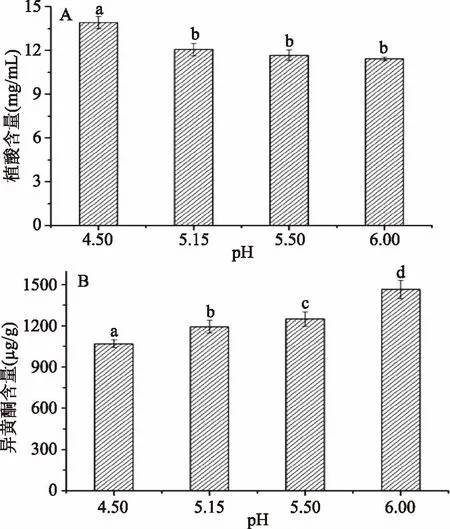
图4 不同pH酸沉处理的蛋白粉中植酸和异黄酮含量Fig.4 Contents of phytate and isoflavones of protein powder in different pH acid precipitation
大豆异黄酮含量则与植酸含量相反,随pH的升高而呈升高趋势(如图4B所示)。在pH4.50、5.15、5.50、6.00的条件下进行酸沉处理浸提液时,蛋白浸提液中含有的异黄酮含量分别降低了55.0%、49.7%、47.4%、38.3%,异黄酮含量随着酸沉pH的降低而降低。研究表明,pH5.3条件下处理大豆分离蛋白,其中的大豆异黄酮含量较未处理的也有所下降[25]。因此,在pH5.15酸沉处理浸提液可有效去除部分植酸和大豆异黄酮含量,获得植酸和黄异酮含量较低的蛋白粉产品。
2.4 乳清含量对蛋白粉中植酸和异黄酮含量的影响
蛋白浸提液经酸处理后发生沉淀,沉淀部分即为蛋白质,上清部分即为乳清。因此在蛋白质提取工艺中,离心去除乳清即可获得蛋白质。但仅一次离心不可能完全去除乳清溶液,因此在实验室制备蛋白质时,通常会将沉淀蛋白质加水水洗离心2~3次,使其它组分可以去除更充分,蛋白质的纯度和提取率也更高。然而在现有工厂生产中,为提高生产效率,蛋白质的离心处理通常采用卧螺式连续离心,而连续式离心处理不可去除所有乳清,因此植酸和异黄酮也会随之有部分保留。为明确乳清的存留量对植酸和异黄酮的影响,本研究对不同乳清保留量下植酸和异黄酮的残留量进行分析,结果如图5所示。从图5中可知,乳清保留量在40%以下时,植酸含量与完全去除乳清时无显著显异(p>0.05),但当乳清保留量达40%以后,植酸含量显著增加(p<0.05);而异黄酮含量随乳清保留量的增加呈显著增加趋势(p<0.05)。因此综合考虑,在工厂生产时,若乳清保留量能控制在20%以内,则植酸和异黄酮的含量可以得到较好的控制。其蛋白质植酸和异黄酮含量分别为(12.08±0.46) mg/g和(1468±74) μg/g,较普通大豆分离蛋白中的植酸(19.86±0.56) mg/g和异黄酮(2108±176) μg/g[6,26]分别降低了39.17%和30.36%。
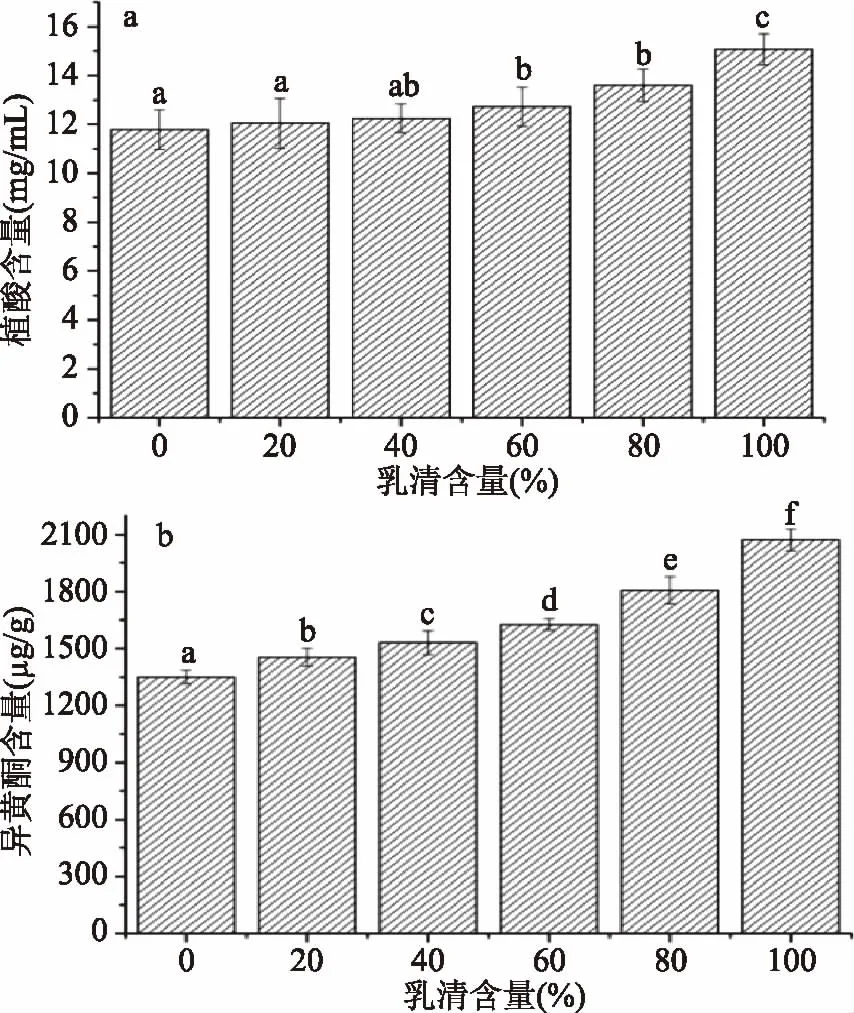
图5 不同乳清含量的蛋白粉中植酸和异黄酮的含量Fig.5 The content of phytate and isoflavones of protein powder with different whey fraction
3 结论
本研究确定了可获得安全性更高的大豆蛋白制备工艺:当采用半干法制备蛋白浸提液,在pH5.15时酸沉浸提液再水洗离心提取大豆蛋白质,且体系中乳清保留量低于20%时,可以较好的控制植酸和异黄酮的残留量。利用此方法所获得的蛋白质植酸和异黄酮含量分别为(12.08±0.46) mg/g和(1468±74) μg/g,低于普通大豆分离蛋白粉,提高了蛋白质基料的安全性,为进一步开发为高安全性的婴儿专用大豆蛋白基料奠定了基础。

