双歧杆菌复合微胶囊的工艺优化、表征及功能特性分析
,,,,, ,
(广州医科大学公共卫生学院,广东广州 511436)
双歧杆菌是人体肠道中的益生菌,其制品的益生作用比单纯服用双歧因子制剂效果更好[1],但活菌数需超过106CFU/g或106CFU/mL才能有效地发挥作用。然而,双歧杆菌对氧、酸性环境极为敏感,保持活性较困难[2]。此外,胃液中较低的pH和氧化还原电位、小肠中的高浓度胆汁溶液都会使其活性大幅度降低[3]。微胶囊技术是一种能保持益生菌存活率的方法,可提高益生菌在加工、储藏及通过人体消化道期间对氧、胃酸和胆汁的耐受性[4]。微胶囊壁材的选择对于微胶囊产品的性能起决定性作用,在制备益生菌微胶囊过程中使用单一壁材,难以达到微胶囊化的所有要求。研究表明使用复合壁材包埋双歧杆菌可增加其存活率,在微胶囊制备过程中具有特定优势。因此,深入研究复合微胶囊对益生菌的保护作用十分必要。
已有研究证实,以海藻酸钠和壳聚糖为壁材,制备出的双歧杆菌微胶囊,在胃酸耐受性和稳定性上较游离的菌液均有所提高[5]。也有学者采用羧甲基壳聚糖和海藻酸盐为壁材,制备长双歧杆菌BIOMA5920微胶囊,结果显示,用复合壁材比用单一壁材制备的微胶囊在包埋率、肠溶性等方面更好[6]。这些研究表明复合壁材用于益生菌微胶囊的制备,具有包埋率高,肠溶性好,稳定性高,耐受性强等特点。但现有复合壁材制备的微胶囊仍存在定向释放困难、菌体成活率低、粒径均一性较差等不足[7],亟需探索具有提高活菌率、定向释放特性、良好均一性的新型复合壁材。膳食纤维根据溶解性的不同可分为水不溶性膳食纤维和水溶性膳食纤维。水不溶性膳食纤维的主要成分是纤维素、半纤维素、木质素,在胃中不能被消化吸收,而在肠道里面可被菌群降解利用,可作为益生菌的微胶囊壁材,有望实现益生菌在肠道的定向释放[8-9]。此外,膳食纤维中的多糖成分可充当益生菌的营养物质,起到培养基的作用,提高活菌率。因此,水不溶性膳食纤维作为益生菌微胶囊的壁材具有独特的优势。但单独使用水不溶性膳食纤维凝胶性能较差,结合海藻酸钠和卡拉胶作为微胶囊的壁材,可增加其包埋率和肠溶性。
针对上述问题,本文拟采用香蕉皮水不溶性膳食纤维-海藻酸钠-卡拉胶为复合壁材包埋双歧杆菌BB12,同时在芯材中添加低聚果糖作为益生元,进一步提高益生菌的存活率。此外,本研究还将优化微胶囊化工艺,并对该微胶囊的结构表征和在消化道环境中的稳定性进行了研究,以期最大限度地保持菌体的生物活性,为工业化生产活菌制剂提供技术支持。
1 材料与方法
1.1 材料与仪器
动物双歧杆菌BB12(Bifidobacteriumanimalissubsp.lactisBB-12) 丹麦科汉森公司;香蕉 广州南沙;海藻酸钠(Sodium alginate) 河南优元生物科技有限公司;卡拉胶(Carrageenan) 滕州市香凝生物工程有限公司;低聚果糖(Fructo oligosaccharides) 山东欣鼎生物科技有限公司;CaCl2广州化学试剂;NaCl 广州化学试剂厂;PBS粉剂 广州杰特伟生物科技有限公司;胆盐 上海阿拉丁生化科技股份有限公司;胃蛋白酶(10000 U/g)、胰蛋白酶(250 U/g) 美国Sigma公司;MRS肉汤、MRS琼脂 广东环凯生物科技有限公司。
FD-1A-80真空冷冻干燥机 北京博医实验仪器有限公司;D2F-6050电热烘干箱 上海一恒科学仪器有限公司;SPX-250B生化培养箱 上海锐丰仪器仪表有限公司;ZHJH-C1106B生物洁净工作台 上海智域分析仪器制造有限公司;ME204E电子分析天平 梅特勒托利多仪器(上海)有限公司;mLS-3750高压蒸汽灭菌锅 日本SANYO公司;Allegra x-22R离心机 美国BECKMAN COULTER公司;F30400209磁力搅拌器 意大利VELP SCIENTIFICA公司;FE20/EL20pH计 梅特勒托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 香蕉皮中水不溶性膳食纤维的制备 参考张丰等[10]的方法进行制备。将香蕉皮真空冷冻干燥后,使用粉碎机粉碎并过筛(40目)。称取香蕉皮干粉放入带盖的瓶子中,加入12%的NaOH溶液,料液比为2∶50 g/mL。将瓶子放入超声清洗仪中超声30 min后,放入61 ℃的水浴锅中水浴90 min。取出后,在瓶中滴加盐酸(5 mol/L)调pH至7.0左右。将瓶中液体倒入离心管中,离心管放入离心机(5000 r/min,6 min),室温下进行离心处理。倒掉滤液,在滤渣中加入2~3倍体积的无水乙醇脱色3 h后,抽滤,用生理盐水冲洗3次,取出滤渣,放置在锡纸内,放入电热鼓风干燥箱中干燥(50 ℃,4~5 h),直至恒重,即得香蕉皮水不溶性膳食纤维。
1.2.2 双歧杆菌微胶囊的制备
1.2.2.1 菌种活化 将121 ℃灭菌15 min后的MRS液体培养基冷却,然后在培养基中按0.1%(v/v)接种保存于-20 ℃下的双歧杆菌BB12,37 ℃恒温培养24~36 h,进行活化。
1.2.2.2 菌悬液制备 将已活化至第三代的双歧杆菌菌液在4 ℃下离心(4000 r/min,10 min)后,除去上清液,收集菌泥,再加入与培养液等体积(30 mL)的生理盐水混合均匀后备用。同时,进行梯度稀释,按平板计数法检测菌悬液的活菌数,活菌数用CFU/mL表示。
1.2.2.3 复合微胶囊的制备 称取一定质量的海藻酸钠和卡拉胶,加入5 mL pH6.5的无菌PBS缓冲液,置于75~85 ℃水浴溶解。然后加入一定质量的香蕉皮水不溶性膳食纤维,搅拌均匀,紫外灯照射30 min,此为壁材溶液,备用。将一定浓度的低聚果糖溶液和双歧杆菌菌悬液以1∶1 (v/v)的比例混合,此为芯材溶液。取制备好的芯材溶液5 mL,加入等体积的壁材溶液,混合均匀。用10 mL注射器将混合液喷射到60 mL 5% CaCl2溶液中,用磁力搅拌器搅拌一定时间,形成胶囊,过滤,并用蒸馏水将胶囊冲洗3次,即得湿胶囊。将湿胶囊置于-80 ℃冷冻干燥24~48 h,可制得冻干微胶囊。
1.2.3 微胶囊包埋产率的测定 取1 g湿胶囊,加入9 mL pH为7.4的解囊液[PBS 缓冲液(pH7.4)][11]中,37 ℃振荡完全崩解后,用无菌生理盐水进行梯度稀释,稀释至10-3,使活菌数在30~300 CFU/mL范围内。取0.1 mL稀释过的菌悬液滴于MRS固体培养基上,用涂布器涂布均匀,密封,编号,倒置,在37 ℃恒温条件下培养48~72 h,观察菌落生长情况并计数[12]。
包埋产率(%)=G1×V1×M/(N0×V0×M0)×100
式中:G1:1 mL解囊液中的双歧杆菌活菌数(CFU/mL);V1:解囊液的总体积(mL);N0:包埋前单位体积原菌液中的活菌数(CFU/mL);V0:制备微胶囊所用原菌液的体积(mL);M:所得微胶囊的总重量(g);M0:称取微胶囊的重量(g)。
1.2.4 单因素实验 以包埋产率为指标,分别研究香蕉皮水不溶性膳食纤维含量、海藻酸钠浓度、卡拉胶浓度、低聚果糖浓度及搅拌时间对双歧杆菌BB12微胶囊包埋效果的影响。
1.2.4.1 香蕉皮水不溶性膳食纤维含量 称取海藻酸钠和卡拉胶,溶于5 mL pH6.5的无菌PBS缓冲液,然后分别加入不同质量的香蕉皮水不溶性膳食纤维,搅拌均匀,所得混合液中海藻酸钠和卡拉胶的浓度为2%和3%,水不溶性膳食纤维的含量分别为0、15%、30%、45%、60%,紫外灯照射30 min,制成壁材溶液。将双歧杆菌菌悬液和浓度为5%的低聚果糖溶液以1∶1 (v/v)的比例混合,制成芯材溶液。将制备好的芯材溶液5 mL,加入等体积的壁材溶液,混合均匀。用10 mL注射器将混合液喷射到60 mL 5% CaCl2溶液中,用磁力搅拌器搅拌30 min,形成胶囊,并过滤,用蒸馏水将胶囊冲洗3次,即得湿胶囊。
1.2.4.2 海藻酸钠浓度 称取卡拉胶和海藻酸钠,溶于5 mL pH6.5的无菌PBS缓冲液,然后加入香蕉皮水不溶性膳食纤维,搅拌均匀,紫外灯照射30 min,此为壁材溶液。所得混合液中卡拉胶浓度为3%,水不溶性膳食纤维含量15%,海藻酸钠的含量分别为2%、3%、4%、5%、6%。其余步骤同1.2.4.1。
1.2.4.3 卡拉胶浓度 称取海藻酸钠和卡拉胶,溶于5 mL pH6.5的无菌PBS缓冲液,然后加入香蕉皮水不溶性膳食纤维,搅拌均匀,紫外灯照射30 min,此为壁材溶液。所得混合液中卡拉胶浓度分别为2%、3%、4%、5%、6%,水不溶性膳食纤维含量15%,海藻酸钠的含量为2%。其余步骤同1.2.4.1。
1.2.4.4 低聚果糖浓度 称取海藻酸钠和卡拉胶,溶于5 mL pH6.5的无菌PBS缓冲液,然后加入香蕉皮水不溶性膳食纤维,搅拌均匀,紫外灯照射30 min,此为壁材溶液。所得混合液中海藻酸钠和卡拉胶的浓度为2%和3%,水不溶性膳食纤维含量15%。将浓度分别为1%、2%、3%、4%、5%的低聚果糖溶液和双歧杆菌菌悬液以1∶1 (v/v)的比例混合,此为芯材溶液。其余步骤同1.2.4.1。
1.2.4.5 搅拌时间 称取海藻酸钠和卡拉胶,溶于5 mL pH6.5的无菌PBS缓冲液,然后加入香蕉皮水不溶性膳食纤维,搅拌均匀,紫外灯照射30 min,此为壁材溶液。所得混合液中海藻酸钠和卡拉胶的浓度为2%和3%,水不溶性膳食纤维含量15%。将双歧杆菌菌悬液和浓度为5%的低聚果糖溶液以1∶1 (v/v)的比例混合,制成芯材溶液。取制备好的芯材溶液5 mL,加入等体积的壁材溶液,混合均匀。用10 mL注射器将混合液喷射到60 mL 5% CaCl2溶液中,然后用磁力搅拌器分别搅拌10、20、30、40、50 min,形成胶囊,过滤,并用蒸馏水将胶囊冲洗3次,即得湿胶囊。
1.2.5 最陡爬坡实验 最陡爬坡试验以实验值变化梯度为爬坡方向。根据前期实验得到的各单因素效应值的大小确定变化步长及变化方向,使响应值快速逼近最大响应区域。
1.2.6 响应面优化实验设计 根据Box-Behnken中心组合设计原理,采用5 因素3水平的响应面分析法,以包埋产率为响应值,设计响应面组合,对双歧杆菌BB12微胶囊的制备工艺进行优化。实验设计如表1。

表1 响应面实验因素水平表Table 1 Factors and levels of response surface experiment
1.2.7 微胶囊的表征分析
1.2.7.1 红外光谱 称取最优条件下制备的冻干微胶囊、芯材、壁材单一成分及其混合物各约1 g,分别与100 mg KBr混合,在研钵中充分研磨后,压片,置于4000~400 cm-1内进行红外光谱扫描(分辨率为4 cm-1)。
1.2.7.2 扫描电镜 用导电胶将最优条件下制备的样品粉末黏在SEM载物台上,样品表面喷金,30 min后将载物台置于SEM扫描电镜中进行扫描(加速电压为20 kV,电流为75 mA)。
1.2.8 双歧杆菌微胶囊的功能特性
1.2.8.1 耐胃酸实验 配制人工模拟胃液[13]:取16.4 mL盐酸(5 mol/L)于烧杯中,加入约800 mL蒸馏水稀释,加入10 g胃蛋白酶,搅匀后加水定容至1000 mL。参照冯超[14]的方法进行实验。取最优条件下得到的双歧杆菌微胶囊1 g和1.2.2.2得到的未包埋的双歧杆菌原菌液1 mL,分别置于9 mL人工模拟胃液中,37 ℃恒温摇晃0、1、2 h后,弃去胃液。收集湿微胶囊,用解囊液彻底崩解后,制成菌悬液,计数。
1.2.8.2 耐胆盐实验 将浓度为0%、0.3%、0.4%、0.5%的胆酸钠溶液,121 ℃灭菌。参照肖仔君等[15]的方法进行实验。取最优条件下得到的双歧杆菌微胶囊1 g和1.2.2.2得到的未包埋的双歧杆菌原菌液1 mL,分别置于9 mL上述溶液,37 ℃水浴3 h后,弃去胆汁。收集微胶囊,用解囊液彻底崩解后,制成菌悬液,计数。
1.2.8.3 肠道释放性 配制人工模拟肠液[13]:取6.8 g磷酸二氢钾加500 mL蒸馏水溶解后,用0.4%的氢氧化钠溶液调节pH至6.8;另取10 g胰蛋白酶加适量水使之溶解,将两液混合后,加水定容至1000 mL即得。参照郝莹等[16]的方法进行实验。称取最优条件下得到的双歧杆菌微胶囊1 g,置于9 mL人工模拟肠液中,放在恒温摇床中进行处理,将恒温摇床的温度调节为37 ℃,摇速设置成210 r/min,0、20、40、60 min后,直接吸取3~4 mL溶液,测定其在波长600 nm处的透光率。
1.3 数据处理
2 结果与分析
2.1 单因素实验结果
2.1.1 香蕉皮水不溶性膳食纤维含量对微胶囊包埋产率的影响 由图1可知,未添加香蕉皮水不溶性膳食纤维的微胶囊包埋产率较低。而添加香蕉皮水不溶性膳食纤维的包埋产率升高,当膳食纤维含量为45%时包埋产率达到最大值,为66.46%。香蕉皮水不溶性膳食纤维含量过低时,微胶囊的囊壁厚度不均匀,稳定性较差,使得微胶囊容易破裂,芯材易渗漏在固化液中。当香蕉皮水不溶性膳食纤维含量超过45%并继续增加时,壁材流动性变差,不利于形成均一稳定的双歧杆菌微胶囊。为优化实验,香蕉皮水不溶性膳食纤维最佳含量为45%。
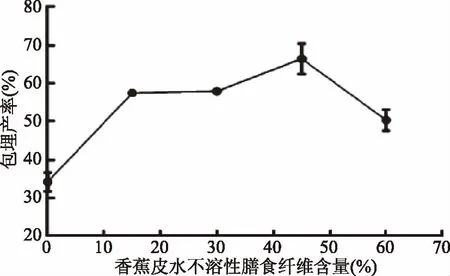
图1 香蕉皮水不溶性膳食纤维含量对双歧杆菌微胶囊包埋产率的影响 Fig.1 Effects of content of water-insoluble dietary fiber in banana peel on embedding yield of Bifidobacteria microcapsules
2.1.2 海藻酸钠浓度对微胶囊包埋产率的影响 由图2可知,在海藻酸钠浓度在2%~3%时,微胶囊的包埋产率会随着海藻酸钠浓度的增加而增大。当海藻酸钠浓度达到3%时,包埋产率达到最大值65.39%。若海藻酸钠浓度继续增大,包埋产率则明显降低。出现上述结果的原因可能是海藻酸钠的浓度对形成微胶囊的机械强度有一定影响。海藻酸钠浓度过低时,三种壁材混合所形成的壁膜过薄,机械强度低,从而影响了包埋效果。海藻酸钠浓度合适时,可与固化液中的Ca2+结合充分,膜结构致密稳定[15]。但海藻酸钠浓度过高时,其黏度增大,微胶囊容易聚集成团,黏连较严重,导致溶液挤出困难。综合考虑各种因素,海藻酸钠浓度选择3%较合适。
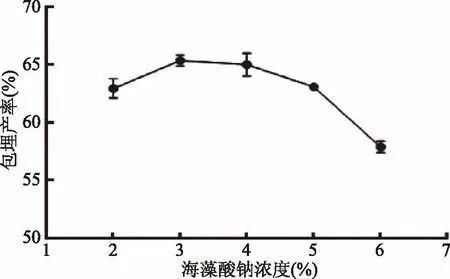
图2 海藻酸钠浓度对双歧杆菌微胶囊包埋产率的影响Fig.2 Effects of concentration of sodium alginate on embedding yield of Bifidobacterium microcapsules
2.1.3 卡拉胶浓度对微胶囊包埋产率的影响 由图3可知,当卡拉胶浓度在2%~4%范围内,微胶囊的包埋产率与卡拉胶浓度呈正相关。这是由于卡拉胶浓度较低时,其硫酸基团所携带的负电荷较少[17],与溶液中其他物质所携带的正电荷结合不充分,导致微胶囊的密度不够。当卡拉胶浓度超过4%并持续增加时,包埋产率稍微降低,是因为卡拉胶在复合壁材中的比例增加,黏度增大,会给微胶囊的挤出过程带来一定的困难。当卡拉胶浓度从5%继续增大,包埋产率随之变大,但此时卡拉胶与其他壁材配比失衡,微胶囊挤压到固化液中并不能形成完整的球形。考虑到微胶囊的形态,卡拉胶浓度不宜过大,建议选择浓度为4%~6%。

图3 卡拉胶浓度对双歧杆菌微胶囊包埋产率的影响Fig.3 Effects of concentration of carrageenan on embedding yield of Bifidobacterium microcapsules
2.1.4 低聚果糖浓度对微胶囊包埋产率的影响 由图4可知,当低聚果糖浓度从1%~3%时,其包埋产率与低聚果糖浓度呈正相关。当低聚果糖浓度为3%时,微胶囊的包埋产率达到最大值60.10%。此时,壁材和芯材所形成的网状结构致密程度较高,在微胶囊中的双歧杆菌活菌不易泄露出来。低聚果糖浓度继续增加,包埋产率呈下降的趋势。可能是由于低聚果糖浓度过高,改变了整个体系的浓度;导致渗透压升高,使细菌活性受到影响,进而影响包埋产率。综合考虑各种因素后,低聚果糖浓度选择3%为宜。
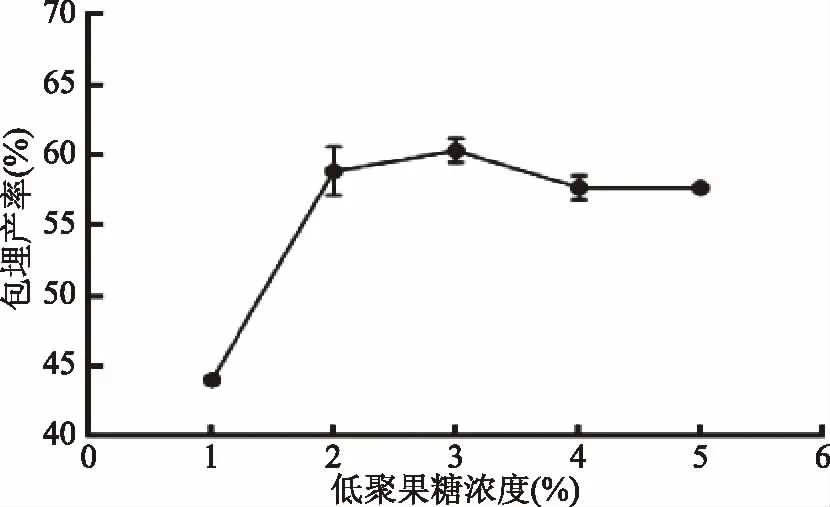
图4 低聚果糖浓度对双歧杆菌微胶囊包埋产率的影响Fig.4 Effects of concentration of fructo oligosaccharide on embedding yield of Bifidobacteria microcapsules
2.1.5 搅拌时间对微胶囊包埋产率的影响 由图5可知,当搅拌时间从10~30 min时,双歧杆菌微胶囊的包埋产率与搅拌时间呈正相关。原因可能是搅拌时间过短,混合溶液正负电荷作用不完全[18]。随着搅拌时间的增加,微胶囊的交联度增大,大量双歧杆菌被包埋。当搅拌时间为30 min时,包埋产率达到最大值64.12%。但此时搅拌时间继续增加,微胶囊的包埋产率又会变小。这是因为过长的搅拌时间会破坏复合壁材形成的网络结构,微胶囊密度发生变化,双歧杆菌重新泄露到溶液中。考虑到实际生产中节能的需要,选择搅拌时间30 min为宜。
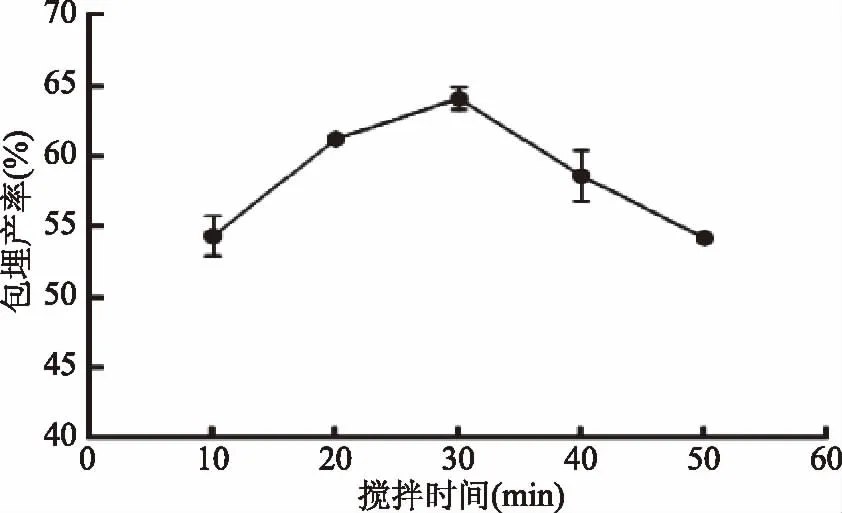
图5 搅拌时间对双歧杆菌微胶囊包埋产率的影响Fig.5 Effects of mixing time on embedding yield of Bifidobacteria microcapsules
2.2 最陡爬坡实验结果
由表2可知,第1、2、3、4、5步爬坡实验的包埋率分别为42.56%、48.79%、68.79%、55.02%、53.55%。在爬坡实验的第三步附近时,微胶囊的包埋产率较高。因此可选择第三步实验中的因素水平作为Box-Behnken实验设计的中心点,即香蕉皮水不溶性膳食纤维含量45.00%、海藻酸钠浓度3.00%、卡拉胶浓度5.50%、搅拌时间30.00 min、低聚果糖浓度3.00%。
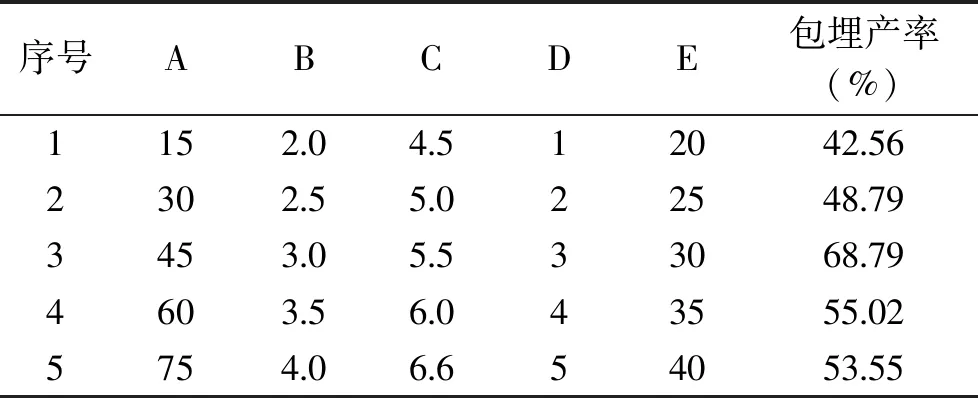
表2 双歧杆菌微胶囊最陡爬坡实验设计Table 2 Experimental design of the steepest climbing of Bifidobacteria microcapsules
2.3 响应曲面优化实验结果
2.3.1 回归模型的建立与分析 由表3可知,响应曲面优化实验共有46个试验点。应用软件Design Expert 10.0.1对实验结果进行回归拟合分析,可得到制备双歧杆菌微胶囊的拟合方程为:
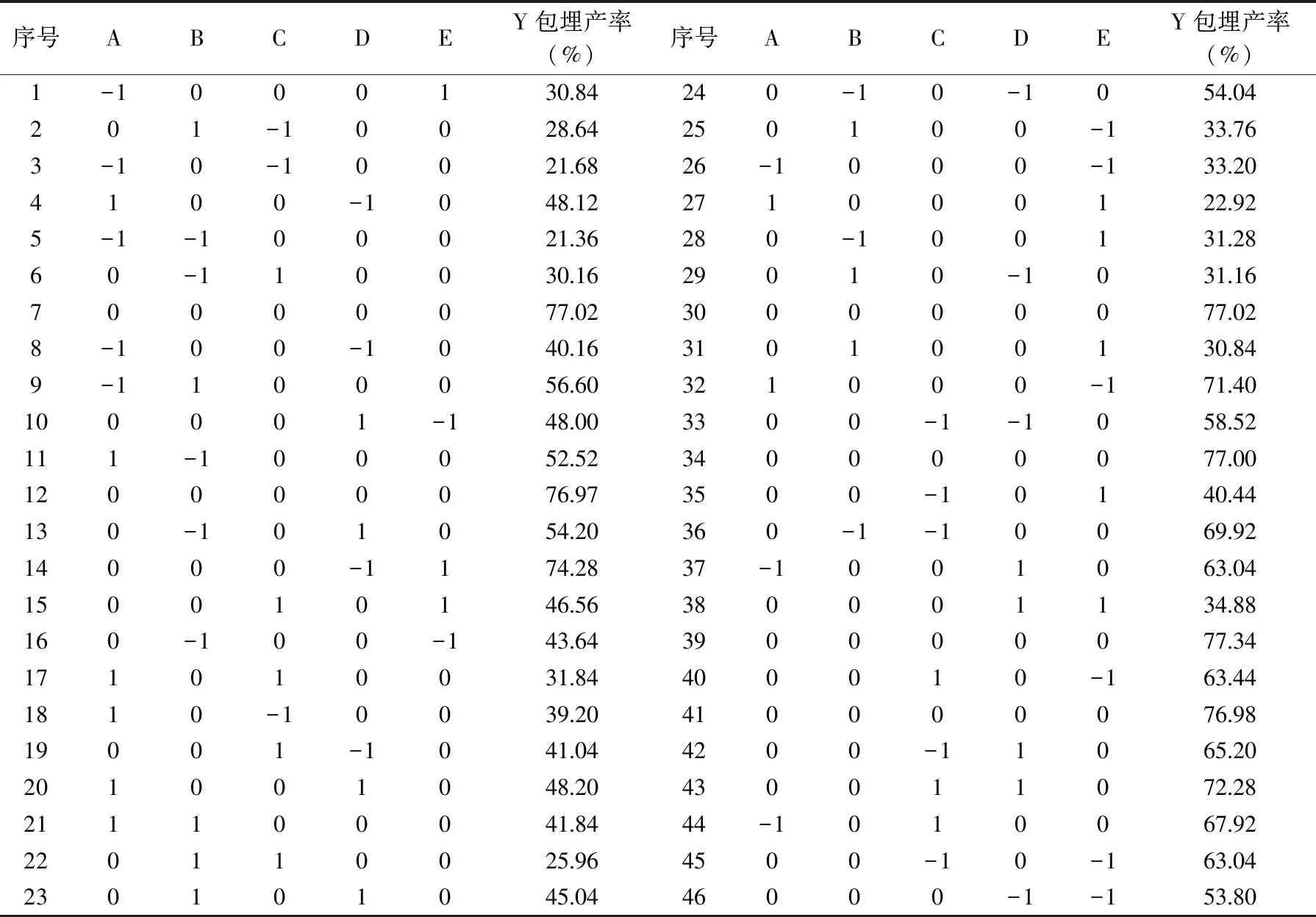
表3 响应面试验设计与结果Table 3 Experimental design and results of response surface
Y=77.00+7.57A-2.58B+1.63C-11.30D+1.84E-11.48AB-13.40AC-5.70AD-11.53AE+9.27BC+3.43BD+2.36BE+6.14CD+1.43CE-8.40DE-19.07A2-22.40B2-12.83C2-7.32D2-16.45E2+8.72A2B+8.09A2C+17.04A2D-14.55A2E-3.47AB2-12.21AC2-9.29AD2-12.24B2C+14.81B2D-5.66B2E-8.79BC2-5.43BD2+20.78C2D-11.71C2E
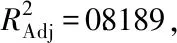
表4 回归方程系数显著性检验表Table 4 Significance checklist of regression equation coefficients
2.3.2 两因素间交互作用分析 图6是因素间显著和极显著交互项的响应曲面图,显示了香蕉皮水不溶性膳食纤维含量、海藻酸钠浓度、卡拉胶浓度、低聚果糖浓度和搅拌时间中任意三个因素取零水平时,其余两个因素对微胶囊包埋产率的影响。
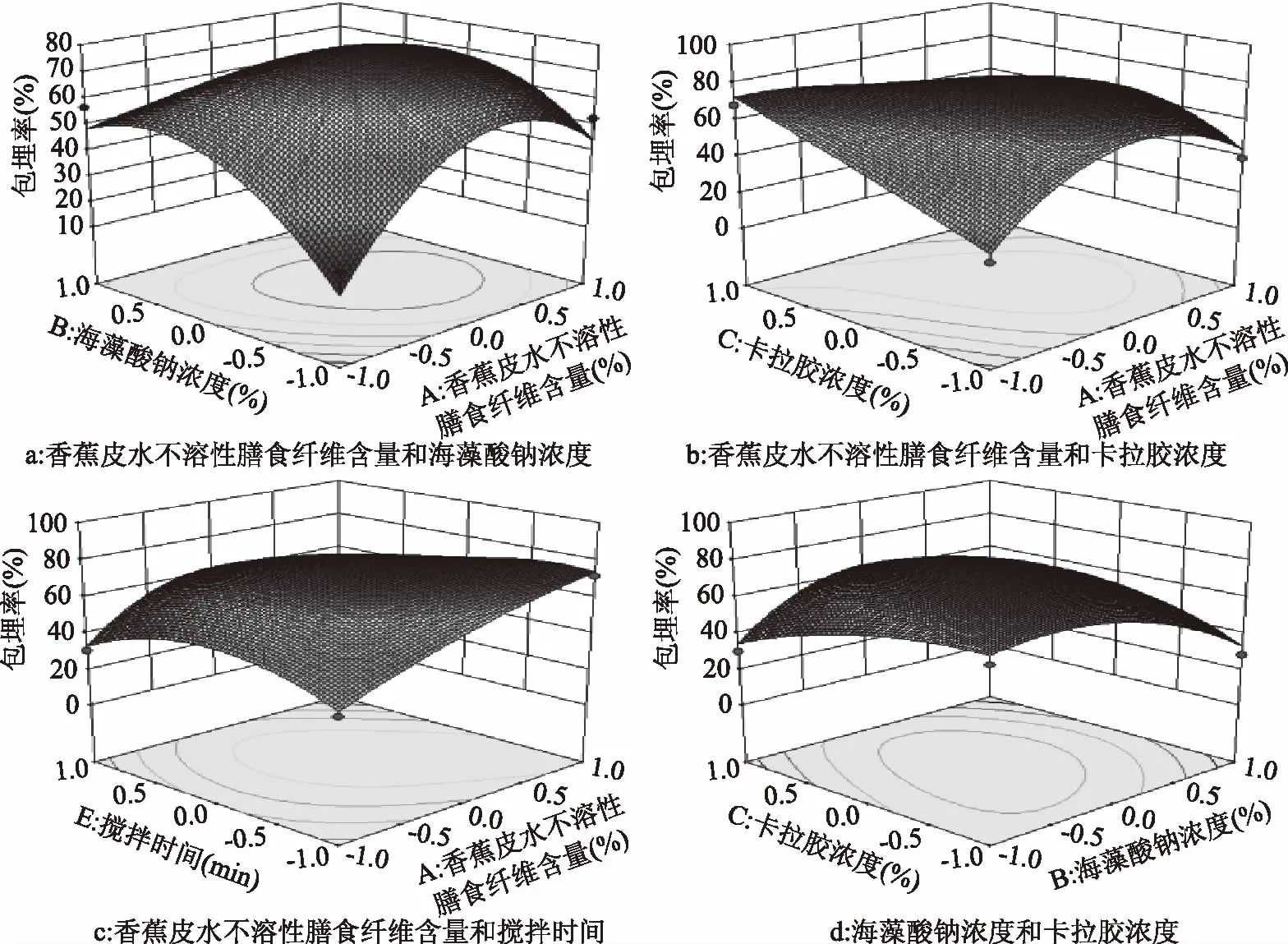
图6 交互项的两个变量对包埋产率影响的等高线与响应曲面图Fig.6 Contour lines and response surface maps of effects of two variables of the interaction term on embedding yield
响应面能直观反映各因素间的影响大小,曲面越陡峭,两因素之间交互作用越强[20]。由图6可知,A与B、A与C、A与E、B与C的响应面坡度较陡,说明交互作用较强,其他两因素之间交互作用则较微弱,几乎可以忽略不计。
2.3.3 最佳包埋条件的预测及验证实验 通过回归模型的预测,可得到双歧杆菌BB12微胶囊的最佳包埋工艺为:香蕉皮水不溶性膳食纤维含量45.69%、海藻酸钠浓度2.72%、卡拉胶5.61%、低聚果糖2.60%、搅拌时间31.13 min。此时微胶囊的理论包埋产率为73.06%。为了验证试验结果是否与真实情况相一致,进行了近似验证实验。最佳工艺条件修正为香蕉皮水不溶性膳食纤维含量46.00%、海藻酸钠浓度2.70%、卡拉胶5.60%、低聚果糖2.60%、搅拌时间31.00 min。在此条件下进行3 次平行试验,平均值为73.02%±0.54%,与微胶囊理论包埋产率的相差百分率为0.05%,表明最佳工艺条件的稳定性较好。
2.4 微胶囊表征与分析
2.4.1 红外光谱分析 由图7a可知,香蕉水不溶性膳食纤维在3454 cm-1处附近有宽而强的吸收峰,属于分子间或分子内的O-H伸缩振动峰;2851 cm-1处附近的吸收峰是糖环或支链上C-H(-CH2)伸缩振动峰;1592 cm-1的吸收锋属于苯环骨架伸缩振动峰;1156和1078 cm-1处附近的吸收峰属于纤维素和半纤维素结构中两种C-O伸缩振动峰,即C-O-H和糖环上C-O-C[21];894 cm-1处的吸收峰则是由β构型糖苷键引起的吸收峰,这些吸收峰都属于糖类的特征吸收峰[22]。由图7b可知,海藻酸钠在3277 cm-1处的吸收峰归属为-OH基的伸缩振动峰,1607和1419 cm-1处的吸收峰分别属于海藻酸钠的COO-的对称伸缩振动和不对称伸缩振动[23]。由图7c可知,卡拉胶在2926 cm-1有强的吸收带,是因C-H2的存在,1232 cm-1左右为硫酸酯基中S=O伸缩振动峰,930 cm-1为3,6-内醚半乳糖上的SO4(直立键)吸收峰,在848 cm-1为C4位硫酸根的吸收峰[24]。比较水不溶性膳食纤维、海藻酸钠与卡拉胶及壁材混合物的红外图谱(见图7d)可发现,壁材仍然可见水不溶性膳食纤维、海藻酸钠与卡拉胶的振动吸收,但1000~1600 cm-1范围波形与壁材单一成分不完全重合,1419、1232、1156 cm-1处吸收峰分别左移至1415、1222、1154,2995~3791 cm-1变为平滑的宽峰,可能与壁材成分之间形成了化学键有关。
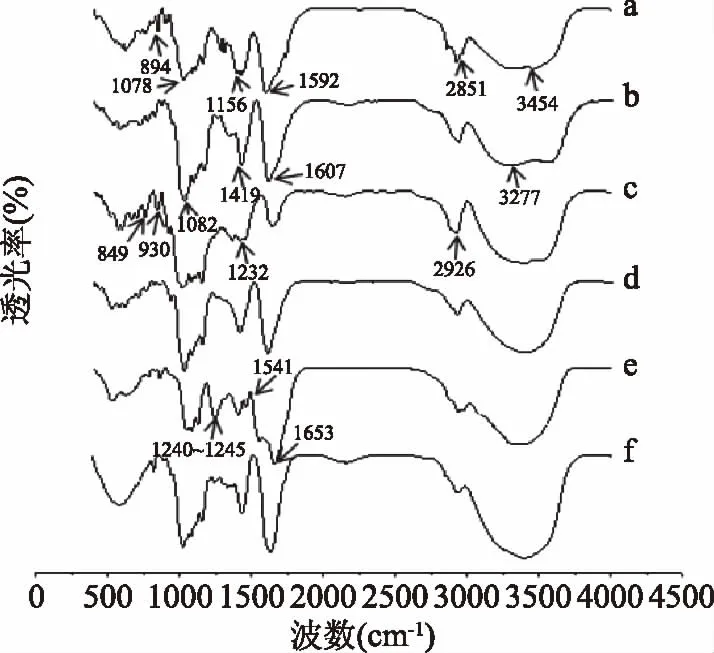
图7 壁材单一成分、壁材、芯材和微胶囊的红外光谱Fig.7 Infrared spectra of single composition,wall,core and microcapsules注:a:香蕉皮水不溶性膳食纤维,b:海藻酸钠,c:卡拉胶,d:壁材,e:芯材,f:微胶囊。
由图7e可知,芯材(双歧杆菌含蛋白质)在3000~3600 cm-1范围有吸收峰,属于形成氢键缔合的-OH伸缩振动吸收峰与-NH的伸缩振动吸收峰重叠而增宽的多重吸收峰;在1653 cm-1处的吸收峰,是蛋白质的酰胺I带吸收峰,C=O的伸缩振动;1541 cm-1为蛋白质的酰胺II带吸收峰,是-NH的弯曲振动和C-N的伸缩振动;1240~1245 cm-1是蛋白质的酰胺III带的吸收峰,由C-N的伸缩振动和N-H的弯曲振动引起的。酰胺I带、酰胺Ⅱ带、酰胺Ⅲ带是蛋白质的特征吸收峰[25]。由图7(f)可知,微胶囊也具有3000~3600 cm-1多重吸收峰和蛋白质的特征吸收峰;在1155~1439 cm-1范围吸收减弱,这可能是因为BB12进入壁材形成的空腔后振动受限导致[26]。红外光谱吸收的变化说明双歧杆菌包埋在复合壁材中形成微胶囊。
2.4.2 扫描电镜观察 挤压法制备的湿微胶囊,呈圆球状,直径为1~2 mm。湿胶囊经冷冻干燥后,用扫描电镜观察。由图8可看出,制得的双歧杆菌微胶囊粒径适中。整体上看,依然呈颗粒状,但边缘不是很工整。在较高的放大倍数下,微胶囊内部疏松多孔,可能是由于双歧杆菌微胶囊在真空冷冻干燥的过程中水分散失,造成微胶囊表面和内部的空洞较多[27]。

图8 微胶囊扫描电镜照片Fig.8 SEM micrographs of microcapsule
2.5 微胶囊功能特性分析
2.5.1 耐胃酸性质 由表5可知,微胶囊在未经人工胃液浸泡前,活菌数是9.09×106CFU/g;经人工胃液浸泡2 h后,活菌数下降到0.77×106CFU/g,仅下降了一个数量级。而双歧杆菌菌液的活菌数在人工胃液浸泡前后则发生巨大变化,活菌数从43.00×106CFU/g下降到0.00 CFU/g,表明人工胃液对未微胶囊化的双歧杆菌有很强的损害作用,而双歧杆菌微胶囊却能较好地抵御胃酸。这是因为双歧杆菌周围的凝胶体系为菌体提供了一道屏障。
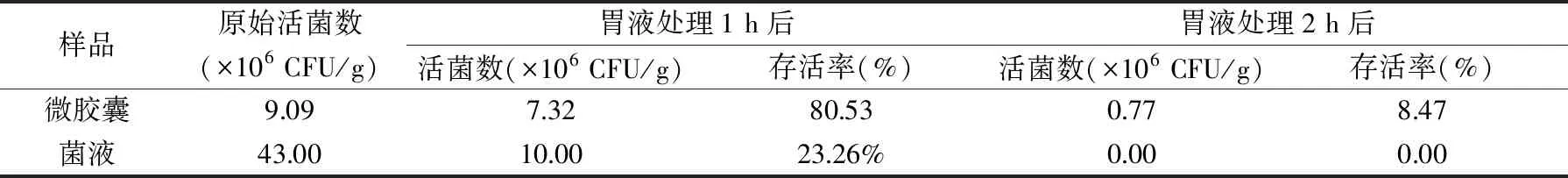
表5 在模拟胃液中菌液和微胶囊活菌数的变化Table 5 Changes in the number of viable bacteria of bacterial fluid and microcapsules in simulated gastric fluid
海藻酸钠是一种pH敏感性凝胶,在低pH下较为稳定[28];卡拉胶线性大分子内的结构排列及其大分子链节的荷电性,使得它具有强烈的反应性、可形成凝胶及高粘度溶液等优异性能[29];水不溶性膳食纤维则可以起到增强壁材的作用[30]。三者复合形成的壁材可减少胃酸对菌体的伤害,使得微胶囊化的双歧杆菌对胃酸的耐受力增强。
2.5.2 耐胆盐性质 由图9可知,随着胆盐浓度的提高,菌液和微胶囊的活菌数均下降,表明胆盐溶液对双歧杆菌有很强的损害作用。但微胶囊化处理的活菌数始终远远高于对照组,下降幅度较小。可见,微囊化的双歧杆菌对人工胆汁的耐受力远远大于未包埋保护的双歧杆菌。这与壁材的作用分不开,壁材可以增大胆盐溶液穿越的阻力,从而避免了胆盐与菌体直接接触。
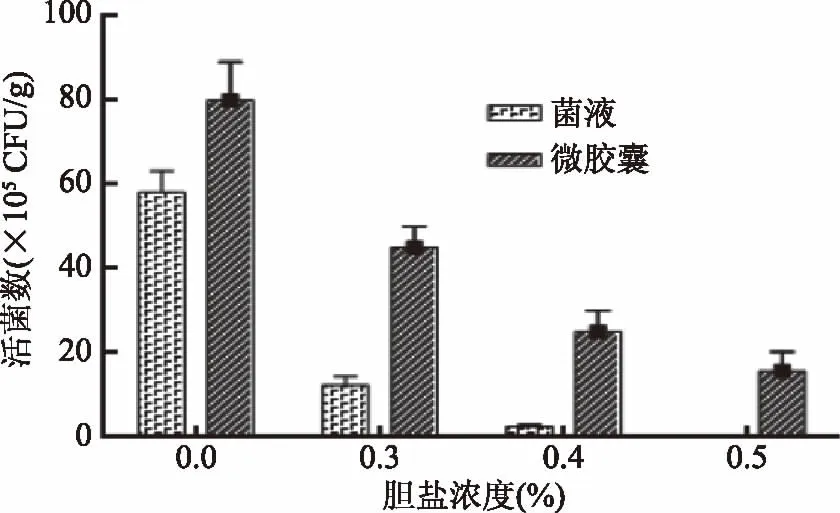
图9 不同浓度胆汁下菌液和微胶囊活菌数的变化 Fig.9 Changes in the number of viable bacteria of bacterial fluid and microcapsules in different concentrations of bile
2.5.3 肠道释放性 微胶囊经裂解,释放出双歧杆菌,会导致溶液内物质增多,透光率下降。由图10可知,微胶囊在人工模拟肠液中处理的前20 min,透光率迅速下降。20 min后,透光率基本稳定,说明大部分湿微胶囊在肠液中20~60 min即可完全崩解,有较好的肠溶性。这是因为海藻酸钙是依赖于Ca2+形成的可逆性凝胶,解囊液中存在与Ca2+结合能力更强的阴离子PO3-。一旦加入解囊液,Ca2+便会与这种阴离子结合,使凝胶体系破裂[31]。
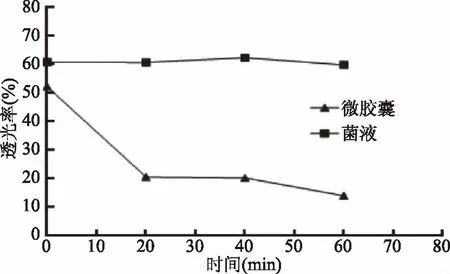
图10 在人工模拟肠液中微胶囊双歧杆菌的溶出 Fig.10 Dissolution of microcapsule Bifidobacterium in artificial simulated intestinal fluid
3 结论
以香蕉水不溶性膳食纤维-海藻酸钠-卡拉胶为复合壁材,添加低聚果糖作为保护剂,成功制备了双歧杆菌微胶囊,其最佳工艺条件为香蕉皮水不溶性膳食纤维含量46.00%、海藻酸钠浓度2.70%、卡拉胶浓度5.60%、低聚果糖浓度2.60%、搅拌时间31.00 min,此条件下,微胶囊的包埋产率为73.02%。影响包埋产率的因素重要性排序为D(低聚果糖浓度)>A(膳食纤维含量)>B(海藻酸钠浓度)>E(搅拌时间)>C(卡拉胶浓度)。红外光谱分析表明,壁材各成分之间可能发生了作用,形成了新的物质,双歧杆菌包埋在复合壁材中并形成微胶囊;扫描电镜显示微胶囊呈粒状,内部疏松多孔。在模拟消化的实验中,微胶囊化的双歧杆菌BB12在人工胃液、胆汁中的耐受性均高于未包埋保护的益生菌;微胶囊在人工肠液处理20 min后,透光率基本稳定,溶出性能良好。本研究能较好地解决双歧杆菌抵抗不良环境的能力差的问题,增强双歧杆菌的存活性能,可为双歧杆菌微胶囊在食品中的应用及开发新型益生菌产品奠定基础,且具有积极的生产实际意义。

