COX-2、VEGF及miRNA表达水平与食管鳞状细胞癌患者的临床疗效及预后的关系
吕 歆
食管癌是一种严重的消化道恶性肿瘤,组织病理学分型主要为食管鳞状细胞癌[1]。目前,食管鳞状细胞癌的发病机制尚不清晰,因此对该疾病发生发展过程中关键因子进行研究,为食管癌的诊断和治疗提供新的方向。研究表明,VEGF是调节淋巴管形成转移的关键信号通路[2]。另外COX-2的表达与淋巴结转移密切相关。近年来,分子生物学的研究发现,VEGF与COX-2表达量的改变与miRNA的表达量有相关性,其促进了癌细胞的增殖与转移[3]。为了进一步了解COX-2、VEGF及miRNA的表达水平与食管鳞状细胞癌患者的临床疗效及预后的关系,我院选择了120例患者进行相关研究,现报告如下。
1 材料与方法
1.1 一般资料
随机选择2014年1月至2016年1月我院收治确诊的120例临床资料完整的食管鳞状细胞癌患者作为观察组;并选择同期来医院体检的120例正常人为对照组。对照组男性67例,女性53例,年龄31~72岁,平均年龄(51.79±5.21)岁;观察组男性65例,女性55例,年龄32~73岁,平均年龄(52.06±5.17)岁。2组患者的平均年龄、性别比例无明显差异(P>0.05)。观察组患者均为初治患者,并在全麻下行食管癌根治术,术后病理证实为鳞癌,组织分化程度:低分化35例、中分化61例、高分化24例,按照1997年UICC分期标准,T1期26例,T2期45例,T3期37例,T4期12例。该研究符合医院伦理会研究标准。
纳入标准:患者参照我国卫生部2015年《原发性食管癌诊疗规范》[4]的诊断标准证实为食管鳞状细胞癌;预计生存期≥3个月;自愿入组且签署了知情同意书;患者接受手术治疗均不同意采取其他治疗方案。
排除标准:5年内患有其他肿瘤史的患者;哺乳期或妊娠期患者;有精神病史的患者。
1.2 方法
食管鳞状细胞癌患者均采用单纯根治性切除术治疗,并按患者治疗效果分为有效组和无效组。
采集患者病理组织标本,用甲醛固定,经过脱水,浸蜡,石蜡包埋等制作切边,厚度为4 μm。脱蜡,然后经水化,采用EDTA抗原修复COX-2、VEGF。最后,通用型免疫组化染色SP试剂盒,设置合适的COX-2和VEGF的工作浓度。将食管鳞状细胞癌细胞组织培养,利用Trizol试剂裂解提取癌组织RNA,严格按照说明书进行操作,利用紫外分光光度计滴定RNA浓度(主要测定的是miRNA-21的浓度)。原发病灶和复发转移病灶取自同一人进行对比。所有患者的基因检测均为病理。
1.3 观察指标
COX-2结果判断:COX-2阳性染色主要位于细胞质,呈棕黄色弥散性分布,观察核膜着色情况。用半定量法以肿瘤细胞的染色阳性率表示肿瘤的表达情况,以比例积分75%~100%计4分,50%~74%计3分,25%~49%计2分,<25%计0分。染色强度用0(阴性),1(弱阳性),2(阳性)表示。COX-2的表达水平用染色阳性率与染色强度乘积表示0~1分为(-),2~3分为(+),4~6分为(++),>6分为(+++)。
VEGF结果判断:按照文献方法,免疫组化染色以细胞质或细胞膜染成棕黄色为阳性。选择染色均匀的癌间质区,在400倍视野下,按着色细胞数占视野细胞数的百分比,未见阳性细胞为(-),阳性细胞<30%为(+),≥30%为(++)。(-)在数据处理中认为是阴性,(+)(++)(+++)在数据处理中为阳性。
临床疗效评价[5]:按照WHO制定的实体瘤疗效评价标准,将疗效分为完全缓解(CR)、部分缓解(PR)、无变化(NC)、进展(PD)。有效组为完全缓解与部分缓解的患者;无效组为无变化和进展的患者。
1.4 统计学方法

2 结果
2.1 对比2组参试者入院检查时的COX-2、VEGF与miRNA的表达含量
观察组患者的COX-2、VEGF、miRNA表达量高于对照组,差异具有统计学意义(P<0.05)。见表1。

表1 对比2组参试者入院检查时的COX-2、VEGF与miRNA的表达含量
2.2 对比COX-2、VEGF与miRNA表达量与食管鳞状细胞癌临床病理特征的关系
对比发现,食管鳞状细胞癌COX-2、VEGF与miRNA表达量与患者的年龄,性别及组织分化程度有轻微关系,但差异无统计学意义(P>0.05)。见表2。
2.3 对比治疗后有效组和无效组患者COX-2、VEGF与miRNA表达量
无效组的COX-2、VEGF、miRNA表达量明显高于有效组,差异有统计学意义(P<0.05)。见表3。

表2 对比食管鳞状细胞癌COX-2、VEGF与miRNA表达量与临床病理特征的关系

表3 对比治疗后有效组和无效组患者COX-2、VEGF与miRNA表达量
2.4 对比原发病灶和复发转移病灶间COX-2、VEGF与miRNA阳性表达率
对比食管鳞状细胞癌患者原发病灶的COX-2、VEGF与miRNA阳性表达率明显低于复发转移病灶患者,对比有统计学意义(P<0.05)。见表4。
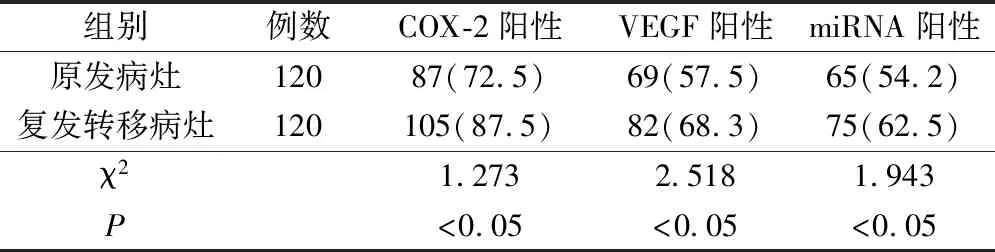
表4 对比原发病灶和复发转移灶间COX-2、VEGF与miRNA阳性表达率(例,%)
3 讨论
食管癌是食管腺体或黏膜上皮发生的恶性肿瘤,其发病率随年龄的增长而增加[5]。根据流行病学研究发现,食管癌在我国的发病类型主要是食管鳞状细胞癌[4]。肿瘤细胞通过对周围组织的直接浸润淋巴道、血道等途径转移。随着医疗技术的进步及研究的深入,食管癌根治性切除术能有效地改善患者的治疗效果,但由于淋巴结清除的局限性和隐匿性转移的存在,术后复发转移是患者手术治疗失败的主要原因[6]。临床上,为了寻找较好的监测患者治疗效果及预后的评价标准,分子生物学的发展提出对血清中COX-2、VEGF等物质的含量变化作为评价患者预后的标准[7]。
COX-2基因定位于1号染色体的lq25,由10个外显子和9个内含子构成,全长8.3 kb,由604个氨基酸缩合而成的多肽。COX-2是诱生型花生四烯酸的环氧酶代谢途径的限速酶,催化花生四烯酸转化为前列腺素[8-9]。正常状态下,COX-2在外界因素的刺激下会提升其表达量。近期研究证实,COX-2能通过加速细胞增殖,阻止细胞凋亡,增加生成新生血管,抑制患者免疫机制,加快肿瘤的增生和转移,也就是说COX-2在肿瘤的发生发展中起到重要作用[10]。VEGF基因位于染色体6p21,由7个内含子和8个外显子组成。VEGF由于其外显子剪切的不同而形成5种异构体。VEGF是肿瘤组织中最重要的促血管生成因子,参与肿瘤的生长增殖、分化及转移过程[11]。mi-RNA通过完全或部分与靶向mRNA的3'非翻译通过碱基对不完全或完全结合,抑制mRNA的翻译或切割降解,从而在转录后调节基因表达[12]。研究发现,miRNA在外周血肿能稳定存在,患者在不同时期、不同部位需要不同的蛋白发挥作用,一部分miRNA通过转录后诱导癌基因的过度表达,促进肿瘤增殖和转移。因此,一系列的mi-RNA在癌组织中的异常表达,使其成为诊断和评价临床疗效及预后的重要指标[13]。mi-RNA-21是miRNA的成员,其在多种肿瘤中异常表达,并参与肿瘤的发生发展。研究显示,mi-RNA-21在食管癌中表达水平升高,抑制食管癌患者正常细胞代谢,进而阻碍AKT和ERK信号通路的畅通[14]。
研究表明,观察组患者的COX-2、VEGF、miRNA表达量高于对照组。对比发现,食管鳞状细胞癌COX-2、VEGF与miRNA表达量与患者的年龄,性别及组织分化程度有轻微关系,与文献报道一致[15]。有效组患者的COX-2、VEGF、miRNA表达量低于无效组。对比食管鳞状细胞癌患者原发病灶的COX-2、VEGF与miRNA阳性表达率明显低于复发转移病灶患者。这表明,食管癌原发病灶和复发转移病灶之间存在这变化,表明COX-2、VEGF及miRNA在食管癌的发生发展中起重要作用。
综上所述,监测COX-2、VEGF联合miRNA表达水平,能有效预测食管鳞状细胞癌的临床疗效及预后情况,值得临床借鉴。

