p62基因沉默对宫颈癌Hela细胞生长和药物敏感性的影响
娄欢,马金平,武明莉,杨小风
(郑州大学附属郑州中心医院妇产科,河南 郑州 450000)
长期的临床随访研究认为,宫颈柱状上皮细胞癌的发生率可达374~583/10万人左右[1]。临床上宫颈癌患者容易早期发生淋巴结转移,远期生存转归较差,而无进展生存时间均较短[2]。不同的肿瘤相关基因或者相关蛋白,均能够影响宫颈癌细胞的特性,导致癌细胞的分化、耐药或者凋亡等病理特征的改变。P62基因是细胞自噬相关基因,P62基因的表达能够通过影响到细胞的自噬、癌细胞有丝分裂等过程,进而抑制癌细胞的凋亡,导致癌细胞有丝分裂速度的增快。P62基因的表达能够影响到内质网伴侣分子的表达,进而提高上皮细胞的核基因转录活性,导致癌细胞的扩增速度的增快[3]。部分研究者探讨了P62基因在鼻咽癌患者中的表达情况,认为P62基因的表达浓度的上升能够导致鼻咽癌细胞的浸润能力和复发风险的上升[4],部分研究者探讨了P63基因与宫颈癌的关系,但多数限于流行病学研究。为了揭示P62基因的表达与宫颈癌细胞的生物学特征关系,从而为临床上宫颈癌患者的临床诊疗提供理论基础,本次研究通过细胞基因水平的转染沉默P62基因表达后,观察了宫颈癌细胞的特征改变,报告如下。
1 材料与方法
1.1 材料 宫颈癌Hela细胞株为本院保存,短发夹RNA(shRNA)慢病毒载体购自上海吉玛制药技术有效公司。
1.2 实验方法
1.2.1 shRNA慢病毒载体转染 采用无内毒素质粒提取试剂盒提取和纯化P62抑制剂质粒及空白质粒,测定浓度,将宫颈癌Hela细胞铺于六孔板上,隔日更换DMEM高糖培养基,在细胞融合度为75%~80%时加入脂质体和构建的质粒,并进行p62-shRNA筛选,定期更换培养基清除死亡的细胞。检测药物耐药性前对照组、空白组及慢病毒转染组均给予 0.05mg/L、0.5mg/L 和 5mg/L 顺铂处理。
1.2.2 CCK法检测 在 96孔板中接种细胞悬液(100μL/孔),向每孔加入 10μL CCK8 溶液,将培养板在培养箱内孵育1~4h,用酶标仪测定在450nm处的吸光度,若暂时不测定OD值,可以向每孔中加入 10μL 0.1M 的 HCL溶液或者 1%w/v SDS溶液,24h内测定,吸光度不会发生变化。
1.2.3 RT-PCR检测 收集细胞进行裂解,收集细胞裂解液,加入 0.2ml的氯仿,2℃~8℃冰冻离心机中离心(12000g/min,15min),反复一次洗涤 RNA,弃上清,在管底部可见一乳白色小沉淀物,加入1ml 75%乙醇,0.1%DEPC水溶解。加入P62基因和GAPDH上下游引物、0.1%DEPC使其终浓度均为20pmol/ul,制备反应体系,RT-PCR扩增的条件与 参 数 :48℃ ,45min,94℃ ,2min;94℃ 30s,58℃60s,68℃ 2min共40个循环;循环完毕后68℃延伸7min。 ShRNA序列5’外侧cttgccacaggtctccccaa 3’外侧 aggggtcagaggcaagcaga。
1.2.4 流式细胞仪检测 采用annexin/PI法检测细胞凋亡,采用刮匙刮取培养基中的细胞,采用磷酸盐缓冲液洗涤3次,2000r/min离心10min,去除上清液。采用预先混合的缓冲液进行重新悬浮细胞,加入10ul的PI和10ul的annexin进行染色,混匀后4℃放置10min,采用流式细胞仪分析细胞凋亡情况。
1.3 统计学处理 统计分析采用SPSS 19.0软件,计量资料采用(x±s)表示,多组间比较使用方差分析或重复测量方差分析,两两比较采用LSD-t检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1 各组 p62 mRNA相对表达比较 p62-shRNA组p62 mRNA相对表达量明显低于对照组和空白shRNA 组(P<0.05),见表 1。

表1 各组p62 mRNA相对表达比较
2.2 各组Hela细胞增殖情况比较 p62-shRNA组培养24h、48h、72h细胞OD值明显低于对照组和空白 shRNA 组(P<0.05),见表 2。
2.3 各组Hela细胞凋亡率比较 p62-shRNA组细胞凋亡率明显高于对照组和空白shRNA组 (P<0.05),见表 3、图 1。
2.4 顺铂处理后各组细胞存活率比较 0.05mg/L、0.5mg/L和5mg/L顺铂作用下,p62-shRNA组细胞存活率明显低于对照组和空白shRNA组 (P<0.05),见表 4。

表2 各组Hela细胞增殖情况比较

表3 各组细胞凋亡率比较(%)

图1 流式细胞仪检测图
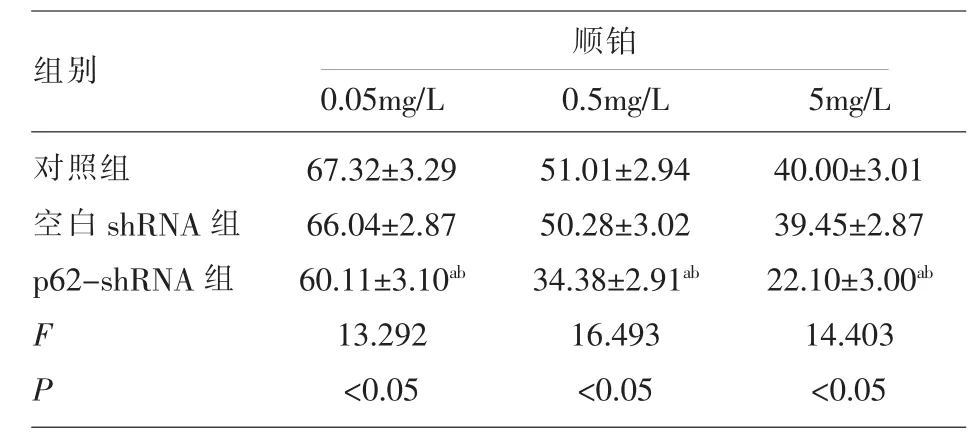
表4 顺铂处理后各组细胞存活率比较(%)
3 讨论
临床上宫颈癌的发生主要考虑与高危型HPV病毒感染导致的宫颈柱状上皮细胞持续性病变有关,流行病学研究证实,在HPV16或者HPV18感染的人群中,宫颈鳞状细胞癌的发生风险可进一步的上升[5,6]。长期的临床观察认为,宫颈癌患者的无进展生存时间不足34个月,综合性治疗措施治疗后的3年内病死率仍然超过了25%以上[7]。免疫靶向治疗能够在宫颈恶性肿瘤的治疗过程中发挥重要作用,其能够通过沉默相关基因或者蛋白的表达,进而抑制宫颈癌细胞的复发和转移,辅助治疗宫颈恶性肿瘤[8,9]。而本次研究对于宫颈癌细胞中P62基因功能的表达分析研究,能够为临床上宫颈癌的免疫靶向治疗提供参考靶点。
P62基因是调控细胞自噬和凋亡的基因,其表达的P62蛋白能够导致上皮细胞多种生物学特征的改变,导致上皮细胞的线粒体损伤、内质网功能障碍并促进细胞有丝分裂等过程。P62基因的高表达能够导致癌细胞对于基底膜组织的突破能力的增强,导致癌细胞间质成分的分解,从而促进了肿瘤细胞的扩散和转移[2]。基础领域相关的临床研究认为,P62基因的表达能够导致肿瘤干细胞活性的增强,提高肿瘤干细胞自我增殖能力,加剧了癌细胞的持续性扩增的风险[10]。
本次研究中通过对于P62基因进行沉默,可以发现沉默表达P62基因组的细胞株中P62基因表达水平明显的下降,提示了转染的成功。对于不同组别宫颈癌细胞株的生物学特征的分析可见,沉默表达P62基因的癌细胞,其增殖活性明显的下降,提示了P62基因对于维持宫颈癌细胞株的增殖特性具有重要的作用,通过汇集不同的相关文献,笔者认为P62基因对于宫颈癌细胞株增殖特性的维持作用,主要考虑与P62基因的下列几个作用有关[11,12]:⑴P62基因能够提高宫颈癌细胞核DNA上游启动子的活性,导致癌细胞的转录活性的增加;⑵P62基因能够通过激活宫颈癌细胞内的MAPK或者NOTCH信号通路,进而提高了宫颈癌细胞的增殖速度。梁冠男等[13]研究者也认为,在过度表达P62基因的宫颈癌中,癌细胞的浸润能力明显的增强,同时癌细胞的增殖速度明显加快,高于P62基因低表达的宫颈癌患者。在探讨P62基因对于宫颈癌细胞凋亡特性的影响过程中可以发现,P62基因沉默表达后,宫颈癌细胞的凋亡速度明显增加,高于P62未沉默表达组,差异较为明显,提示了P62基因对于宫颈癌细胞的凋亡具有显著的抑制作用,P62基因对于癌细胞凋亡的影响,主要通过对于内质网分子伴侣的影响,导致内质网氧化应激水平的改变,提高了线粒体的ATP合成活性,进而提高了癌细胞的增殖水平,抑制了肿瘤细胞的凋亡[14]。但部分研究者并不认为P62基因的表达与宫颈癌细胞的凋亡有关,认为P62基因负载后,宫颈癌细胞的凋亡比例并无明显的下降[15],这主要考虑与不同宫颈癌细胞株的选择或者P62基因的负载程度的差异有关。最后本次研究通过不同浓度的顺铂进行癌细胞的耐药性检测,可以发现顺铂处理后的各组细胞均存在明显的凋亡现象,但P62基因沉默组患者的细胞存活率较低,提示P62基因对于维持癌细胞的存活状态,提高癌细胞的存活能力具有重要的作用。
本次研究的创新性在于探讨了P62基因沉默表达后的宫颈癌细胞株的生物学特征的改变。综上所述,p62基因沉默可抑制宫颈癌Hela细胞增殖,促进细胞凋亡,增加对顺铂的敏感性。

