1H 核磁共振结合多元统计方法分析糟鸭加工过程中滋味化合物的变化
周楠楠,楼宵玮,王 颖,潘道东,孙杨赢,党亚丽,曹锦轩*
(浙江省动物蛋白食品精深加工技术重点实验室,宁波大学食品与药学学院,浙江 宁波 315211)
糟肉是我国的传统特色食品,以其典型的糟卤风味著称于世,广泛受到浙江、上海、江苏、广东等各地区人民的喜好。糟肉一般以猪肉、鸡肉、鸭肉、鹅肉、禽蛋、水产品等为原料,经过清洗、煮制后,低温腌制,最后经过干糟或者湿糟卤汁进行糟制而成。糟鸭是糟肉中的代表性产品,色泽洁白,口感细腻,风味浓郁。国内糟鸭的加工主要有2 种常见工艺类型,其中干糟是将腌制的鸭肉采用干酒糟直接糟制而成,而湿糟是将腌制的鸭肉浸入由鸭汤和酒糟、黄酒萃取制得的糟卤中浸泡制备。风味主要包括气味和滋味,作为食品的重要特性之一,滋味对产品的质量和消费者购买量具有重要影响[1]。大量研究表明,鸭肉和鸭肉制品中主要非挥发性滋味物质包括游离氨基酸、小肽、核苷酸等[2-3]。干糟和湿糟由于其不同的糟制方式,以及干糟和湿糟的糟制剂(酒糟和糟卤)化合物种类、含量不同,糟制剂扩散速率不同,会形成不同的滋味。目前,有关糟鸭加工过程中的小分子滋味化合物的相关文献较少,糟鸭滋味特征性化合物种类和含量并不清楚。
研究表明,基于1H核磁共振(1H nuclear magnetic resonance,1H NMR)的代谢组学技术,可以同时检测出样品中的多种小分子代谢物[4]。Graham等[5]研究牛肉成熟过程中核苷酸和游离氨基酸的NMR信号变化,发现宰后21 d成熟过程中12 种氨基酸含量显著升高。Castejón等[6]利用NMR分析宰后牛肉渗出液的代谢物含量,报道23 种不曾在肉制品中发现的化合物。Zanardi等[7]通过NMR识别辐照牛肉特有的代谢生化标示物主要有3 类:甘油、乳酸酯类和酪胺(或者p-取代酚类化合物)。与高效液相色谱-质谱联用和毛细管电泳质谱相比,NMR技术能够更快速地对目标物进行检测[8]。因此,该项技术被认为是一种先进的高通量代谢组学分析方法[5,9]。Liu Chunli等[3]采用NMR技术快速测定鸭肉中的代谢物,包括氨基酸、羧酸、糖类、核苷酸。Chen Daian等[4]基于NMR技术系统阐明糟带鱼中的小分子营养化合物,主要为有机酸、氨基酸、醇类、糖类。这些被NMR鉴定出的小分子化合物不仅是产品加工和贮藏过程中代谢物,也是肉制品中重要的滋味物质。然而,NMR技术能否适用于检测糟鸭加工过程中的滋味物质,仍缺乏相关研究。
鉴于此,本研究采用NMR技术,结合多元统计方法,分析糟鸭加工过程中的关键工序对小分子滋味物质含量的影响,以期阐明糟鸭产品的滋味形成机理。
1 材料与方法
1.1 材料与试剂
番鸭(日龄105~110 d,体质量(2 845±224)g),除去内脏的冷鲜白条鸭购买自宁波市乐购超市;3 a陈黄酒糟 嵊州市崇仁东升酒厂。
重水(D2O,99.9%)、三甲基甲硅烷基丙酸(3-(trimethylsilyl) propionic-2,2,3,3-d4acid sodium salt,TSP) 美国CIL公司;其他试剂(分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
组织均质仪 杭州奥盛仪器有限公司;冷冻离心机湖南湘仪实验室仪器开发有限公司;真空离心浓缩机美国Labconco公司;冷冻干燥机 德国Christ公司;AVIII 600 MHz NMR仪 德国Bruker公司。
1.3 方法
1.3.1 糟鸭加工工艺
20 只番鸭洗净,沿着胸膛肋骨中线一分为二,取10 个半胴体作为生鸭样品。剩余30 个半胴体按照料液比1∶2(g/mL)加入自来水,煮至大约15 min,鸭肉能被筷子扎透,取出自然冷却。鸭肉冷却后,用3%精盐抹匀,4 ℃低温腌制12 h。盐腌后取10 个半胴体作为盐腌样品,剩余20 个半胴体鸭肉分为2 组,一组用于制作干糟产品,另一组用于制作湿糟产品。
干糟产品糟制工艺:向酒糟中加入3%精盐拌匀,揉搓成团待用。陶罐底部铺上一层酒糟,罩上一层透气性良好的纱布,码一层鸭肉,交替码酒糟和鸭肉,酒糟和鸭肉质量比为1∶1,最上层以酒糟塞住瓶口,封上保鲜膜和陶罐盖。
湿糟产品糟制工艺:将酒糟和黄酒完全拌匀至没有结块为止,酒糟和黄酒料液比1∶1(g/mL)。糟酒混合物压滤,所得汁液为糟露。煮制坯料的汤汁撇去浮油,过滤待用。糟露、鸭肉汤汁、精盐、味精、酱油混匀即成糟卤,其中糟露10 L、鸭汤200 L、盐0.3 kg、味精0.03 kg、酱油0.13 L。将冷却后的盐腌鸭坯平铺于陶罐中,倒入糟卤使其高过肉面,封上保鲜膜和陶罐盖。
将干糟和湿糟产品的陶罐置于4 ℃,共糟制7 d得成品,分别各取10 只生鲜样品、盐腌鸭肉、干糟成品、湿糟成品为样本,重复数为10 个。选取鸭胸肉样品为测试对象,剔出胸肉,用锡箔纸包好,于-80 ℃贮存备用。
1.3.2 代谢化合物的提取
传统金融信用评估模型虽然可以在信用风险评估中具有一定评估作用,但是大数据的出现导致其数据出现了更多的信息维度。除了交易结构数据本身,还有大量的其他类型数据,如:企业水电数据、企业高管人员数据、相关企业信息数据等,上述数据均不兼容于传统评估模型,导致最终信息出入较大,所以必须设计新的金融信用评估模型。这就需要利用大数据下的信用评估分析,原理如图1所示。
称取0.4 g鸭胸肉样品,加入1 mL的甲醇-水(2∶1,V/V)混合液和1 g研磨珠于带盖破碎管中。在组织均质仪上以4 260 r/min破碎30 s,冰浴30 s,共重复5 次。取出后于4 ℃、12 000 r/min离心10 min,取上清液。重复加入甲醇溶液,破碎,离心。合并2 次离心所得的上清液,利用离心浓缩机除去有机溶剂后冷冻干燥。冷冻干燥后所得的代谢物重悬于550 µL Na+/K+缓冲液(0.15 mol/L,含有0.015% TSP和50% D2O,pH 7.4),4 ℃、12 000 r/min离心10 min后,取500 µL上清液于5 mm NMR核磁管中待检。每种样品做10 次重复实验。
1.3.3 NMR分析
样品1D1H NMR谱采集,在配备有超低温探头的Bruker AVIII 600 MHz NMR仪上完成,质子共振频率为600.13 MHz,实验温度为298 K。谱宽为δ20,等待时间为2 s,混合时间为80 ms,90°脉宽为18 μs,采样时间为1.36 s,采样点数为32 K,FID累加次数为32 次。
采用1D1H NMR谱上出峰较强的样品,分别检测1H J,1H-1H COSY,1H-1H TOCSY,1H-13C HMBC和1H-13C HSQ这一系列的2D NMR谱,从而对1D1H NMR谱上的信号进行归属。操作方法和相关参数参考课题组先前的实验方法[3]。各代谢物的指认根据与The Metabolomics Innovation Centre数据库比对来确定。
1.4 数据处理与分析
对1H NMR谱,使用TOPSPIN软件进行手动定内标和调平基线,使用AMIX软件将样品1H NMR谱从δ9.0~0.8按δ0.004分段进行积分,除去水峰(δ5.17~4.75)以及甲醇峰(δ3.38~3.35)所在化学位移区域。数据归一化处理后,导入SIMCA-P 12.0软件进行多元统计分析,进行主成分分析(principal component analysis,PCA)图和正交偏最小方差判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)。所有的OPLS-DA模型采用CV-ANOVA进行检验[9],P<0.05,差异显著。代谢物的相关系数图使用MATLAB 7.1软件所得。代谢物含量测定,根据其非重叠信号峰面积与已知浓度内标TSP比值计算,具体计算公式和过程参考Dai Hui等[10]的方法。
不同工艺点各代谢物含量,采用SAS 8.0中one-way ANOVA的Duncan's multiple range test模型进行统计学分析,P<0.05,差异显著。
2 结果与分析
2.1 1H NMR分析
图1为生鸭肉(A)、干糟产品(C)和酒糟(E)的1H NMR图谱。2D NMR谱对代谢物的信号归属结果如表1所示。本实验中检测到鸭肉和糟制剂中的代谢物共34 种,包括15 种氨基酸(异亮氨酸、亮氨酸、缬氨酸、苏氨酸、丙氨酸、焦谷氨酸、赖氨酸、谷氨酸、谷氨酰胺、天冬氨酸、精氨酸、牛磺酸、甘氨酸、酪氨酸、苯丙氨酸)、6 种有机酸(乳酸、乙酸、琥珀酸、肌酸、肌酸酐、甲酸)、2 种糖(葡萄糖、麦芽糖)、6 种核苷酸及其衍生物(尿嘧啶、尿苷、胞苷酸(5′-cytidine monophosphate,5′-CMP)、次黄嘌呤、肌苷、肌苷酸(5′-inosinate,5′-IMP))、2 种醇(乙醇、2,3-丁二醇)、3 种碱(胆碱、甜菜碱、甘油磷酸胆碱)。大部分物质在关于鸭肉代谢物和糟带鱼代谢物的研究中已有报道[3-4]。

图1 生鸭肉(A)、干糟产品(C)和酒糟(E)的1H NMR谱图Fig. 1 Representative 1H NMR spectra of metabolites extracts from raw duck (A), dry vinasse-cured duck (C) and vinasse (E)

表1 鸭肉和酒糟的NMR信号归属Table 1 NMR data of metabolites detected in vinasse-cured duck and vinasse
2.2 PCA结果
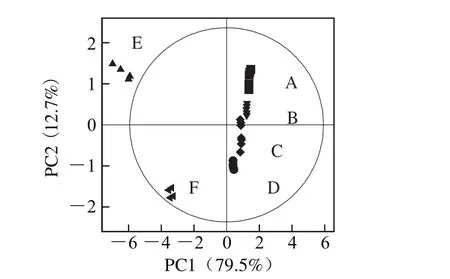
图2 糟鸭加工过程中代谢物的主成分分析图Fig. 2 PCA plot for metabolites of vinasse-cured duck during processing
2.3 糟鸭加工过程中代谢物的变化
OPLS-DA模型的准确性采用R2X和Q2评估,CV-ANOVA的结果用p值体现。这3 个数值均体现组间结果的显著性和模型可信度。本研究中,相关系数大于0.602被认为存在显著差异。向上的峰代表在后者样品中该代谢物的含量高于前者,反之亦然。系数图中代谢物峰的颜色越红,代表两者之间的差异越显著。
如图3所示,在煮制、盐腌过程中,鸭肉中的琥珀酸、肌酸酐、胆碱、次黄嘌呤含量升高,而氨基酸、乳酸、肌酸、甘油磷酰胆碱、糖类、肌苷、5′-IMP含量下降。在干糟过程中,鸭肉中的氨基酸、醇类、甲酸、乙酸、有机碱、糖类、肌苷含量升高,而肌酸、肌酸酐含量下降。在湿糟过程中,鸭肉中的氨基酸、醇类、甲酸、乙酸、有机碱、葡萄糖含量上升,而乳酸、琥珀酸、肌酸、肌酸酐、麦芽糖、5′-IMP含量下降。和干糟产品相比,湿糟产品的氨基酸、醇类、甲酸、乙酸、有机碱、葡萄糖含量较高,而乳酸、琥珀酸、肌酸、肌酸酐、麦芽糖、5′-IMP含量较低。
如表2所示,鸭肉中含量最高的物质为天冬氨酸、乳酸、肌酸、葡萄糖和5′-IMP。Chen Daian等[4]在糟带鱼中同样测定出含量最高的物质为乳酸、肌酸和葡萄糖。除琥珀酸、肌酸酐、胆碱、次黄嘌呤外,大多数代谢物的含量在煮制盐腌过程中下降(P<0.05)。糟制过程促使糟鸭中的氨基酸、醇类、甲酸、乙酸、甘油磷酸胆碱、葡萄糖含量上升(P<0.05),但使其他酸类含量下降(P<0.05)。湿糟比干糟对糟鸭滋味含量变化影响更显著(P<0.05),这可能是因为湿糟渗透比干糟迁移速率更快。糟鸭中代谢物含量结果与OPLS-DA结果一致。
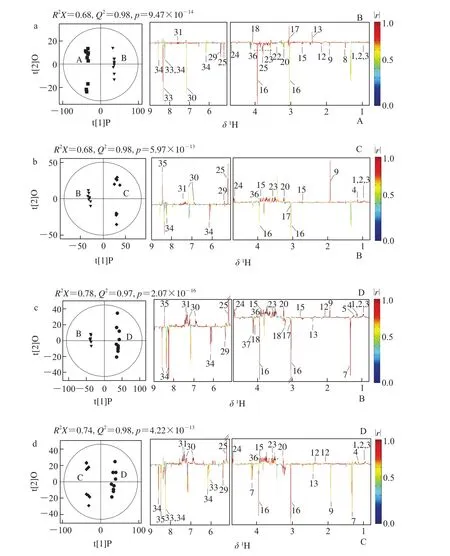
图3 生鸭肉和盐腌鸭肉(a)、盐腌鸭肉和干糟产品(b)、盐腌鸭肉和湿糟产品(c)、干糟产品和湿糟产品(d)的正交偏最小方差判别分析Fig. 3 OPLS-DA results generated by comparisons of spectra between raw duck and salted duck (a), salted duck and dry vinasse-cured duck (b),salted duck and wet vinasse-cured duck (c), and dry and wet vinasse-cured duck (d), respectively
表2显示,酒糟和糟卤中含有大量与糟鸭产品滋味物质相同的代谢物,如异亮氨酸、亮氨酸、缬氨酸、丙氨酸、乙醇、乳酸、葡萄糖等。这些物质在糟制过程中能够通过扩散作用渗透进鸭肉中,形成糟鸭的特征滋味。此外,由于酒糟是黄酒酿造后留下的残渣以及黄酒生产中的发酵剂,酒糟中会残留多种黄酒发酵所需的微生物,如酵母、真菌和细菌[11]。这些微生物可能在糟制过程中发挥作用,分泌特定的酶,从而影响糟鸭中代谢物的变化。
根据OPLS-DA和定量分析的结果,几乎所有的氨基酸含量在煮制盐腌过程中下降,糟制过程中上升。此结果与盐水鸭加工过程中游离氨基酸的报道[12]一致,盐水鸭在盐腌和煮制过程中,游离氨基酸含量均呈现下降趋势。Dai Yan等[13]研究同样显示,南京盐水鸭在经过热处理后,其游离氨基酸含量也会减少。但是,在板鸭加工过程中氨基酸变化研究中,盐腌促使游离氨基酸含量的增加,可能原因是加工工艺的差异以及游离氨基酸含量在煮制过程中剧烈下降。
在煮制和盐腌过程中,鸭肉中的游离氨基酸会参与反应,生成挥发性风味化合物或者降解成其他物质[14],与挥发性化合物变化的结果一致。对于酒糟中含有的氨基酸,糟鸭在糟制后均有显著升高,因此,这些氨基酸可能来源是糟制剂[15]。对于酒糟中未被检出的氨基酸,糟鸭在糟制过程中这些物质含量的升高可能归因于鸭肉中残留的内源蛋白酶以及酒糟中真菌和细菌分泌的蛋白水解酶[16-17]。糟鸭中含量最高的游离氨基酸是丙氨酸(干糟产品:0.38 mg/g;湿糟产品:0.31 mg/g)、天冬氨酸(干糟产品:2.06 mg/g;湿糟产品:3.15 mg/g)、牛磺酸(干糟产品:0.95 mg/g;湿糟产品:1.03 mg/g)、甘氨酸(干糟产品:0.28 mg/g;湿糟产品:0.31 mg/g),其中丙氨酸和甘氨酸呈甜味[18],天冬氨酸呈鲜味[19]。糟鸭中的苦味氨基酸,比如亮氨酸、异亮氨酸、酪氨酸等[20],其呈味作用可以被糖、盐等物质抑制[21]。通过比较滋味阈值[22]可知,天冬氨酸对糟鸭的鲜味贡献较大。

表2 糟鸭加工过程中代谢物含量及OPLS-DA相关系数Table 2 Correlation coef fi cients from OPLS-DA and metabolite contents in vinasse-cured duck extracts at different sampling time points
酒糟和糟卤中含有大量的葡萄糖[23]。此外,糟制剂中含有酿酒酵母和芽孢杆菌可以分泌淀粉酶和葡聚糖酶等[11]。因此葡萄糖的增加可能来源于糟制剂,以及糟制过程中多糖的分解[24]。麦芽糖在干糟和湿糟过程中含量降低,可能是因为糟制剂中残留的麦芽糖酶将其发酵分解成葡萄糖[25]。代谢物中醇类和酸类的变化与碳水化合物发酵有关[26]。有研究报道,酒的发酵剂中含有大量的酿酒酵母和乳酸杆菌[27]。这些化合物会参与发酵,将葡萄糖转化成丙酮酸,而后再代谢成醇类和酸类[4]。乙酸、甲酸、乙醇、2,3-丁二醇在糟制期间含量升高,主要源于糟制剂渗透和微生物发酵[28]。此外,肌酸和肌酸酐含量的下降有可能是分解生成精氨酸、甘氨酸和甲硫氨酸[29]。
肌苷和磷酸构成5′-IMP,次黄嘌呤和核糖构成肌苷[30]。在煮制盐腌过程中,5′-IMP和肌苷含量下降,次黄嘌呤含量上升,说明5′-IMP和肌苷降解生成次黄嘌呤[31]。在糟制过程中,5′-IMP和肌苷进一步降解生成次黄嘌呤。上述变化说明糟鸭加工过程中与核苷酸有关的鲜味物质显著下降。
3 结 论
本研究采用NMR检测糟鸭、糟制剂中的滋味成分,共测出34 种物质,包括14 种氨基酸、7 种有机酸、2 种糖、6 种核苷酸及其衍生物、2 种醇、3 种碱。糟鸭加工过程中,氨基酸、醇类、碱类、糖类含量在煮制、盐腌过程中下降,糟制过程中上升。甲酸、次黄嘌呤持续升高,而乳酸、肌酸、5′-IMP和肌苷含量则持续下降。湿糟比干糟过程对滋味化合物含量的影响更显著。糟鸭加工过程中的代谢物含量变化与蛋白质、多糖降解,滋味物质渗透以及糟制剂中残存微生物和酶作用有关。

