茶多酚-高直链玉米淀粉 共研磨混合物的制备与结构表征
,,*,,,*,,,
(1.天津科技大学生物工程学院,工业发酵微生物教育部重点实验室,天津 300457; 2.中国人民解放军军事科学院军需装备研究所,北京 100010)
淀粉是由直链淀粉和支链淀粉两种天然聚合物组成的。为了克服天然淀粉自身的缺点或扩大其在工业领域的应用范围,需要对其进行改性[1-2]。到目前为止,淀粉改性的方法主要包括物理、化学和生物法[3]。近年来,球磨处理作为一种低成本和环境友好的物理改性技术已经广泛用于淀粉的改性[4]。例如,喻弘等[5]采用星式球磨机对3种淀粉(玉米淀粉、木薯淀粉和籼米淀粉)进行球磨改性,结果随着球磨时间的增加,淀粉颗粒逐渐破碎,淀粉粒度逐渐减小;这3种淀粉的还原力、冷水溶解度、透明度均逐渐增加,淀粉的表观黏度、结晶度逐渐减小。Tan等[6]探讨了湿法球磨对玉米淀粉理化性质和糊化特性的影响,结果发现球磨后淀粉的结晶结构发生改变,糊化温度和最大粘度减小。Zhang等[7]研究了球磨过程中大米淀粉分子量分布和碘兰值最大吸收波长的变化,发现球磨过程中大米淀粉的直链淀粉分子和支链淀粉分子均发生了断裂。陈玲等[8]研究了机械球磨对马铃薯淀粉酶反应活性的影响,发现微细化可以提高淀粉颗粒对酶的敏感性,增加反应活性。Zhang等[9]发现玉米淀粉经过球磨处理后,淀粉的结晶结构被破坏,糊化温度和峰值粘度随着研磨载荷的降低而降低,并且球磨后提高了淀粉与交联剂的反应活性。然而,这些球磨改性研究主要集中在对淀粉单一组分的处理方面,未见与其它小分子活性组分共研磨的报道。
茶多酚(Tea Polyphenols)是茶叶中多酚类物质的总称,其主要成分包括儿茶素类、黄酮类、黄酮醇类、酚酸类、缩酚酸类及聚合酚类等。其中儿茶素可以抑制α-淀粉酶的活性[10],减少淀粉分解后葡萄糖在小肠的吸收[11]。因此,本文旨在尝试茶多酚与淀粉混合物的共研磨,探讨茶多酚存在下球磨处理对淀粉理化性质和消化性能的影响。
1 材料与方法
1.1 材料与仪器
高直链玉米淀粉 山东华农特种玉米开发有限公司;茶多酚 无锡世纪生物公司;猪胰α-淀粉酶、糖化酶 Sigma公司;磷酸氢二钠、氢氧化钠、3,5-二硝基水杨酸、酒石酸钾钠、苯酚等 均为分析纯,天津市风船化学试剂科技有限公司。
XQM-0.4型星式球磨机 湖南长沙天创粉末科技有限公司;722s型紫外分光光度计 上海精密科学仪器有限公司;Philips XL-30型扫描电子显微镜 荷兰飞利浦公司;Shimadzu TGA-50型热重分析仪 日本Kyoto公司;Rigaku D/max 2500型X-射线衍射仪 日本理学株式会社;Vector-22型傅立叶变换红外分析仪 德国布鲁克仪器公司;BS-2FS型立式恒温恒湿摇床 苏州威尔实验用品有限公司。
1.2 实验方法
1.2.1 茶多酚-淀粉混合物的共研磨处理 茶多酚-淀粉混合物的共研磨参考文献[6]。采用星式球磨机制备茶多酚-淀粉共研磨混合物(茶多酚与高直链玉米淀粉质量比为1/12)。将高直链玉米淀粉、茶多酚置于陶瓷罐(100 mL)中,按混合物总质量的5%加入蒸馏水,再加入不同直径(5、10和15 mm)的氧化锆球。将球磨机负荷设定为15.0 g,材料(淀粉和茶多酚):水:氧化锆球为1.5∶1∶4.5(质量比),转速350 r/min的条件下,球磨处理1、1.5、2、2.5、3 h。通过共研磨混合物的X-射线衍射确定最优球磨时间后,制备不同质量比的茶多酚-淀粉共研磨混合物,设定其质量比茶多酚/高直链玉米淀粉为1/10、1/12、1/16、1/25、1/50。球磨操作步骤完成后,将所得产物在40 ℃,真空度小于133 Pa的真空干燥箱中干燥12 h,研磨并过100目筛。
1.2.2 茶多酚-淀粉共研磨混合物的X-射线衍射分析(XRD) 采用连续扫描法,对不同球磨时间的茶多酚-淀粉共研磨混合物进行测定,测定条件如下:实验条件[12]:Cu-Κα1(λ=0.1541 nm)、电压40 kV、电流25 mA、2θ起始角5 °、终止角60 °、扫描速度12 °/min。
1.2.3 茶多酚-淀粉共研磨混合物的扫描电子显微镜分析(SEM) 在SEM样品台上贴上导电胶,用药匙分别将少量球磨不同时间的茶多酚-淀粉共研磨混合物均匀的撒在导电胶上,然后喷金观察。加速电压20 kV,放大1000倍[13]。
1.2.4 茶多酚-淀粉共研磨混合物的热重分析(TGA) 分别称取10 mg茶多酚、高直链玉米淀粉与茶多酚-淀粉共研磨混合物样品置于热重分析仪的铂金坩埚中,起始温度和终止温度分别为:25 ℃、600 ℃,升温速率为10 ℃/min,氮气作为保护气,氮气流速60 mL/min。
1.2.5 茶多酚-淀粉共研磨混合物的体外消化性测定实验 体外消化性能的评价主要参考Shin[14]的方法并稍作修改。具体操作步骤如下:取200 mg样品、15 mL pH6.8磷酸盐缓冲溶液于锥形瓶中,在37 ℃、120 r/min转速恒温摇床上平衡5 min,然后倒入透析袋中,并加入10 mLα-淀粉酶(280 U/mL)、1 mL糖化酶(2500 U/mL),水解0、20和120 min,分别取样1 mL采用DNS法测定葡萄糖含量,重复3次实验,计算平均值。快消化淀粉(RDS)、慢消化淀粉(SDS)、抗性淀粉(RS)的含量根据以下公式计算。
RS(%)=1-RDS-SDS
式中:A为酶水解处理前淀粉中游离葡萄糖质量(mg);B、C为淀粉酶水解20、120 min后产生的葡萄糖质量(mg);D为样品中总淀粉质量(mg)。
1.2.6 数据处理 实验数据以平均值±标准差(Mean±SD)表示。采用SPSS 19.0软件和Origin 8.5软件处理实验数据,结果取三次实验的平均值。显著性检验方法为邓肯式(Duncan)多重比较,p<0.05为差异显著。
2 结果与分析
2.1 茶多酚-淀粉共研磨混合物的XRD分析
图1为高直链玉米淀粉和不同球磨时间的茶多酚-高直链淀粉共研磨混合物的X-射线衍射谱图。由图1可知,高直链玉米淀粉(图1a)在15、17、18和23.5 °处有强衍射峰,是典型B型淀粉特征[15]。随着球磨时间的增加,茶多酚-高直链玉米淀粉共研磨混合物的结晶衍射峰逐渐减弱,经3 h的球磨处理后,茶多酚与高直链玉米淀粉共研物中淀粉在17°和22°处的衍射峰几乎消失,结晶度由38.1%降低到8.3%。因此,茶多酚-高直链玉米淀粉混合物共研磨后淀粉的结晶结构被破坏。这个实验结果与球磨处理单一玉米淀粉的结果一致[4]。
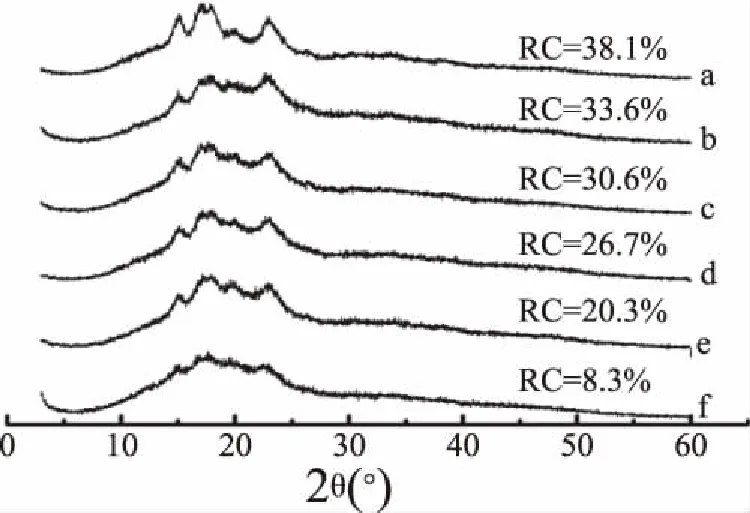
图1 高直链玉米淀粉、茶多酚/高直链玉米淀粉 共研磨混合物的X-射线衍射图Fig.1 X-ray diffraction patterns of high-amylose maize starch(HAMS)and tea polyphenols(TPs)-HAM co-grinding mixtures.注:a为高直链玉米淀粉;b~f分别表示球磨时间为: 1、1.5、2、2.5、3 h。RC为相对结晶度。
2.2 茶多酚-淀粉共研磨混合物的SEM分析
图2为高直链玉米淀粉和不同球磨时间茶多酚/高直链玉米淀粉(1/12)共研磨混合物的扫描电镜照片。由图2可知,高直链玉米淀粉颗粒呈无规则多面体,表面相对光滑,颗粒分布相对紧密。当茶多酚/淀粉混合物经过共研磨后,茶多酚与高直链玉米淀粉通过压力相互粘连缔合成团,高直链玉米淀粉的多面体形状被压扁,形貌明显发生改变,由于茶多酚的嵌入;由图2(a~f)可以看出,混合物颗粒是一个从分散到聚集,再由聚集到分散的过程。球磨后混合物颗粒的直径增加,颗粒形状的规则性变差,颗粒表面变得相对粗糙。
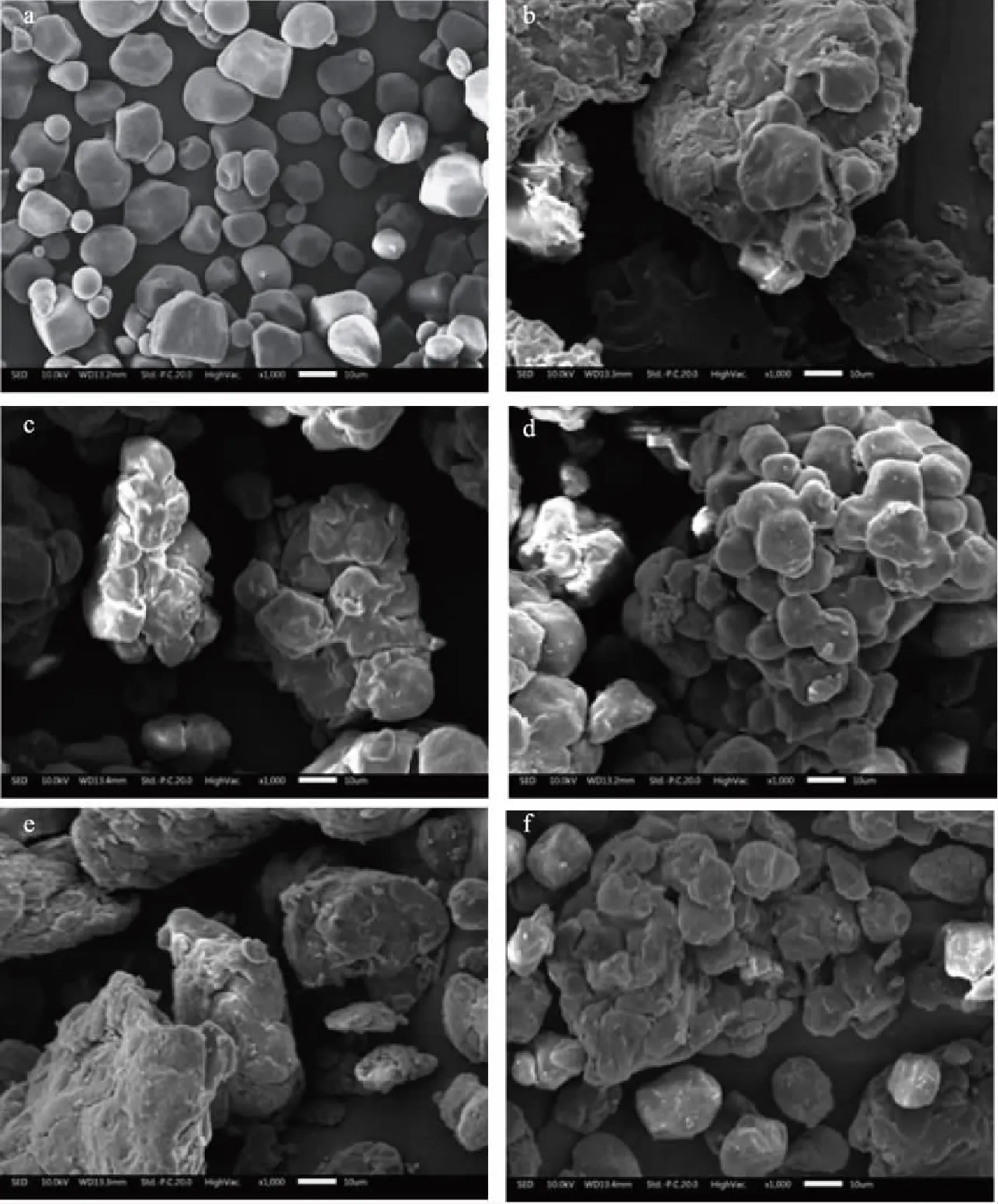
图2 高直链玉米淀粉、茶多酚/高直链玉米淀粉共研磨混合物的扫描电镜照片(1000×)Fig.2 SEM photos of high-amylose maize starch(HAMS)and tea polyphenols(TPs)-HAMS co-grinding mixtures(1000×)注:a为高直链玉米淀粉;b~f分别表示球磨时间为:1、1.5、2、2.5、3 h。茶多酚/高直链玉米淀粉(1/12)。
2.3 茶多酚-淀粉共研磨混合物的热稳定性分析
图3为茶多酚、高直链玉米淀粉和茶多酚/高直链玉米淀粉(1/12)共研磨混合物(球磨时间3 h)的热重分析曲线。由图3可知,茶多酚(曲线a)有两个失重阶段,第一个是大约在100 ℃以前,这是茶多酚中游离水和结合水分损失的过程;第二阶段是大约在250~320 ℃,这是茶多酚中活性成分损失引起的。高直链玉米淀粉(曲线c)为两个失重阶段,但第二阶段失重的起始温度为320 ℃,远远高于茶多酚第二阶段失重的起始温度,这说明高直链淀粉的热稳定性比茶多酚好。而茶多酚-高直链玉米淀粉共研磨混合物(曲线b)也有两个平台期,分别是室温到100 ℃前和250~300 ℃。第一阶段是由失水引起的失重,第二阶段是淀粉碳化和茶多酚的热分解导致分子重量急剧下降。相对于高直链玉米淀粉的热分解曲线,共研磨混合物的热稳定性降低,但相对于茶多酚热分解曲线,共研磨混合物的热分解起始温度较高,分解时间长,对茶多酚起到一个保护作用,热稳定性提高。
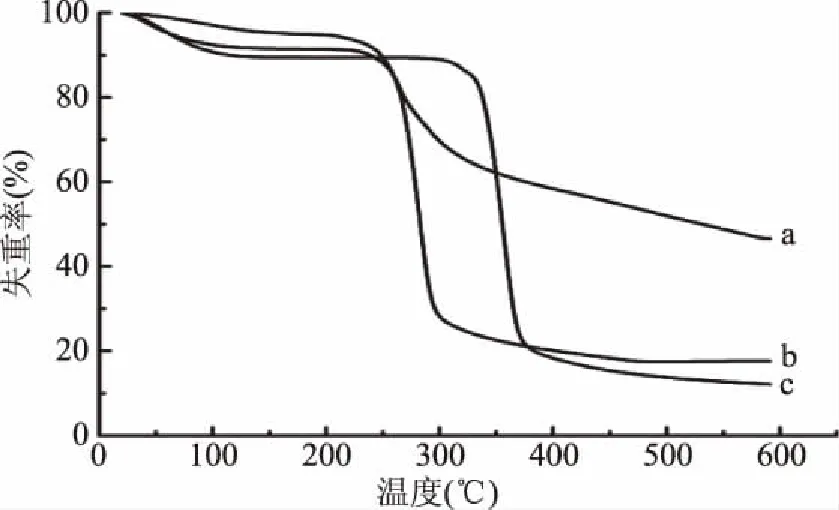
图3 茶多酚、高直链玉米淀粉和茶多酚/高直链 玉米淀粉共研磨混合物的热重曲线Fig.3 TG curves of tea polyphenols,HAM and TP-HAM co-grinding mixtures注:a. 茶多酚;b. 茶多酚-淀粉共研磨混合物; c. 高直链玉米淀粉。
2.4 茶多酚-淀粉共研磨混合物的RDS、SDS和RS分析
餐后血糖的应答很大程度上取决于RDS的含量,RS和SDS含量控制低血糖控制指数(GI)的升高,RS的含量升高代表抗消化性能增加。球磨处理对高直链玉米淀粉的颗粒表面和结晶结构均造成了破坏,以至于不同球磨时间的共研磨混合物消化性均高于原淀粉的消化性,对不同质量比的茶多酚-高直链玉米淀粉共研磨混合物进行体外消化性的测定。表1为不同比例茶多酚-高直链玉米淀粉共研磨混合物的RDS、SDS和RS含量。由表1可以看出,研磨后RDS含量范围在1.98%~6.21%,SDS含量范围在61.87%~91.71%,RS含量范围在6.31%~31.92%。所有比例的茶多酚-淀粉共研磨混合物中SDS的含量最高、变化范围最大,并且随茶多酚比例的增加而减小;而RDS的含量随茶多酚比例的增加而增加,RS含量随茶多酚比例的增加而增加,其最高值为31.92%。RS增加的原由一方面由于茶多酚与高直链玉米淀粉通过氢键发生相互作用,使得淀粉和茶多酚相缔合,单一的淀粉分子减少,从而使RS含量增加;另一方面由于茶多酚本身有抑制α-淀粉酶和α-葡萄糖苷酶的活性,从而降低高直链玉米淀粉的水解,导致淀粉的消化性降低,这种RS营养片段的增加有利于抑制餐后血糖的升高[16]。
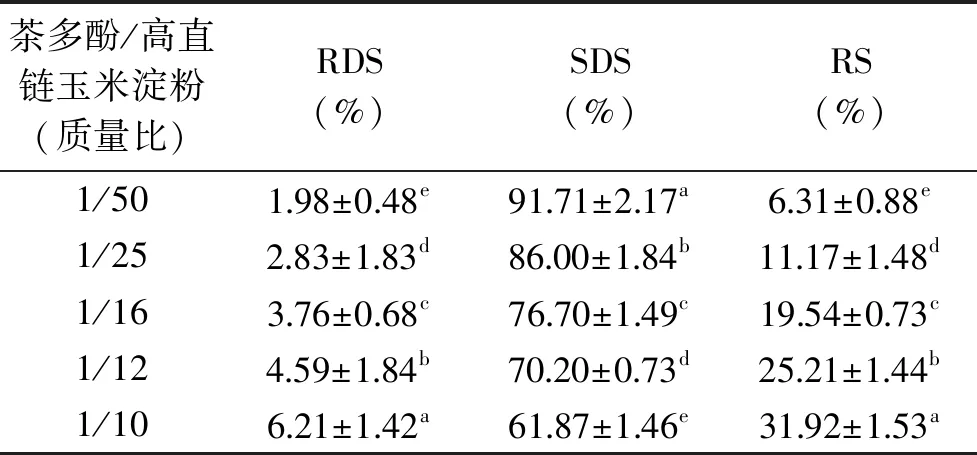
表1 不同质量比茶多酚-高直链玉米淀粉 共研磨后的RDS、SDS和RS含量Table 1 Contents of RDS,SDS and RS in TPs-HAMS co-grinding mixtures with different mass ratios
3 结论
采用共研磨技术制备了茶多酚-高直链玉米淀粉混合物。实验结果表明,共研磨混合物中淀粉的特征衍射峰随球磨时间的增加而减小,淀粉的结晶结构被破坏,结晶度降低。球磨后的淀粉颗粒表面变得粗糙、形状不规则,颗粒直径变大。实验所得共研磨混合物的热稳定性比淀粉低,但共研磨混合物的热稳定性比茶多酚高,因此共研磨有利于保护茶多酚的活性成分。体外消化性评价结果显示,随着共研磨混合物中茶多酚含量的增加,其抗性淀粉含量升高,这种营养片段含量的升高有利于控制餐后血糖的升高。本研究结果可以为利用膳食多酚与淀粉相互作用来控制淀粉的消化提供新的思路。

