植物乳杆菌和蛋白酶协同发酵水解大米蛋白ACE抑制肽高活性组分的氨基酸序列分析
邹俊哲,林凯,杨旭,谯飞,韩雪,刘红彦,杨艳艳,刘汉民,张兰威,5,*(.中国海洋大学基础教学中心,山东青岛6600;.哈尔滨工业大学化工与化学学院,黑龙江哈尔滨50090;.哈尔滨市食品工业研究所有限公司,黑龙江哈尔滨50090;.中恩(天津)营养科技有限公司,天津00000;5.华羚生物技术研究中心,甘肃兰州70000)
高血压是引起心脑血管疾病的元凶之一,它对人体的心脑血管和肾脏等器官具有较大损伤[1]。因此,研制能够有效预防和治疗高血压的降压药物或保健食品已成为研究热点[2]。其中食源性血管紧张素-I 转换酶(angiotensin I-converting enzyme,ACE)抑制肽因其温和、高效以及无副作用而倍受青睐。ACE 又称肽基-羧基肽酶,广泛存在于人体各种器官中,其主要作用是将血管紧张素I(Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu)C 端的两个氨基酸(His-Leu)水解生成血管紧张素II(Asp-Arg-Val-Tyr-Ile-His-Pro-Phe)。血管紧张素II 是强有效的升压物质,从而使血压升高。同时,ACE 能够导致使得血管舒张的舒缓激肽失活,从而进一步加剧血压的升高[3]。研究表明,ACE 的底物转移性较差,很多具有与血管紧张素I 结构类似的多肽都能够与ACE 发生竞争性抑制,从而使ACE 活性降低,阻止血压升高[4]。
许多蛋白质序列中含有与血管紧张素I 结构类似的多肽序列。目前,研究主要利用蛋白酶对各种蛋白进行水解,通过对获得的水解物进一步分离纯化,考察各组分的ACE抑制活性,从而获得新型ACE抑制肽。有研究已经通过对油菜籽蛋白[5]、大豆蛋白[6]和蘑菇[7]等不同蛋白进行水解,分离纯化获得了多种具有ACE抑制活性的多肽片段。同时,也有研究利用乳酸菌水解植物蛋白制备具有ACE抑制活性水解物的研究[8]。蛋白酶及菌体发酵均能够水解蛋白产生具有生物活性的物质,但很少有将蛋白酶与菌体发酵相结合用于制备功能性多肽的研究。蛋白酶与菌体结合可能会互补对方在水解方面的不足,从而制备获得新型生物活性肽。
本研究通过植物乳杆菌2-18 与风味蛋白酶/菠萝蛋白酶、胃蛋白酶/酸性蛋白酶协同作用,制备肾病患者专用低蛋白大米,对获得的富含多肽的大米蛋白脱除液进行多步分离纯化,最终获得具有高ACE抑制活性的多肽片段,并采用液质联用(liquid chromatographmass spectrometer,LC-MS)测定其氨基酸序列,验证其ACE抑制活性。
1 材料与方法
1.1 材料
试验用大米购于天津市宝坻区喜旺米加工有限公司;枯草芽孢杆菌Y(Bacillus subtilisY)、枯草芽孢杆菌Y4-2(Bacillus subtilisY4-2)由哈尔滨工业大学乳品科学实验室提供;胃蛋白酶:美国Sigma 公司;菠萝蛋白酶、风味蛋白酶、酸性蛋白酶、碱性蛋白酶:诺维信(中国)生物技术有限公司;ACE(1 UN):Sigma 公司;蛋白纯化系统:美国GE 公司,液质联用(Liquid Chromatography-Mass LC-MS):美国Agilent 公司;3-30K 高速冷冻离心机:美国Sigma 公司,生物发酵罐:上海保兴生物设备工程,Millipore8400 超滤杯:美国密理博公司。
1.2 菌酶组合发酵水解大米蛋白
将植物乳杆菌2-18 预先活化2 次,按总体系的5 %(体积分数)接种于大米水溶液中,于发酵罐中40 ℃30 r/min 条件下发酵9 h,使用200 目滤布过滤收集滤液。用等量蒸馏水清洗经乳杆菌处理后的大米,调整大米发酵液pH值至1.5,加入0.3%(E/S,质量分数)胃蛋白酶/酸性蛋白酶,控制温度为40 ℃30 r/min条件下发酵18 h,过滤收集滤液,用等量蒸馏水清洗大米;调整大米发酵液pH值至6.8,温度为45 ℃,加入0.3%(E/S,质量分数)风味蛋白酶/菠萝蛋白酶,于45 ℃30 r/min 条件下发酵18 h,过滤收集过滤液,用蒸馏水清洗大米。将乳杆菌2-18 发酵液与两次蛋白酶酶解液收集合并,经8 000 r/min 离心10 min,去除菌体和颗粒等杂质。将上清液通过3 kDa 的超滤膜,收集透过液。最后经冷冻干燥后,将样品置于-20 ℃备用。采用凯氏定氮法测定大米蛋白脱除率[9]。
1.3 ACE抑制活性的测定
ACE抑制率测定步骤如下[10]:取25 μL 样品,然后加125 μL 的马尿酰组氨酸亮氨酸(N-hippuril-Lhistidy-L-leucine,HHL),在37 ℃水浴中预热5 min,加入20 μL 的ACE(0.1 U/mL),37 ℃孵育1 h,然后加入350 μL 1 mol/L 的HCl 溶液以终止反应。向试管中加入1.7 mL 乙酸乙酯萃取生成的马尿酸,旋涡震荡15 s,在4 000 r/min 的条件下离心5 min,然后取上层液1 mL于120 ℃烘干,冷却后加入1 mL 水溶解,超声5 min,最后在228 nm 处测吸光值,以水作为空白对照。ACE抑制剂的活性通过下式计算:
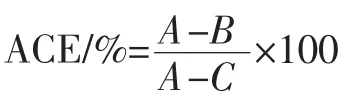
其中A为空白组(即将25 μL 样品换成缓冲液)吸光值,B为样品组吸光值,C为ACE 失活组(即在加入ACE 之前先加入350 μL HCl,使ACE 失活)吸光值。采用BCA 测定试剂盒测定滤液中多肽含量。
1.4 大米蛋白发酵水解液中ACE抑制肽的分离纯化
将经植物乳杆菌2-18+胃蛋白酶/酸性蛋白酶+风味蛋白酶/菠萝蛋白酶处理后的大米蛋白发酵水解液经如下步骤进行分离纯化。
1.4.1 阳离子交换色谱层析
首先,选用阳离子交换层析柱进行分离纯化[11]。阳离子交换层析条件:离子交换柱选择SP Sepherose Fast Flow(1.6 cm×20 cm),装柱后经20%的乙醇、磷酸盐缓冲溶液(含1 mol/L 的NaCl)冲洗,再用50 mmol/L 的磷酸盐缓冲液(pH 6.0)平衡层析柱。上样量为100 mL,用磷酸盐缓冲溶液(含1 mol/L NaCl)进行梯度洗脱,洗脱流速为2 mL/min,每管收集5 mL,检测波长280 nm。测定具有吸收峰管数的收集液的ACE抑制活性,将具有最高ACE抑制率的组分进行收集,经过冷冻干燥后进一步分离纯化。
1.4.2 凝胶色谱层析
选择分离分子量在100 Da~7000Da 之间的Superdex Peptide 10/300 GL 凝胶色谱柱进一步对上述组分进行分离纯化[12]。柱条件:先用20%的乙醇冲洗柱子,再用30%的乙腈(含0.1%三氟乙酸)平衡柱子。上样量为0.5 mL,洗脱液为30%的乙腈(含0.1%三氟乙酸),流速为0.5 mL/min,检测波长280 nm,每管接收1 mL。测定具有吸收峰管数的收集液的ACE抑制活性,将具有最高ACE抑制率的组分收进行集,经过冷冻干燥后进一步分离纯化。
1.4.3 高效液相色谱分离纯化
将经凝胶层析得到的具有最高ACE抑制活性的组分用高效液相色谱(High Performance Liquid Chromatography HPLC)进行分离纯化[13]。色谱条件为:色谱柱使用Grom-sil 120 ODS-5 ST(5 μm,10.0 mm×250 mm),使用乙腈(含0.1%的三氟乙酸)进行梯度洗脱,洗脱条件为0%~50%的乙腈溶液(v/v,50 min),流速为1 mL/min,检测波长为280 nm。收集并测定具有吸收峰的组分的ACE抑制活性。
1.5 LC-MS鉴定ACE抑制肽序列
将HPLC 分离得到的具有最高ACE抑制活性的组分进行LC-MS 分析[14]。色谱条件:Express Peptide Es-C8 柱(100 mm×2.1 mm×2.7 μm),流动相A(0.3 %乙酸水溶液),流动相B(含0.3%乙酸的乙腈),梯度洗脱,3%~95%的B 30 min,95%~3%的B 5 min,流速0.3 mL/min,柱温25 ℃,进样量15 μL。质谱条件:阳离子模式,质量范围m/z:100~3 200,分离电压200 V,喷嘴电压50V,喷雾器压力3.4×105Pa,毛细管电压3500 V,气体温度350 ℃,气体流速12 L/min,Skimmer 60 V[10]。
1.6 数据分析
采用SPSS 16.0 软件对试验数据进行统计学分析,各组数据间的比较采用单因素方差分析(one-way ANOVA)中Duncan's 法进行分析,显著性水平设定为P<0.05。
2 结果与讨论
利用植物乳杆菌2-18+风味蛋白酶/菠萝蛋白酶+胃蛋白酶/酸性蛋白酶分步进行大米蛋白发酵水解处理,测定蛋白脱除率为(91.32±1.6)%,对收集获得的大米蛋白发酵水解液进行分离并考察相应组分的ACE抑制活性。
2.1 阳离子交换色谱处理效果
离子交换层析是用来分离纯化多肽的常用方法,离子柱的固定相与带相反电荷的多肽通过库仑力结合吸附,再用与多肽带有相同电荷的流动相洗脱,通过连续改变流动相的离子强度,从而将带有不同强度电荷的多逐步洗脱,从而达到分离纯化的目的[15]。首先,将大米蛋白发酵水解液进行SP Sepherose Fast Flow阳离子交换层析,其分离效果如图1(a)所示。
通过吸收峰可知,样品初步分为3 个组分,分别为AI、AII 和AIII。对这三管进行多肽含量和ACE抑制率的测定,图1(b)是AI、AII 和AIII 这3 个组分的多肽含量和IC50值。其多肽含量分别为(1.22±0.048)、(1.87±0.034)、(1.98±0.053)mg/mL。IC50值分别为(0.267±0.014)、(0.355±0.013)、(0.442±0.015)mg/mL,组分AI 具有最高的ACE抑制活性。因此,将对AI 组分进行进一步分离纯化。
2.2 凝胶色谱处理效果
将SP Sepherose Fast Flow 阳离交换色谱层析获得的AI 组分收集并冻干成粉末,利用Superdex peptide 10/300 GL 凝胶色谱柱对该组分进一步进行分离纯化。将冻干粉配制成2 g/L 的溶液进行分离纯化。分离纯化的结果如图2(a)所示。由图可知,通过使用凝胶色谱对AI 组分继续进行分离,得到了BI、BII、BIII、BIV、BV、BVI 和BVII 共7 个组分。说明该试验选用的Superdex peptide 10/300 GL 凝胶色谱柱能够较好的分离小分子量多肽。试验测定了不同组分的多肽含量和IC50值,如图2(b)所示。
由结果可知,组分BIII、IV 和BV 的蛋白含量较高。同时测定不同组分的ACE抑制活性可知,BI、BII和BVII 均未测的具有ACE抑制活性。BIII、BIV、BV 和BVI 具有较强的ACE抑制活性,其IC50值分别为(111.20±3.10)、(87.58±2.20)、54.97、133.21 μg/mL。由此可知,BV 组分具有最高的ACE抑制活性。因此,收集BV 组分,将其冻干浓缩,进行下一步的反相高效液相色谱(reversed-phase high-performance liquid chromatography RE-HLPC)分离分析。

图1 SP Sepherose Fast Flow阳离子交换色谱层析分离效果及各组分的多肽含量和ACE抑制抑制活性Fig.1 The results of cationic column chromatography separation and the peptide concentrations of different components and their ACE inhibitory activities
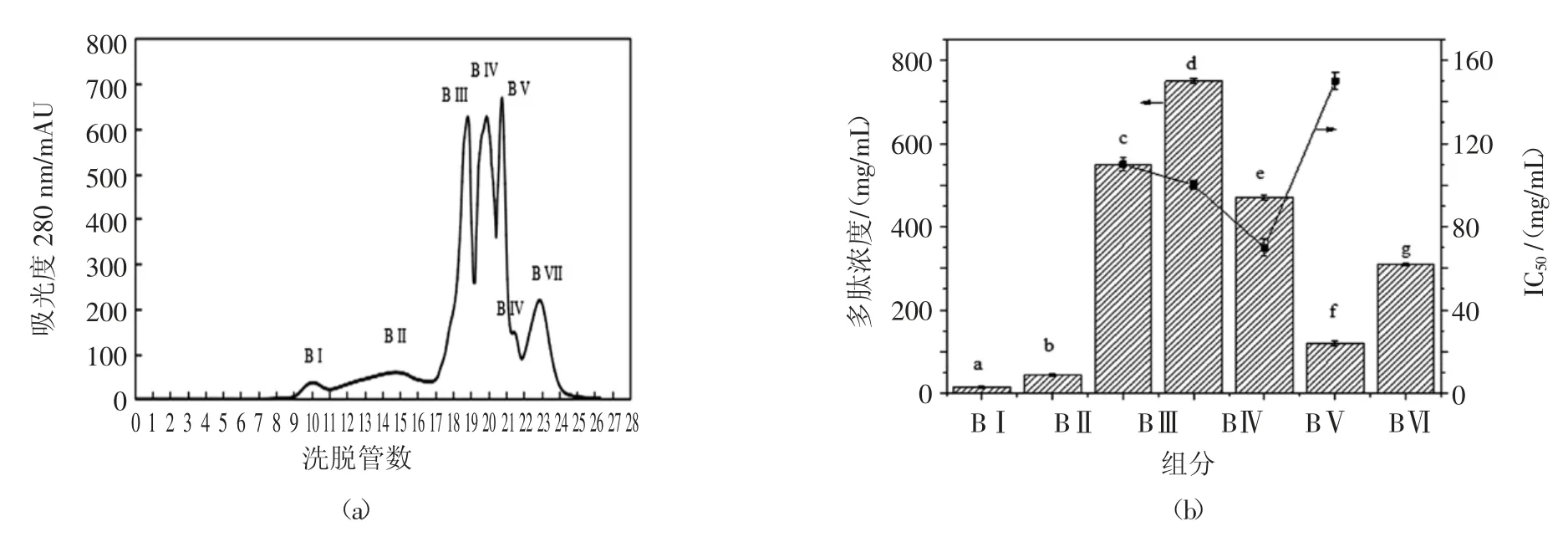
图2 Superdex peptide 10/300 GL柱层析分离效果及不同组分的肽含量和ACE抑制IC50值Fig.2 The results of Superdex peptide 10/300 GL separation and the peptide concentrations of different components and their ACE inhibitory activities
2.3 高效液相色谱
将经冷冻干燥后的BV 组分配成的2 g/L 的多肽液,使用HPLC 对该组分进一步进行分离纯化,见图3。
结果如图3(a)所示,在16.0 min~17.5 min 和17.5 min~18.0 min 获得了两个分离较好的吸收峰,分别为CI 和CII 组分。收集CI 和CII 分离液并冷冻干燥后测定两组分的多肽浓度和ACE抑制活性,结果如图3(b)所示。由结果可知CI 的IC50值为(33.81±2.10)μg/mL,低于于CII 组分的IC50值(61.31±3.20 μg/mL)。由结果可知,CI 组分具有较强的ACE抑制活性。试验将进一步利用LC-MS 测定CI 组分的多肽序列。
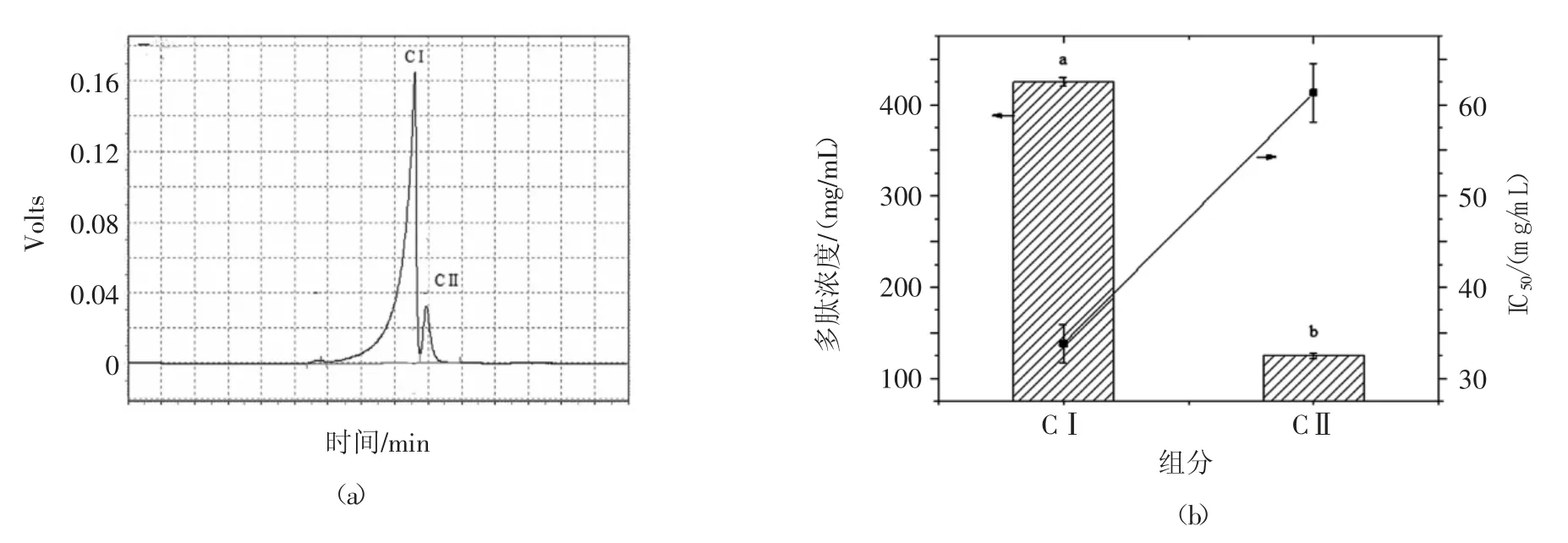
图3 RE-HPLC 分离效果及不同组分的肽含量和ACE抑制IC50值Fig.3 The result of RE-HPLC separation(a)and the peptide concentrations of different components and their ACE inhibitory activities(b)
2.4 LC-MS鉴定多肽序列分析结果
LC/MS 是用来分析多肽氨基酸序列信息的常用手段,本试验将通过LC-MS 研究CI 组分的氨基酸序列,见图4。
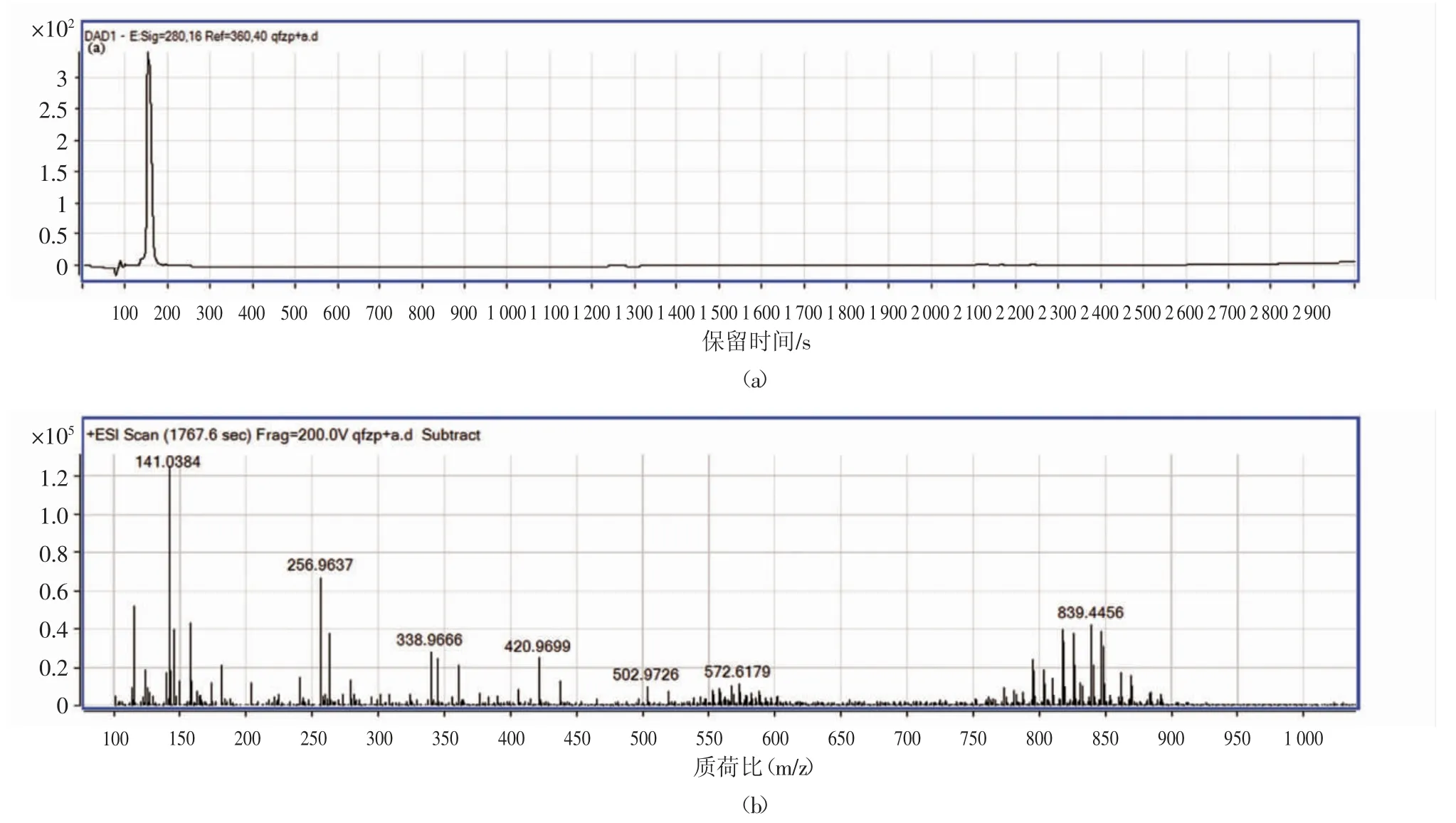
图4 LC-MS 分析色谱图及其对应的质谱图Fig.4 The chromatogram of LC-MS analysis and the peaks in chromatogram corresponding of the spectrum.
图4(a)是CI 组分液相色谱图,图谱具有一个单峰,说明CI 组分为单一物质。对应该液相色谱峰的质谱图如图4(b)所示,通过对质谱峰的分析,该物质的相对分子质量为838.445 6 Da。根据已知多肽的分子质量和多肽来源,用于推测多肽段序列结构已得到了广泛的应用[16-17]。大米蛋白主要为谷蛋白,其序列可通过UniProt 网站获得,其氨基酸序列为:
MASKVVFFAAALMAAMVAISGAQLSESEMRFRDRQCQREVQDSPLDACRQVLDRQLTGRERFQPMFRRPGALGLRMQCCQQLQDVSRECRCAAIRRMVRSYEESMPMPLEQGWSSSSSEYYGGEGSSSEQGYYGEGSSEEGYYGEQQQQPGMTRVRLTRARQYAAQLPSMCRVEPQQCSIFAAGQY。通过搜索该序列相对分子质量为(838.4±2)Da的肽序列。经过氨基酸序列比较,该多肽序列为:Val-Val-Phe-Phe-Ala-Ala-Ala-Leu。由结果可以发现,该序列中的氨基酸全部为疏水性氨基酸,已有研究表明,多肽序列中含有疏水性氨基酸能够有利于其与ACE分子催化活性中心结合,从而发挥ACE抑制作用[18]。
3 结论
试验采用了植物乳酸菌2-18 协同蛋白酶(风味蛋白酶/菠萝蛋白酶+胃蛋白酶/酸性蛋白酶)分步脱除大米蛋白,大米蛋白脱除率可达(91.32±1.26)%。对蛋白脱除液进行阳离子交换层析、凝胶过滤层析和REHPLC 三步分离纯化,获得了具有较高ACE抑制活性的多肽组分,并对该多肽序列进行了LC-MS 分析,通过与大米的谷蛋白序列进行对比,确定了该ACE抑制肽序列为VVFFAAAL,其ACE抑制活性IC50值为33.81 μg/mL。本研究表明,经菌酶组合获得的大米蛋白发酵水解能够作为产ACE抑制肽的良好原料。

