高分辨率磁共振指导下的孤立皮质下梗死的CISS分型及相关临床研究
陈蓓蕾, 李 威, 杨 柳, 于海龙, 叶 靖, 王 钰
孤立皮质下梗死(Single subcortical infarction,SSI)通常是指在穿支动脉供血区域发生的,位于大脑半球深部的梗死病灶,包括半卵圆中心、放射冠、基底节、丘脑、脑干等部位,病灶直径通常小于20 mm[1]。以往认为,孤立皮质下梗死是由于小穿支动脉的脂质玻璃样变造成的,然而近来研究发现,载体动脉动脉粥样硬化阻塞穿支动脉口,导致穿支动脉闭塞或狭窄,也可导致孤立皮质下梗死[2]。根据CISS(Chinese ischemic stroke subclassification)分型,载体动脉病变导致的孤立皮质下梗死属于大动脉粥样硬化型脑梗死,但是根据目前常用的TOAST分类标准,往往会将该类患者归类为小血管病型甚至不明原因型[3],从而无法对患者的病因和发病机制进行准确的评估。高分辨磁共振(High Resolution Magnetic Resonance Imaging,HRMRI)是利用磁共振原理抑制血管内流动血液信号获取血管壁等静态组织图像的一种成像方法,可以更准确的提供脑梗死责任血管壁和动脉粥样硬化斑块成分的信息。HRMRI已经被广泛应用于颅内动脉壁的分析,我们采用该技术,分析不同卒中亚型的孤立皮质下梗死患者的相关危险因素及预后,从而有益于制定个体化诊疗方案。
1 对象和方法
1.1 研究对象 连续纳入2015年1月~2018年4月江苏省苏北人民医院符合孤立皮质下梗死的患者共78例。纳入标准:(1)年龄18~90岁;(2)发病72 h内的急性脑梗死患者;(3)头部CT排除出血;(4)DWI提示符合孤立皮质下梗死。排除标准:(1)多发性脑梗死(2)脑出血(3)脑炎(4)多发性硬化患者。
1.2 方法
1.2.1 一般临床资料 入院时采集患者的基线资料,包括年龄、性别、高血压、糖尿病、心房颤动、吸烟史、饮酒史、空腹血糖、糖化血红蛋白、血脂、血压(舒张压和收缩压)、NIHSS评分等。入院后完善心电图/动态心电图,颈部血管彩超、颅内多普勒血流图/头颈CTA检查。
1.2.2 预后和随访 起病3 d对患者进行NIHSS评分评估,早期神经系统功能恶化(Early neurological deterioration,END)被定义为在72 h内NIHSS的运动部分评分增加≥2分[4]。3 m后进行随访,行NIHSS评分及改良Rankin量表评分(mRS评分),评估患者的远期预后。
1.3 MRI检查 对入组患者行头部MRI扫描(包括T1、T2、DWI、FLAIR等序列)、三维时间飞跃法磁共振血管成像(3D TOF Magnetic Resonance Angiography,3D TOF MRA)、高分辨率磁共振 (high resolution magnetic resonance imaging,HRMRI)血管壁分析、动脉自旋标记技术(arterial spin labeling,ASL)、磁敏感成像(susceptibility weighted imaging,SWI)等检查项目。脑梗死病灶大小定义为DWI所显示脑梗死病灶面积最大层面的病灶直径;根据Pullicino公式,梗死病灶体积=长×宽×MRI扫面阳性层数×π/6,计算三次取平均值[5]。
1.4 CISS分型标准 (1)大动脉粥样硬化(Large artery atherosclerosis,LAA):①对于除了穿支动脉区孤立梗死以外的其他任何类型梗死灶,有梗死病灶相对应的颅内或颅外大动脉粥样硬化证据(易损斑块或狭窄≥50%);②对于穿支动脉区孤立梗死灶类型,以下情形也归到此类:其高分辨率磁共振(HRMRI)提示载体动脉有粥样硬化斑块或血管检查(TCD、MRA、CTA 或DSA)提示任何程度的粥样硬化性狭窄;③需排除心源性卒中;④排除其他可能的病因。(2)穿支动脉疾病(Penetrating artery disease,PAD):①与临床症状相吻合的发生在穿支动脉区的急性孤立梗死灶,不考虑梗死灶大小;②高分辨率磁共振(HRMRI)载体动脉无粥样硬化斑块或血管检查(TCD、MRA、CTA 或DSA)未发现任何程度狭窄;③同侧近端颅内或颅外动脉有易损斑块或>50%的狭窄,孤立穿支动脉急性梗死灶归类到不明原因(多病因);④需排除心源性卒中;⑤排除其他可能的病因[6]。
1.5 近端孤立皮质下梗死(proximal single subcortical infarction,pSSI)和远端孤立皮质下梗死(distal single subcortical infarction,dSSI)的标准 根据病灶位置与动脉主干(大脑中动脉或基底动脉)的相对关系,将pSSI定义为梗死病灶位于动脉主干的穿支动脉供血的近端区域,即延伸至主干分支处;dSSI定义为梗死病灶位于动脉主干的穿支动脉供血的远端区域,即未延伸至主干分支处[7]。

2 结 果
共连续入组78例患者,结合高分辨率磁共振,根据CISS分型标准进行分型,其中大动脉粥样硬化型46例(见图1~图6),穿支动脉型30例(见图7~图12),心源性栓塞型1例,其他原因型1例。
2.1 不同卒中分型患者基线资料的比较 单因素分析显示,大动脉粥样硬化型孤立皮质下梗死患者中,高龄(P=0.002)、高血压(P=0.019)患者的比例以及脂蛋白a(P=0.033)、糖化血红蛋白(P=0.049)水平,均高于穿支动脉型孤立皮质下梗死患者,结果具有统计学意义(见表1)。
2.2 不同卒中分型患者的多因素分析 多因素回归分析显示,年龄与大动脉粥样硬化型脑梗死患者孤立性皮质下梗死的发生独立相关(P=0.021),差异具有统计学意义(见表2)。
2.3 不同卒中分型患者影像学特点比较 大动脉粥样硬化型与穿支动脉型孤立皮质下梗死患者的病灶大小(P=0.685)及病灶体积(P=0.867)均无明显统计学差异(见表3)。
2.4 不同病因分型和病灶部位的关系 大动脉粥样硬化型与穿支动脉型孤立皮质下梗死患者,其病灶部位在两组间无明显统计学差异(见表4)。
2.5 不同卒中分型患者预后的比较 大动脉粥样硬化型孤立皮质下梗死的患者在起病早期(72 h)更容易出现神经系统症状的进展(P=0.003),差异具有统计学意义;而两组的远期3 m临床预后(mRS评分)无明显统计学意义(见表5)。


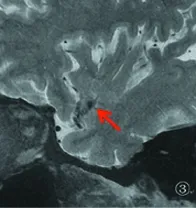
图1 DWI提示左侧放射冠急性脑梗死,其病灶直径26.50 mm; 图2 MRA提示左侧大脑中动脉M段闭塞; 图3 HRMRI提示左侧大脑中动脉粥样硬化斑块,阻塞管腔,血管闭塞。根据CISS分型标准也归类于大动脉粥样硬化型


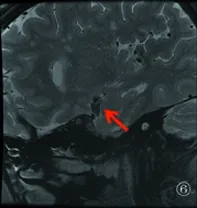
图4 DWI提示左侧放射冠区孤立皮质下梗死,位于左侧大脑中动脉穿支供血区,病灶直径14.31 mm; 图5 MRA未见左侧大脑中动脉狭窄; 图6 HRMRI提示左侧大脑中动脉存在新月形动脉粥样硬化斑块,并且阻塞穿支动脉。根据CISS分型标准归类于大动脉粥样硬化型


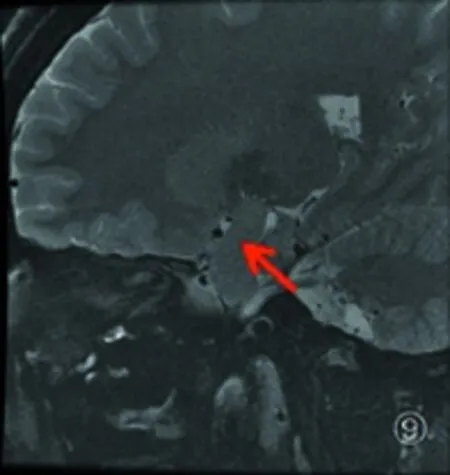
图7 DWI提示右侧基底节区孤立皮质下梗死,病灶直径12.75 mm; 图8 MRA未见明显异常; 图9 HRMRI未发现载体动脉粥样硬化斑块。根据CISS分型标准归类于穿支动脉疾病型


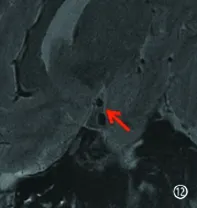
图10 DWI提示左侧基底节区孤立皮质下梗死,病灶直径37.73 mm; 图11 MRA未提示血管狭窄; 图12 HRMRI无载体动脉粥样硬化斑块,可见其大脑中动脉穿支动脉存在动脉粥样硬化,内膜增厚。该患者CTA排除颅外血管狭窄,根据CISS分型标准也应归类于穿支动脉型

表1 不同卒中分型患者基线资料
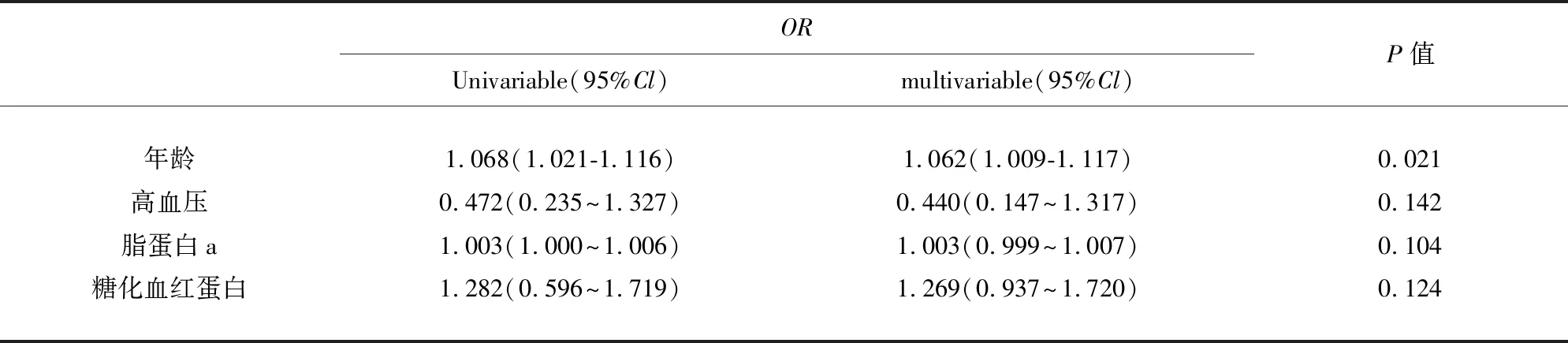
表2 不同卒中分型患者的多因素分析

表3 不同卒中分型患者影像学特点

表4 不同病因分型和病灶部位的关系

表5 不同卒中分型患者的预后
3 讨 论
孤立皮质下梗死是缺血性脑卒中的一个重要类型,是指穿支动脉供血区域的脑白质深部的孤立梗死病灶,通常被认为是由于小穿支动脉动脉病变所致,但近来研究发现,其病因也可以是大动脉病变[2]。目前国际公认的卒中分型方法为TOAST(Trial of Org 10 172 in acute stroke treatment)分型,根据TOAST分型标准,大动脉粥样硬化型脑梗死要求存在由于动脉粥样硬化所致的颈动脉、大脑前动脉、大脑中动脉、大脑后动脉、椎-基底动脉的狭窄程度大于等于50%,而小血管闭塞型脑梗死则要求其病灶直径小于15 mm[8]。因此,存在轻度(<50%)载体动脉狭窄的SSIs,以及病灶直径大于15 mm的SSIs,可能会分别被归类为小血管疾病和隐源性卒中。近年来HRMRI的研究显示,部分颅内血管有轻度狭窄,甚至在MRA上没有狭窄,但在HRMRI上有明显的斑块的血管,可以由于其分支闭塞导致SSIs,而且这些血管的病变与动脉粥样硬化有关,因此应该被归类为大动脉粥样硬化型[3]。CISS分型则不将血管狭窄程度或病灶大小作为卒中分型的标准,而是通过病因或发病机制对卒中进行分型,并且提出了穿支动脉疾病的概念,将动脉粥样硬化正式引入到穿支动脉的病因诊断中。通过血管影像学,其将大动脉粥样硬化型脑梗死的发病机制区分为:(1)载体动脉斑块或血栓堵塞穿支动脉;(2)动脉到动脉栓塞;(3)低灌注或栓子清除下降或混合型。根据动脉粥样硬化部位来区分大动脉粥样硬化型和穿支动脉型脑梗死[6]。针对病灶直径通常较小的孤立皮质下梗死患者来说,这种分型标准可能能更加准确的从病因学上对其进行分型。HRMRI与传统MRI相比,可以使几毫米的动脉壁可视化[9],并能够分析颅内血管斑块位置及性质,从而比一般影像学手段如CT及超声等更灵敏的发现血管病变,确认孤立皮质下梗死的责任血管,并更加准确的对孤立皮质下梗死进行卒中分型。本研究通过HRMRI,对患者责任血管血管壁进行分析,发现孤立皮质下梗死患者的CISS卒中分型,主要是以是大动脉粥样硬化型和穿支动脉病变型,少量患者为心源性栓塞或其他类型。
本研究针对大动脉粥样硬化型和穿支动脉型的孤立皮质下梗死患者,进行了相关危险因素分析,并比较两种类型孤立皮质下梗死患者的预后。研究发现,在单因素分析中,大动脉粥样硬化型孤立皮质下梗死的患者中,存在更多高龄及高血压的患者,并且其脂蛋白a、糖化血红蛋白水平均高于穿支动脉型孤立皮质下梗死患者。而多因素分析显示,年龄是大动脉粥样硬化型孤立性皮质下梗死的独立危险因素。Choi等研究发现,载体动脉病变导致的孤立皮质下梗死与高龄和其他非颅内血管的动脉粥样硬化相关[10]。这与我们的研究结果相符。以往研究发现,近端孤立皮质下梗死(pSSI)和远端孤立皮质下梗死(dSSI)的临床特点及预后存在一定差异,通常pSSI的梗死体积较大,入院时NIHSS评分也较高,dSS 1 y内复发或恶化风险较低,预后较好[11,12]。此外,有研究指出,大脑中动脉(MCA)粥样硬化更易导致孤立皮质下梗死进展或预后不佳[13,14],但也有研究发现卒中进展可能与梗死体积相关,而与是否存在MCA动脉粥样硬化无明显关联[15]。本研究主要是根据病变血管进行分组研究,研究结果并未提示病灶大小及病灶体积在两组间存在显著差异,并且未提示大动脉粥样硬化型孤立皮质下梗死患者更多是dSSI。我们发现大动脉粥样硬化型孤立皮质下梗死的患者在起病早期(72 h)更容易出现临床症状的进展,即神经系统症状的加重,而两组的3 m临床预后无明显统计学意义,从而提示发病72 h内的卒中进展可能与其病因及病变血管部位相关,大动脉病变导致的孤立皮质下梗死更容易表现为早期进展型脑卒中。
本研究通过高分辨率磁共振血管壁成像,根据血管病变部位对孤立皮质下梗死进行了分型,能从病因上更准确的将不同类型孤立皮质下梗死进行分组;并分析了不同卒中分型的相关危险因素,结果显示高龄是大动脉粥样硬化型孤立性皮质下梗死的独立危险因素;大动脉粥样硬化型梗死患者早期更容易出现卒中进展,但两者的远期预后并没有明显的差异。该研究的结论对孤立皮质下梗死患者的病因及早期进展的预测有一定的临床指导意义。但本研究为小样本单中心研究,样本量较少,研究结果存在一定的局限性。扩充样本量或进行多中心研究,可能得出更准确及更有意义的研究结果。

