miR-200c在胃癌早期诊断中的作用研究现状及展望
张玲倩,卢 宁
张玲倩,卢宁,中国人民解放军新疆军区总医院肿瘤科 新疆维吾尔自治区乌鲁木齐市 830000
核心提要: 胃癌(gastric cancer,GC)是消化道最常见的恶性肿瘤之一,其发病率和死亡率在所有癌症中均位列第二位,在所有就诊的患者中,晚期GC患者所占比例较高,有不断上升的趋势.如何提高GC患者的早期诊断水平并跟踪评估GC患者的治疗疗效对提高GC患者的治疗效果具有重要意义.长期以来,癌胚抗原CEA已经成为胃肠道肿瘤的较好标志物,但仍无法精准的预测GC患者的发病情况.有关miR-200c在GC患者血清中的表达对进一步提高GC的早期诊断率可能具有重要意义.
0 引言
胃癌(gastric cancer,GC)是消化道最常见的恶性肿瘤之一,严重威胁人类健康.近年来随着检查和治疗手段的不断提高,其发病率总体有所下降,但仍居于消化道恶性肿瘤的首位[1].由于GC的发展规律和特点,临床上有相当一部分患者在GC术后、化疗后仍出现局部复发和(或)远处转移,严重影响了GC患者的预后[2-9].上皮间质转化(epithelial mesenchymal transition,EMT)的发生与肿瘤侵袭、转移、复发密切相关,在肿瘤细胞获得EMT的过程中,上皮源性的细胞失去极性,导致肿瘤细胞的黏附能力下降、迁移运动能力增加[10,11].目前有研究证实GC细胞中miR-200c的表达下调,导致与EMT密切相关的E-钙黏蛋白表达减少,细胞间的黏附作用降低,侵袭转移能力增加[12-15].因此,有必要探讨miR-200c调控EMT阻止GC复发转移的作用机制.
1 microRNA的作用研究及miR-200c的基因定位
1.1 microRNA的作用研究 microRNAs(简称miRNA或miR)是一类短小的单链非编码RNA,一般由17-25 bp组成,最早由Lee等[16]在1993年研究参与调控线虫时序发育时发现,统称为小分子RNA或微小RNA(microRNA).miRNA不能翻译蛋白质,主要在转录后水平调控其他编码基因,即通过与其配对的特定靶信使RNA(mRNA)的3'-非翻译区(3'-UTR)来抑制翻译或诱导靶mRNA的降解,参与细胞的增殖、凋亡与分化等多种重要生命活动的调控[17].近年来研究发现,miRNA参与多种恶性肿瘤的演进,起抑癌基因或原癌基因的作用.miRNA曾经长期被视为转录的副产物,然而越来越多的证据表明,miRNA参与正常生理活动与病理过程的调控[18].miRNA参与调节几乎所有已知的癌变过程,包括细胞生长、增殖、分化、血管生成、细胞凋亡以及侵袭和转移[19].
很多研究显示,miRNA与肿瘤的发生发展密切相关,采用基因芯片技术对多种肿瘤组织样本中的miRNA表达谱进行检测,发现大多数miRNA在肿瘤样本中出现下调,少部分miRNA表达水平上调[20].在各种人类实体肿瘤和恶性血液病研究中,整个miRNA基因组的研究显示在肿瘤和正常组织间是有miRNA表达差异的,miRNA在细胞分化、增殖、迁移和凋亡中起重要的调控作用[21].因此,miRNA的功能失调可能导致人类各种疾病如肿瘤、肝脏疾病、免疫机能障碍和代谢紊乱的发生[22,23].
1.2 miR-200c的基因定位 miRNA-200家族是miRNA家族的重要成员[17].最近的研究表明,种子序列决定miRNA-200家族的区分,并决定着各成员的功能差异.miRNA-200家族分为miRNA-200a、miRNA-141和miRNA-200b、miRNA-200c、miRNA-429两个亚家族[24].前者有相同的种子序列“AACACU”;后者有共同种子序列“AAUACU”.作为miRNA-200家族中的一个成员,miRNA-200c基因簇定位于12号染色体p13.31上,其基因序列为5'-UAAUACUGCCGGGUAAUGAUGGA-3'.miR-200c的作用靶点是转录因子ZEB1和ZEB2(锌指E盒同源结合蛋白-1、2)[25,26].
2 miR-200c对GC细胞增殖能力的影响及其机制研究
目前已有相关实验证实miR-200c通过靶向多种蛋白影响GC细胞的增殖、侵袭能力,且多数研究结果显示miR-200c可显著抑制人GC细胞增殖[27,28].伍菲菲等[29]采用MTT法检测miR-200c对人GCMGC-803细胞生长增殖能力的影响,并通过荧光素酶报告载体系统证实miR-200c可抑制GC细胞增殖,并进一步证实DNMT3B是miR-200c直接调控的靶基因,miR-200c通过靶向调控DNMT3B的表达而抑制GC细胞生长增殖能力.
李鹰飞等[30]通过CCK-8法、FCM、Transwell等方法检测了48例GC和相应癌旁组织的标本,采用双荧光素酶实验验证miR-200c对EFNA1基因的靶向抑制作用,并分析GC组织中EFNA1蛋白表达与患者性别、年龄、吸烟、饮酒、病理类型、浸润深度、淋巴结及远处转移、肿瘤部位间的关系,结果显示与对照组相比,miR-200c可使GC细胞SGC7901的增殖能力明显降低(P<0.05),总凋亡率升高(P<0.05),侵袭能力降低(P<0.05),并证实miR-200c可通过靶向EFNA1基因抑制GC细胞增殖及侵袭,促进凋亡.
由此说明,尽管miR-200c抑制GC细胞增殖的作用靶点不同,作用机制也不同,但是都能够通过不同的信号通路起到抑制GC细胞增殖的能力.其确切的作用机制及靶点仍有待于进一步的实验加以补充完善.
3 miR-200c对ZEB1表达影响和对肿瘤细胞侵袭迁移作用
ZEB-1是重要的非受体细胞核转录因子,定位于人类10号染色体短臂上,能抑制多种基因的表达[31].已有研究表明,miR-200c可通过与ZEB-1的3'-UTR结合,抑制ZEB-1蛋白的表达[32],ZEB-1蛋白进一步与E-cadherin蛋白启动子上保守的E2-boxes结合,使E-cadherin表达上调,从而加强了细胞间的黏附作用,抑制恶性肿瘤细胞的侵袭转移能力[33].除了miR-200c对ZEB1的抑制作用,研究还发现ZEB1蛋白的表达上调后可以明显抑制miR-200c的表达,这样在miR-200c和ZEB1之间就形成一个负反馈回路,起到调节肿瘤细胞的侵袭转移能力[34].
目前已有研究证实miR-200c能够通过抑制ZEB-1蛋白的表达,从而起到抑制肿瘤细胞的迁移及侵袭能力.宋永站等[35]利用脂质体Lipofectamin2000将人工合成的miR-200c转染SGC-7901细胞,转染24 h后RT-PCR检测各转染组中ZEB1基因的表达量,Transwell小室法检测各转染组细胞迁移和侵袭能力的变化.结果表明转染miR-200c能明显抑制SGC-7901细胞ZEB1基因的表达及细胞迁移和侵袭能力.且ZEB1基因的表达水平与肿瘤细胞的侵袭和迁移能力相关.
4 miR-200c通过调节上皮间质转化抑制GC侵袭和转移
4.1 上皮间质转化加强了肿瘤细胞的侵袭转移能力EMT是肿瘤重要的恶性生物学行为之一,存在于人体多个病理生理过程中,以上皮表型缺失和获得间质表型为主要特征[24],研究表明肿瘤的侵袭转移机制中包含EMT这一过程[36].EMT的发生与肿瘤侵袭、转移、复发密切相关,在肿瘤细胞获得EMT的过程中,上皮源性的细胞失去极性,导致肿瘤细胞的黏附能力下降,迁移运动能力增加[37].当发生EMT时,上皮细胞失去顶—基底极性,细胞间的黏附力减弱或者消失,细胞骨架重塑,获得纤维细胞样形态,同时上皮表型标志物E-cadherin蛋白表达下调,而间质型标志物N-钙黏蛋白(N-cadherin)、纤维黏连蛋白(fibronectin,FN)等表达上调,同时特异性核转录因子ZEB-l表达也随之上调[38,39].这一系列的因素共同导致肿瘤细胞的侵袭转移能力增加(图1).
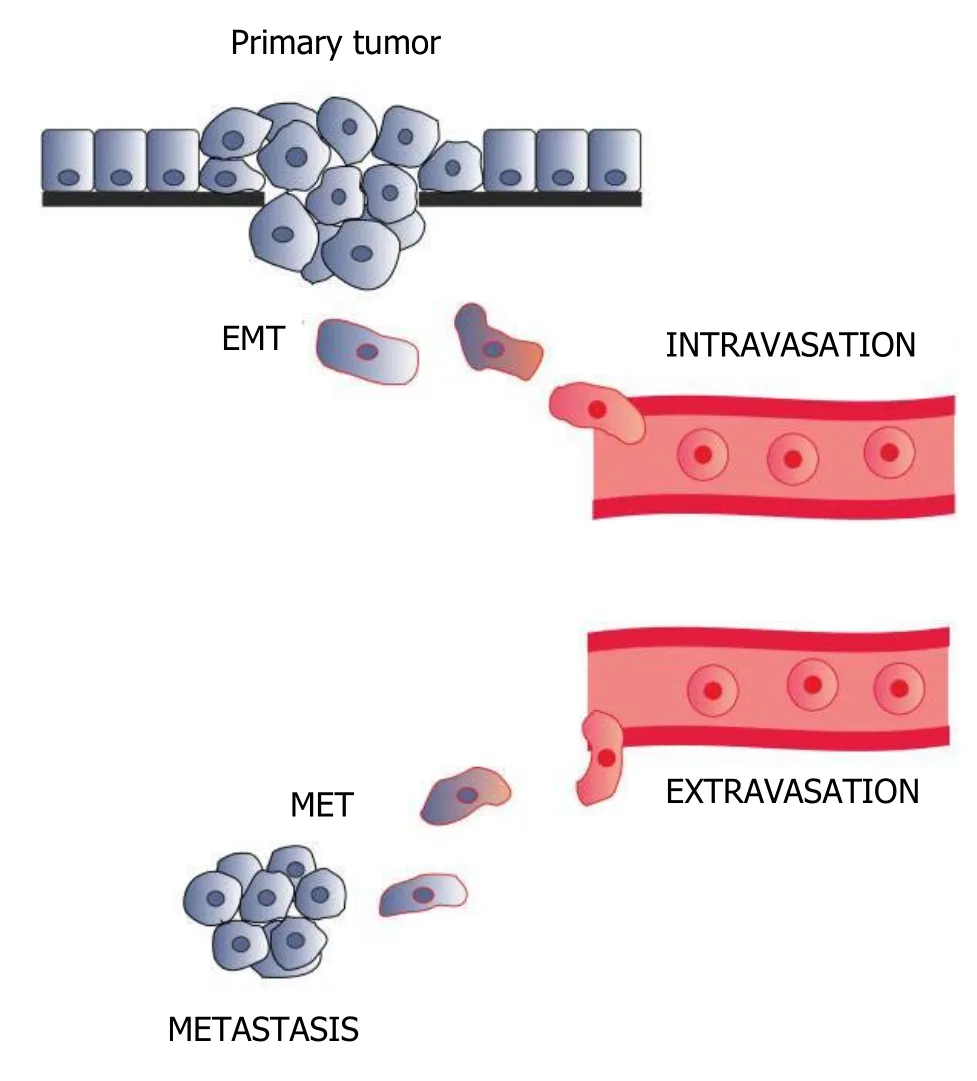
图1 上皮间质转化的发生加强肿瘤细胞的侵袭和迁移能力[40].
4.2 miR-200c通过调节EMT抑制GC侵袭和转移 有研究指出肿瘤形成机制中包含肿瘤细胞EMT这一过程[41].EMT使上皮细胞失去了细胞极性以及与基底膜的连接,转换为具有较高迁移与侵袭、抗凋亡和降解细胞外基质的能力的间质表型.然而这过程有赖于miR-200c对细胞的调控[42].miR-200c是EMT过程中的重要调节基因,除了在正常细胞的表型转换中起作用,还在多种类型癌细胞的表型转换中起调节作用[43].大量研究证实,在多种肿瘤组织中存在miR-200c的表达缺失[44].DNA的甲基化、致癌基因的激活和肿瘤抑制基因p53的缺失导致的miR-200c的缺失和癌细胞的低分化和干细胞化存在着联系[45].
不少功能性研究表明,miR-200c是抑制EMT和不同类型的癌症侵袭转移的一个关键的因素[46].机制上,EMT表现为E-cadherin的表达缺失,组成细胞骨架的角蛋白转化为波形蛋白,从而引起细胞形态的改变,促进了肿瘤细胞的运动和侵袭能力[47].目前,研究最为热门的miR-200c的作用靶点是转录因子ZEB1和ZEB2,而转录因子ZEB1/ZEB2可下调E-cadherin的表达,降低细胞间黏附作用,从而促进肿瘤细胞的侵袭转移[48](图2).miR-200c可通过直接抑制ZEBl/ZEB2的表达,进而增加E-cadherin的表达,阻止EMT的发生,从而抑制GC侵袭和转移能力.
5 miR-200c在GC组织中的含量明显低于正常组织
目前,已有多个实验证实,miR-200c在GC组织中的含量与正常组织相比明显下调.李小华等[49]通过采用实时荧光定量PCR分析了25例GC组织中miR-200家族的表达.结果显示:与癌旁正常组织相比,GC组织中miR-200家族有不同程度的表达下调(P<0.05),在TNM Ⅲ期GC组织中miR-200b,miR-200c表达显著低于癌旁正常组织(P<0.05).GC组织中的miR-200家族表达与E-cadherin的表达下调呈正相关(P<0.05).结果表明,GC组织中miR-200家族表达下调可能与GC侵袭转移有关.周欣亮等[50]检测了GC组织中miR-200c的表达水平与GC患者临床病理特征的相关性,结果表明:miR-200c在GC细胞中的表达下调促进了GC的复发与转移,且miR-200c的表达水平显著降低;且miR-200c的表达与肿瘤TNM分期、肿瘤浸润深度、无病生存期之间存在显著的负相关关系.黄俊等[51]采用原位杂交法检测了40例正常人群胃黏膜组织以及121例GC患者组织中miR-200c的表达情况,结果显示miR-200c在GC组织中表达显著下调,且miR-200c的表达水平与GC临床分期和淋巴结转移情况显著相关(P<0.05).由此可见,miR-200c在GC组织中的含量与正常组织相比明显下调,且与GC患者的临床分期和淋巴结转移情况密切相关.类似研究结果较多,我们分别检索了中国知网、万方、Pubmed等数据库,归纳出相关研究结果如下(表1).

表1 miR-200c在胃癌组织中的含量与正常组织对比
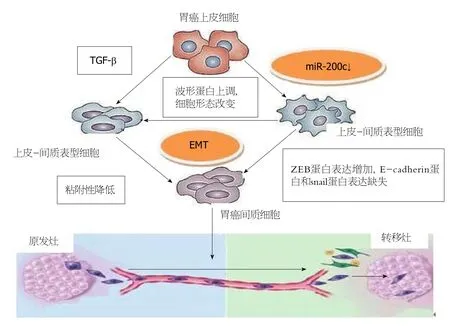
图2 miR-200c调控上皮间质转化抑制胃癌细胞侵袭和转移.
6 miR-200c在GC患者血清中的含量高于正常人群
林国友等[54]采用逆转录荧光PCR方法检测50例GC患者和50例健康对照者静脉血清中miR-200c的表达情况,结果显示GC患者中血清miR-200c水平明显高于健康对照组,ROC曲线分析显示miR-200c诊断GC的ROC曲线下面积为0.725(95%CI:0.698-0.851),敏感度和特异度分别为67.5%和78.5%.miR-200c水平与患者年龄、性别、肿瘤大小和TNM分期无关,提示miR-200c水平可能成为GC独立诊断标志物.唐锦莉等[55]应用实时荧光定量PCR技术(TaqMan探针法)研究了47例胃腺癌患者及50名健康对照者检测血清中miR-200c的表达水平,分析其与年龄、性别、肿瘤定位、大小、分化程度、TNM分期、淋巴结转移等病理参数的关系,并比较30例GC根治术前及术后6-8 d血浆中miR-200c的表达的变化情况,结果显示miR-200c在GC患者血清中相对表达量为(15.15±3.02),与对照组(3.39±0.87)相比,显著升高(t=-2.854,P= 0.006).且miR-200c在术后表达降低(t= 2.978,P= 0.006).ROC曲线分析表明血清miR-200c曲线下面积(AUC)分别是0.692、0.792、0.798;敏感性和特异性分别是97%、54%.证实了miR-200c对胃腺癌的联合检测具有较高的灵敏度和特异性.Zhang等[56]应用定量RTPCR分析了98名GC患者血清样品中miR-200c表达水平,并确定该表达与临床病理特征和存活之间的关系.结果发现GC患者的相对血清miR-200c水平显著高于健康对照,且GC患者血清miR-200c水平高的患者的总生存率显著低于低水平患者.这表明GC患者中血清miR-200c的表达可能作为GC患者早期诊断的一个较好指标,且由于其灵敏度和特异度均较好,可用于评估GC患者的预后.
7 结论
近年来,虽然人们在GC的早期诊断方面做了很多有意义的探索,但尚未取得长足的进展.胃镜的广泛使用对GC患者的早期定位和定性诊断具有不可替代的作用,但胃镜毕竟属于有创性检查,目前尚未作为一个常规检查项目,尤其的在农村边远地区,胃镜远远没有达到普及的程度[57].血清癌胚抗原虽然对GC的诊断具有一定的指导意义,但是由于其灵敏度和特异性均不高,在GC的早期诊断中发挥的作用有限,仅限于高度怀疑为GC的患者的常规筛查以及胃肠道肿瘤患者术后的定期随访[4].因此,在GC的早期诊断和预后评估方面,仍需进一步开发出其他指标.目前关于miR-200c的研究尚不全面,有关miR-200c在GC诊断中的作用和对GC患者预后的评估作用仍有待于大样本的临床试验加以研究证实.但是,随着对miR-200c研究的不断深入,以及miR-200c作用的相关靶点的发现,可以预测的是miR-200c将在GC的诊断和跟踪随访方面具有较大价值.

