抗反流手术对体重的影响
吾布力卡斯木·吾拉木 艾克拜尔·艾力 李义亮 买买提·依斯热依力赛米·赛麦提 阿卜杜喀迪尔·阿卜杜热合曼 克力木·阿不都热依木
胃食管反流病(gastroesophageal reflux disease,GERD)是指胃内容物反流至食管引起胃灼热和反酸为主的食管内症状以及食管外症状的上消化道常见病,其发病率在不同国家、地区存在较大的差异。食管裂孔疝(hiatal hernia,HH)是指腹腔内脏器,主要是胃,通过膈食管裂孔进入胸腔所致的疾病,在膈疝中最常见的一种,其占90%以上。HH是GERD常见的病因之一,两者有着密切的联系。本研究通过对GERD合并HH患者行腹腔镜下食管裂孔疝修补术联合Nissen胃底折叠术,根据术后随访记录,主要分析该手术对体重的影响。
资料与方法
一、对象
纳入2017年11月至2018年12月于新疆维吾尔自治区人民医院微创、疝和腹壁外科住院患者中行GerdQ评分、24 h动态pH监测、食管测压、胃镜及上消化道钡餐造影检查已明确诊断GERD合并食管裂孔疝的患者共73例。其中男性43例,女性30例;年龄52.14(37~79)岁。本研究经医院伦理委员会审查通过,所有患者均签署知情同意书。
纳入标准:(1)年龄>18岁;(2)GerdQ量表评分≥8;(3)术前胃镜、食管高分辨率测压、24 h食管动态pH检测、上消化道钡餐造影检查等均支持GERD合并HH诊断[1];(4)对于非糜烂性胃食管反流病(non-erosivegastroesophagealrefluxdisease,NERD)的诊断,要求GerdQ量表评分≥8,食管24 h动态pH监测阳性,但内镜下未见糜烂性食管炎或Barrett食管;(5)患者自愿接受随访并配合专职人员做好相关记录。
排除标准:(1)合并严重心肺疾病对手术不能耐受的患者;(2)不愿承担手术风险未能签署手术同意书的患者;(3)麻醉过敏患者;(4)手术后失访患者。
二、方法
1.手术方法:采用腹腔镜食管裂孔疝修补联合Nissen胃底折叠术,麻醉方式为气管插管全麻,手术体位选择头高脚低右倾斜卧位,两腿外展分开。手术步骤:常规消毒,铺无菌巾单,经脐上12 mm纵形切口戳孔注气建立人工气腹,气腹压力控制为12 mmHg(1 mmHg=0.133 kPa)。从此切口插入10 mm Trocar,置入腹腔镜,观察腹腔有无损伤,有无大网膜与腹壁黏连,肝胆脾肠盆腔有无异常。之后分别于两侧肋缘下锁骨中线、左肋缘下腋前线处插入10 mm、5 mm及5 mm Trocar,放入超声刀、分离钳,另于剑突下正中偏左开一3 mm小切口插入3 mm倒“7”字形钝头钢丝,腹腔内放入小号乳胶引流管,套入于钢丝并吊牵肝左叶以充分暴露胃小弯和食管贲门周围,用超声刀切开近端胃小弯的肝胃韧带,出血血管予以钛夹夹闭,游离食管右侧,显露右侧膈肌脚并此处标志性留置一块干纱布,然后超声刀切开胃脾韧带;游离胃底和食管贲门左侧,使食管下端贲门周围完全游离,并两侧膈肌脚充分显露。手术过程中,不可盲目分离,应注意辨认迷走神经、心包及大血管。最后根据患者食管裂孔大小,选择相应修补方案:食管裂孔<5 cm的患者,采用不可吸收线缝合修补后,间断缝合膈肌脚缺损部位2~3针;食管裂孔缺损直径>5 cm的患者,应用HH专用补片覆盖修补后,还需用疝补片钉合器钉合于双侧膈肌脚及膈肌上以进一步固定,后行Nissen胃底折叠术以抗反流。抗反流大致步骤如下:将胃底从贲门后方牵拉包裹食管贲门一圈,并分别缝食管右侧胃底和胃短血管处胃底,固定于食管前壁,使宽3 cm胃底包裹食管,缝合2针,超声刀电凝止血刨面,生理盐水冲洗腹腔,放置负压引流管一根并引出体外固定。确认无明显创面渗血及出血,洗净吸液及气体,退出腹腔镜。
2.术后随访:术后3个月、6个月、12个月采用住院、门诊、电话及信件等方式进行随访。常规测身高、体重、腰围、并且行上消化道钡餐造影、胃镜及食管测酸测压等检查。
三、统计学分析
运用SPSS 23.0软件对样本数据进行处理分析。符合正态分布的计量资料以均数±标准差描述,两样本均数比较用t检验,多组间比较采用方差分析(One way of ANOVA)检验比较组间差异;非正态分布计量资料以中位数描述,计数资料以率描述,以P<0.05为差异有统计学意义。
结 果
一、本组患者一般情况
本研究所纳入的73例患者中,男性43例(59%),女性30例(41%);年龄为37~79岁,中位数为53岁;平均病史为7.2年,服用质子泵抑制剂(proton pump inhibitor,PPI)患者62例(92%),平均服用PPI时间为6.2年。所有患者手术均在腹腔镜下成功完成,无中转开腹。平均手术时间为71.5(62~95)min,术后平均住院时间为4.3(4~7)min。患者均术后2个月过渡到正常饮食。患者术后均未出现明显的贫血、维生素及微量元素明显缺乏。
二、本组体重指数及脂代谢指标测定
73例患者术后随访12个月,患者术前平均身高为162.03 cm,术前、术后3、6、12个月平均体重以及BMI进行比较,各组间有差异,且差异具有统计学意义(P均<0.05)。
表2 术前、后患者体重及BMI比较(±s)
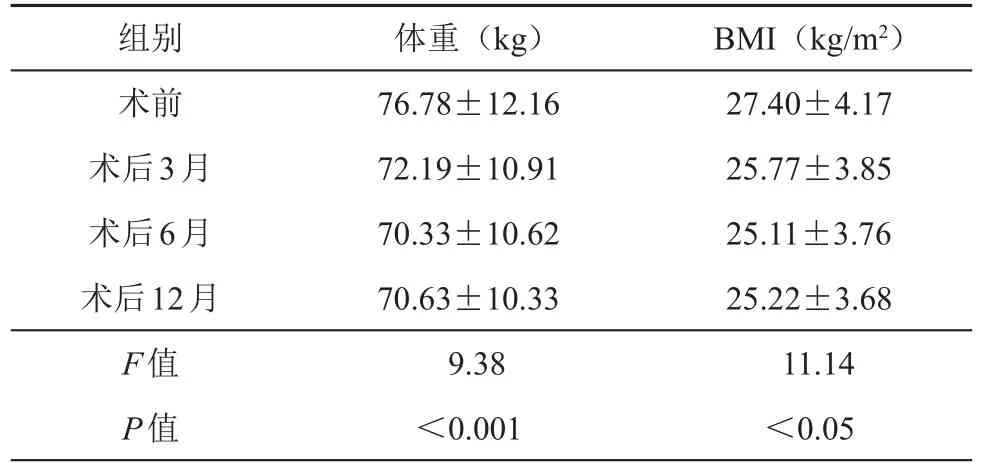
表2 术前、后患者体重及BMI比较(±s)
组别术前术后3月术后6月术后12月F值P值体重(kg)76.78±12.16 72.19±10.91 70.33±10.62 70.63±10.33 9.38<0.001 BMI(kg/m2)27.40±4.17 25.77±3.85 25.11±3.76 25.22±3.68 11.14<0.05
讨 论
胃食管反流病作为最常见的上消化道疾病,其在全球范围内发病率报道有较大差异。据近期流行病学报道,GERD发病率在东亚及东南欧地区最高(>25%),东南亚、加拿大及法国最低(<10%)[2]。众所周知,HH是GERD的常见病因之一。HH患者一旦出现症状,其表现与胃食管反流病极其相似。当疝内容物较大压迫心肺、纵隔,可以产生气急、心悸、咳嗽、发绀等症状。压迫食管时可感觉在胸骨后有食管停滞或吞咽困难。
在临床上,患有HH的患者因随着食管裂孔的不断扩大,食管韧带进行性松弛,从而食管下括约肌(lower esophageal sphincter,LES)失去正常的生理位置,影响其抗反流屏障功能。因此,HH患者往往合并有GERD。对于严格的内科治疗效果不佳或者患者不能耐受长期药物治疗,以及患者合并食物反流引起的呼吸道疾病或严重HH时,临床上被认为有抗反流手术指征。腹腔镜下Nissen胃底折叠术(laparoscopic Nissen fundoplication,LNF)已成为HH合并GERD标准的外科治疗。目前已有研究报道标准的Nissen胃底折叠术对术后体重有明显的影响。大部分研究结果表明,Nissen胃底折叠术后患者体重明显降低,并且对于体重下降的原因,研究者们持有不同的看法[3]。
Kamolz等[4]报道称,约>50%的患者术后1周内开始出现吞咽困难,直到术后3个月患者吞咽障碍得以缓解,只有2%的患者仍存在严重的吞咽困难。因此认为,术后前3个月出现的体重下降可能与吞咽苦难有关。我们的研究结果表明,与术前BMI相比,术后前3个月内患者体重下降较明显,基本与上述研究结果相符。Nissen胃底折叠术后减重的另一个重要原因与患者饮食习惯的改变有关。通常情况下,LNF术后患者被嘱咐少食多餐,细嚼慢咽,充分咀嚼,清淡规律饮食,避免高脂肪、过甜饮食。因此,饮食习惯的改变被认为是术后是否减重的决定性因素[5]。有研究结果显示,LNF术后减重患者达90.9%,体重平均降低3.9 kg,认为其原因归根于术后综合性饮食干预[6]。
虽然大部分研究表明LNF术后体重下降较明显,但也有研究表明LNF术后会出现轻度体重增加[7]。其原因在于,酒精刺激酸分泌并且导致LES的松弛而加重反流症状,因此多数患者术前因喝酒或吃甜食加重心前区不适而远离这些高热量食物[8]。除此之外,胃排空的改变也可以解释LNF术后减重的原因。由于LNF术后瞬间出现胃容积及顺应性的减小,从而导致短暂性胃排空增强。但是有研究[9]报道称,胃排空能力于术后30 d基本能够恢复到术前的状态,因此长期减肥并不能用这一机制来解释。Nissen胃底折叠术具有消除LES迷走神经功能的作用,因此当LES压力减弱与贲门容受性舒张时可能出现胃排空增强[10]。
综上,本研究主要分析HH合并GERD患者行腹腔镜食管裂孔疝修补术联合Nissen胃底折叠术对体重的影响。然而我们的研究结果显示,Nissen胃底折叠术具有较显著的减重效果,术后至随访结束期间平均减重6.15 kg。该术式对体重的影响可能与术后饮食习惯的改变、早饱、性别等因素有关。由于本研究研究对象数量偏少,缺乏代表性,需开展多中心、大样本研究来进一步证实观点及其意义。

