慢性束缚应激对小鼠食管上皮细胞间距增宽及炎症发生的研究
买买提·依斯热依力 赵新胜 艾克拜尔·艾力 李义亮 阿孜古丽·阿力木江赛米·赛麦提 闫晶 克力木·阿不都热依木
胃食管反流病(gastroesophageal reflux disease,GERD)是消化系统常见的疾病,其发生发展与心理因素密切相关。焦虑和抑郁等心理疾病增加罹患GERD的风险,同时会导致GERD症状的加重[1]。食管上皮的通透性取决于紧密连接(tight junction,TJ)蛋白的完整性。研究发现,食管黏膜暴露于酸或酸化的胃蛋白酶环境会使TJ蛋白破坏,从而造成细胞旁通路对水、电解质和小分子物质的通透性增加,导致食管鳞状上皮出现细胞间隙增宽(dilated intercellular space,DIS)[2]。GERD患者食管上皮TJ蛋白表达异常可直接导致食管上皮DIS,这一组织学变化也许能作为GERD食管形态超微结构异常的客观指标[3]。这可能是部分难治性GERD患者使用质子泵抑制剂(proton pump inhibitors,PPI)治疗后,症状仍持续存在的原因之一。国内外的研究发现,活性氧(reactive oxygen species,ROS)在许多疾病发展中发挥着重要作用,也被认为是GERD、Barrett食管的发病重要机制之一[4]。因此,本研究通过建立小鼠慢性束缚应激(Stress)模型,探讨心理应激对食管ROS、抗氧化蛋白、TJ蛋白以及炎症发生的作用。
材料与方法
一、对象
8周龄,SPF级雄昆明小鼠20只,购于新疆实验动物研究中心,许可证号:SCXK(新)2011-0001;实验小鼠饲养于新疆维吾尔自治区维吾尔医药研究所IVC系统动物中心。全例小鼠采用Microsoft Office Excel软件随机分2组(每组10只),即慢性束缚应激组和对照组。小鼠单只饲养在自由进食水的鼠笼内,每日给予12 h昼夜循环,光照均始于8:30分,止于20:30分。
二、方法
1.Stress模型的建立:造模方法,参照我们的前期研究[5-7],大体实验步骤如下;10只慢性束缚应激组小鼠置于用50 ml离心管所制的自制式束缚器中(离心管提前烫制出直径约5 mm的通气孔若干,分布于左右及上侧管壁,管口塑料盖做1小孔以暴露小鼠尾巴),束缚应激均在每日上午10:30~12:30进行,每日限制活动2 h,期间禁食禁水,后放回鼠笼内自由活动,连续束缚14 d。对照组小鼠自由饮水摄食,其余时间2组小鼠处理相同。
2.取材与标本处理:束缚应激第14天下午17:00开始对2组小鼠均进行禁食,于次日上午11:00进行取材。麻醉的小鼠以平卧位固定,从腹部正中至剑突取切口取3 cm切口,下腔静脉取血注入于1.5 ml EP管中。在距离胃食管交界处0.3 cm处和1.5 cm处剪断取材,置于4%中性甲醛固定。
3.食管组织病理学检查:食管标本4%中性甲醛固定24 h后水洗、脱水、透明、浸蜡、包埋,制成4 μm厚切片行H&E染色。
4.间隙测量:2组食管组织常规HE染色后,光学显微镜(油镜)下放大1000倍,并在不同部位上拍摄10张光镜照片,使用Image J等图像处理软件数字化测量细胞间隙。
5.实时定量RT-PCR:采用实时定量(reverse transcription-polymerase chain reaction,RT-PCR)方法检测Nox-4、核转录因子E2相关因子2(Nuclear factor erythroid 2 related factor 2,Nrf-2)、血红素氧合酶-1(Heme oxygenase,HO-1)、闭合蛋白-1(Claudin-1)、闭合蛋白-4(Claudin-4)、咬合蛋白(Occludin)及胞质紧密黏连蛋白-1(Zonula occludens, ZO-1)、单核细胞趋化蛋白-1(Monocyte chemotactic protein 1,MCP-1)、白细胞介素-1β(Interleukin-1β,IL-1β)以及肿瘤坏死因子α(Tumor necrosis factor α,TNF-α)的指标的mRNA表达。取每只小鼠食管组织25 mg,采用TRIzol试剂提取总RNA,采用天根公司Fast Quant RT试剂盒合成第1链cDNA。由上海生工生物工程股份有限公司设计并合成引物,各指标及β-肌动蛋白(actin)引物序列见表1。RT-PCR反应严格按照本研究组前期研究以及试剂盒操作说明进行。反应结束后由电脑自动得出荧光曲线及CT值,采用2-△△CT计算出目标基因的相对表达倍数。
6.酶联免疫吸附(ELISA)测定:取血后不经任何处理,4℃下静置2 h,之后以3500 rpm/min的速度低温离心5 min,取上层血清,-80℃保存,用于后续测定。采用酶联免疫吸附测定(Enzyme linked immunosorbent assay,ELISA)法检测血清中NADPH氧化酶-4(NADPH oxidase-4,Nox-4)、8-羟基脱氧鸟苷(8-hydroxydeoxyguanosine,8-OHdG)及丙二醛(Malondialdehyde,MDA)的含量。实验过程及测量指标浓度的计算严格按试剂盒说明书进行。
三、统计学分析
运用SPSS 22.0软件进行分析,符合正态分布的计量资料均以(±s)表示,2组间比较采用t检验。以P<0.05为差异有统计学意义。
结 果
一、Stress对小鼠食管上皮细胞间距增宽的影响
对照组小鼠食管上皮细胞镜下测量的平均细胞间隙为(0.64±0.04)μm,慢性束缚应激组(1.16±0.02)μm,差异有统计学意义(t=20.63,P<0.05)。见图1。
二、Stress对食管氧化应激的影响
ELISA实验结果显示,与对照组相比,慢性束缚应激组小鼠血液中Nox-4[(9.72±1.80)ng/mlvs(4.54±0.46)ng/ml]、8-OHdG[(4.94±0.58)ng/mlvs(1.44±0.16)ng/ml以及MDA(3.56±0.41)ng/mlvs(1.02±0.12)ng/ml]的释放浓度明显高于对照组,且差异有统计学意义(t=25.54,19.62,13.67,P均<0.05)。见图2。
三、Stress对食管抗氧化蛋白的影响
抗氧化蛋白的RT-PCR实验结果显示,慢性束缚应激组食管组织中Nrf-2和HO-1的mRNA转录水平显著低于对照组,差异有统计学意义(t=-10.36,-9.28,P<0.05)。见图3。

表1 实时定量RT-PCR引物序列
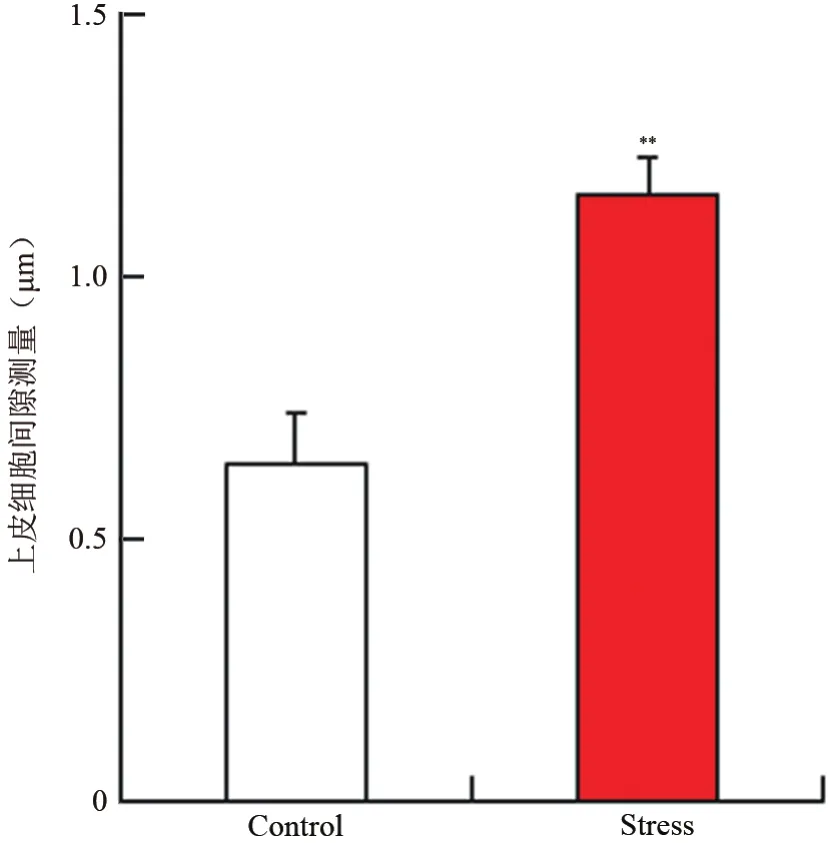
图1 2组食管上皮细胞间隙测量
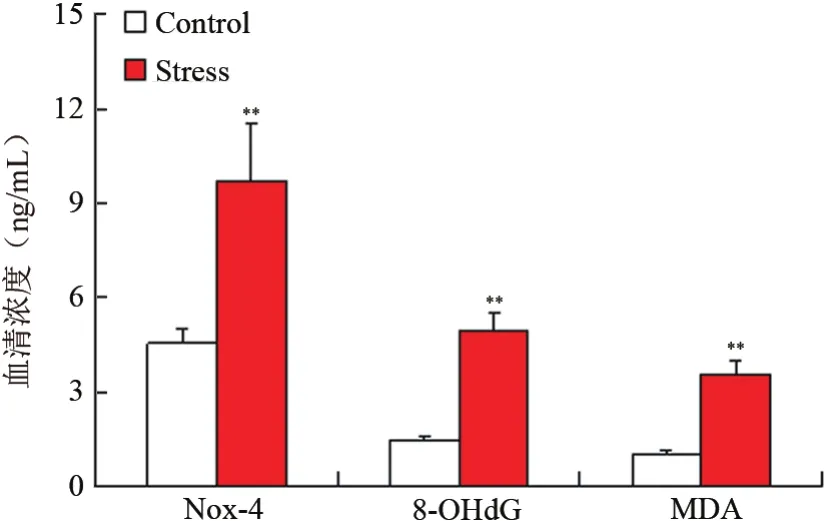
图2 2组食管组织氧化应激指标的mRNA表达情况
四、Stress对食管TJ蛋白的影响
2组小鼠食管组织TJ蛋白重要指标的RT-PCR实验结果显示,慢性束缚应激组TJ蛋白如Claudin-1、Claudin-4、Occludin及ZO-1的mRNA转录水平明显低于对照组,差异有统计学意义(t=-10.23、-9.65、-7.81、-8.75,P<0.05)。见图4。
五、Stress对食管炎症因子的影响
2组小鼠食管组织炎症因子指标的RT-PCR实验结果显示,慢性束缚应激组炎症因(MCP-1、IL-1β、TNF-α)的mRNA转录水平显著高于对照组,差异有统计学意义(t=31.42、42.37、46.83,P<0.05)。见图5。
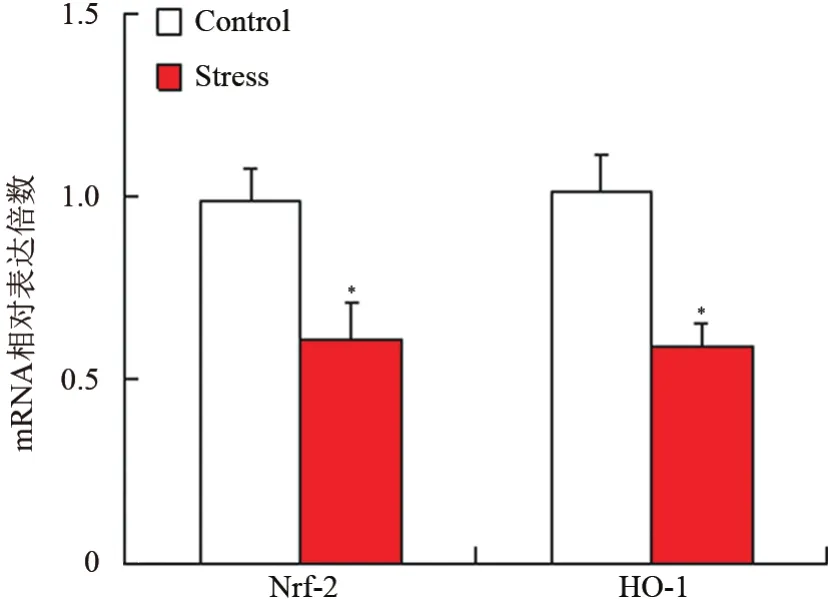
图3 2组食管氧化蛋白的mRNA表达情况
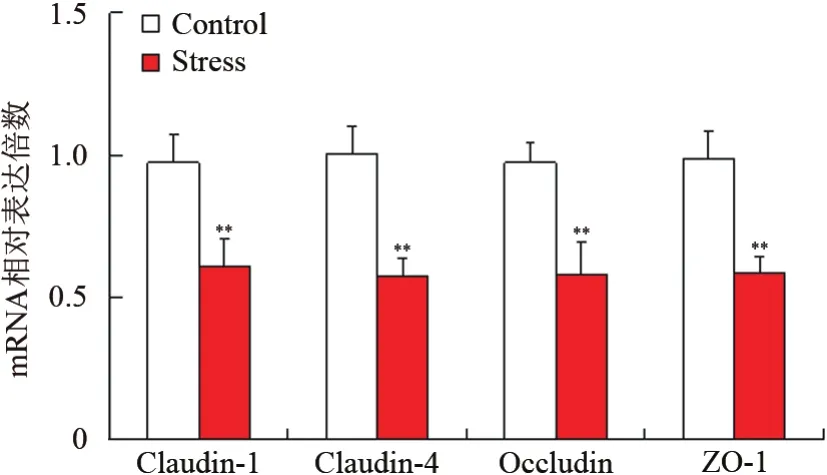
图4 2组食管组织TJ蛋白的mRNA表达情况
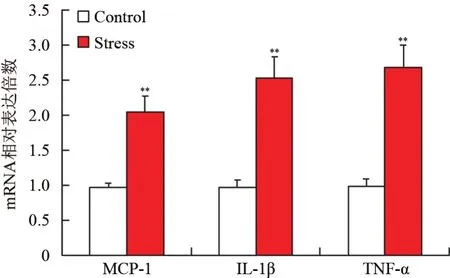
图5 2组食管组织炎症因子的mRNA表达情况
讨 论
食管黏膜防御功能主要由上皮屏障构成,任何一种或多种防御机制的缺陷均可导致食管对胃内容物(胃酸)清除能力降低,继而引起食管上皮损伤,食管上皮TJ蛋白的表达下降是其重要发生机制[8]。食管鳞状上皮对酸性胃液非常敏感。GERD患者在长期持续的胃液刺激下,食管下段的黏膜发生炎症细胞浸润,上皮细胞增生以及DIS等一系列的改变[9]。研究发现,酸反流无明显的GERD患者与健康对照组患者相比食管上皮DIS非常明显,反流性食管炎和非糜烂性食管炎患者均存在不同程度的食管上皮的DIS[10]。当食管上皮DIS持续存在时,伴随H+过多弥散入细胞胞浆和细胞间隙,碳酸氢盐等化学屏障不能够缓冲H+时,H+刺激细胞间隙的酸敏感伤害感受器,导致烧心症状的产生[11]。
GERD是一种多疾病症候群而非单一的发病机制所致,反流症状(烧心、疼痛)会严重影响患者的精神和心理状态。心理应激是机体在受到心理、环境及生理性应激源刺激时所出现的非特异性全身反应。焦虑、抑郁等心理应激与食管高敏感性有着较密切的联系[12]。国外的研究者,在心理压力大鼠模型中发现,压力后大鼠无出现明显的酸反流,而食管上皮细胞间隙出现明显的增宽、通透性增加以及酸敏感受体的大量表达等现象[13]。本研究发现,接受为期2周的心理应激后小鼠出现食管上皮的DIS(1.16±0.02)μm,与对照组(0.64±0.04)μm相比,存在明显的差异。
心理压力增高是诱导ROS发生的重要机制,而ROS也在GERD、Barrett食管和腺癌等诸多疾病的进程中发挥着重要作用[14]。细胞内产生的过量的ROS就能引起生物膜脂质过氧化,细胞内蛋白及酶变形,DNA损害,最后导致细胞凋亡,组织氧化损伤。ROS与促炎症细胞因子常常在炎症部位同时存在,ROS能上调促炎症因子的基因表达水平,同时,促炎症细胞能诱导ROS的生成,两者形成正反馈环[15]。国外研究者发现,反流大鼠模型中,GERD发病机制由内源性ROS过度产生有关的,使用抗氧化剂后发现食管组织ROS的产生被抑制,黏膜炎症发生同时也得到了有效的控制[16]。ROS参与食管黏膜的损伤过程,激活细胞内核因子Kappa B(Nuclear factor-kappa B,NF-κB)信号传导通路并促进炎症因子如白细胞介素-8(IL-8)和TNF-α的转录水平,使炎症效应继续扩大,食管黏膜的损伤不断加重[17]。NADPH氧化酶(NADPH oxidase,Nox)为细胞内一组具有氧化活性的酶复合体,是主要的ROS来源,有6个同源物(Nox-1, Nox-3, Nox-4, Nox-5, DUOX1,DUOX2),其中Nox-4与ROS关系较密切的氧化酶[18]。8-OHdG的形成是反应组织DNA氧化损伤和致癌的重要生物标记物(Bio-marker)。ROS的代谢产物MDA和不饱和醛引起蛋白质交联,使蛋白质失去功能,还具有致突变,致癌活性等作用[19]。这些重要ROS标记物在食管组织中表达及上皮细胞DIS发生中的意义仍需进一步的研究。
细胞内同时具有几种抗氧化蛋白体系,例如;Nrf-2以及下游基因HO-1是细胞内抗氧化防御的重要蛋白,能防止活性氧的损伤作用[20]。Nrf-2/HO-1通路调控组织或细胞内内源性解毒酶及抗氧化应激酶的表达[21]。Chen等[22]研究发现,Nrf-2基因敲除小鼠出现胃酸反流并导致食管及胃底角化,Nrf-2缺乏进一步减少了被回流抑制的单层细胞的跨膜电阻值,从而引起食管DIS、黏膜损伤并使得食管上皮屏障功能异常。因此,机体受到心理应激作用导致ROS产生过多,超出机体氧化物的清除能力,使氧化与抗氧化系统失衡,而引起氧化损伤的加重。本研究结果显示,Stress小鼠食管组织中ROS重要指标(Nox-4、8-OHdG、MDA)和抗氧化蛋白(Nrf-2、HO-1)的mRNA表达以及血液中的释放浓度与对照组相比,存在明显的差异,证实了心理应激可诱导食管组织ROS的过量表达和抗氧化蛋白的降低。更重要的是,心理应激后小鼠食管上皮TJ蛋白指标(Claudin-1、Claudin-4、Occludin、ZO-1)以及促炎症因子(MCP-1、IL-1β、TNF-α)的mRNA表达量,与对照组相比,存在明显的差异。因此,我们认为氧化/抗氧化防御系统的平衡在维持食管黏膜稳态及屏障中发挥着重要的作用。
综上,食管黏膜的损伤,酸反流,食管动力学的改变等都不能完全全面地解释GERD烧心、胸痛的症状的发生[23]。以DIS为代表的食管上皮屏障破坏,可使迷走神经末梢暴露,引起其对各种刺激的反应敏感化,甚至使分布于黏膜上层内的神经突起产生兴奋,从而导致轴突末梢释放神经递质,直接引起食管感觉异常及疼痛反应[24]。本研究前期的工作中发现,不同亚型GERD(非糜烂性反流病、反流性食管炎)患者中酸反流可激活致敏指标(TRPV-1、PAR-2)受体,进而引起食管高敏感性产生[25]。结合我们前期研究和根据本研究结果,我们认为心理压力使食管氧化、抗氧化防御系统受损,进而出现食管上皮存在的TJ蛋白结构和功能的异常,可能是GERD发病机制之一。然而,那些有GERD症状而无酸反流的患者症状产生机制尚未清楚,心理压力与食管超微结构改变的确切的机制也待进一步研究明确。

