十字花科植物与食用菌共培养通过根系分泌物促进菌丝生长
薛蓉蓉, 罗智捷, 黄宇晴, 覃丽谦, 胡 林, 宋圆圆, 曾任森, 王 杰
(1.福建农林大学作物科学学院/作物遗传育种与综合利用教育部重点实验室;2.福建农林大学生命科学学院,福建 福州 350002)
植物的化感作用是活体植物产生并以挥发、淋溶、分泌和分解等方式向环境释放次生代谢物质,而对周围的植物产生有益或有害的影响, 这一自然现象是自然界中普遍存在的一种化学生态学现象[1,2].现已有大量研究表明[3], 化感作用对自然植物群落的形成、演替和农作物对病草害的抗性以及连、间、套作方式有重要的影响.因此,如何使化感作用在农业中获得实际应用已成为广泛关注的问题.
根系分泌物对根际或土壤微生物的影响是化感作用研究的重要内容之一,植物在生长期间不断地通过根系释放分泌物影响其周围生物的生长[4,5].研究表明[6],将具有不同化感潜力的分蘖洋葱与黄瓜共培,发现分蘖洋葱根系分泌物可以促进黄瓜的生长,并提高黄瓜根际土壤细菌和放线菌的数量.同样,小麦和大豆根系浸提液可以显著地促进黄瓜的生长,并且抑制黄瓜枯萎病菌的生长[7].
十字花科植物常被称作为化感作物[8],越来越多的研究表明[9,10],十字花科植物常会影响其他植物生长.在对外生菌根真菌的研究中发现,萝卜的根系分泌物可以促进自然界中常见的一种外生菌根真菌土生空团菌(CenococcumgeophilumFr.)的生长[11].植物除了通过根系分泌物影响周围生物的生长外,其挥发物也有着一定作用,例如黑芥菜和油菜的挥发物对油菜核盘菌菌丝生长有明显的抑制作用[12].
食用菌栽培历史悠久,食用菌产业也已成为我国农业产业中仅次于粮、棉、油、果、菜的第六大产业[13],菌菜间套作是近年来发展起来的高效栽培技术,通过食用菌与各种蔬菜间套作,改善生态环境,获得菌菜双丰收,从而提高经济效益[14-16].对于菌菜互作的机理,目前主要的研究集中于十字花科蔬菜冠层下的微环境对食用菌生长的影响[17],而关于十字花科植物化感效应对食用菌生长的影响鲜有报道.
本研究以食用菌为受体,利用芥菜为供体,研究十字花科植物化感物质(根系分泌物和挥发物)对常见的食用菌菌丝生长的影响,为阐明菌菜共生栽培模式中化感物质的重要作用,揭示化感物质促进食用菌生长的生态学效应提供依据.
1 材料与方法
1.1 试验材料
芥菜[Brassicajuncea(L.) Czern. and Coss.]种子,品种为盖山宽杆芥菜,购于福州市种子站.
常见的6种食用菌株:金针菇[Flammulinavelutiper(Fr.) Sing]、凤尾菇(Pleurotussajur-caju)、香菇[Lentinusedodes(Berk.) Sing]、杏鲍菇[Pleurotuseryngii(DC. ex. Fr.) Quél]、黑木耳[Auriculariaauricula(L.ex Hook.) Underwood]和银耳(TremellafuciformisBerk)均由于福建古田菌业研究院提供.
黑芥子苷(CAS:3952-98-5),英文名称为Sinigrin,标准纯品购买于北京索莱宝科技有限公司.
1.2 培养基
PDA培养基:每升含马铃薯200 g,葡萄糖20 g,琼脂20 g,pH自然.
1/2PDA培养基:每升含马铃薯100 g,葡萄糖10 g,琼脂20 g,pH自然.
1.3 试验方法
1.3.1 植物种子消毒 将适量种子用75%乙醇浸泡30 s,无菌水冲洗3~5次后,用5%次氯酸钠浸泡种子20 min,再用无菌水冲洗5次,最后用无菌水浸泡过夜预发芽.
1.3.2 食用菌和种子培养方法 食用菌培养方法: PDA培养基平板培养.选择固体菌种,用无菌打孔器在菌落边缘截取菌种进行接种,置 25 ℃恒温培养箱中培养20 d.
种子培养方法:在无菌操作台中将表面已消毒种子置于1/2 PDA培养基上,置25 ℃恒温培养箱中培养.
1.3.3 芥菜对食用菌菌丝生长的影响 (1)芥菜和食用菌共培养对菌丝生长的影响:在1/2 PDA平板培养基正中心位置接入真菌,同时以真菌为中心对称点的三角形3个定点位置分别接入1粒已发芽的植物种子,对照处理不放种子.每个菌需要3~5个重复,置 25 ℃恒温培养箱中培养,定期观察和测量菌落直径.
(2)芥菜的挥发物对食用真菌菌丝生长的影响:将无菌的种子接入带有分格1/2 PDA平板培养基内,每个培养皿共4个格子,其中3个格子放入种子,置 25 ℃恒温培养箱中培养5 d后,将菌种接入培养皿的另一格,对照为未接入植物种子的培养基.
(3)芥菜根系分泌物对食用菌菌丝生长的影响:将6粒无菌的植物种子接入1/2 PDA平板培养基中,置25 ℃恒温培养箱中培养15 d后取出植物的幼苗.将培养基进行回收,121 ℃灭菌15 min,重新制作培养基用于接种食用菌菌株,对照为未放置种子的培养基.
(4)黑芥子苷对食用真菌菌丝生长的影响:分别配置含有浓度分别为0.5、1.0、2.0、4.0 mg·mL-1的黑芥子油苷培养基,对照为不添加黑芥子苷的培养基,灭菌后待用.以上培养基分别接入食用菌株,每个处理均为3次重复,放入25 ℃恒温培养箱中培养,定期观察和测量菌落直径.
1.4 数据分析
利用Minitab (Minitab Inc, State College, PA, USA)、Graphpad Prism5 (Graphpad software Inc, San Diego, CA, USA)以及Excel对试验数据进行统计分析和图表的制作.用unpaired Student′st-test分析2种处理之间的差异显著性,用Fisher′s LSD比较法分析多重处理间的差异显著性(P<0.05).
2 结果与分析
2.1 芥菜与食用菌株共培养对菌丝生长的影响
芥菜和食用菌共同培养7 d后,芥菜种子在发芽及生长的过程明显地促进了金针菇、凤尾菇、香菇食用菌菌丝的生长(图1A),但对杏鲍菇、黑木耳和银耳3种食用菌菌丝的生长无明显的影响(图1B).
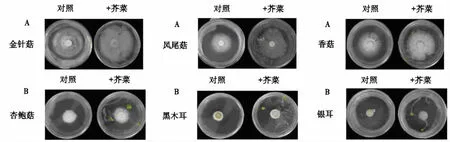
图1 芥菜分别与6种食用菌共培7 d后菌丝形态Fig.1 Mycelial morphology of 6 kinds of edible fungi when co-cultured with mustard seed for 7 d
在无植物共培的情况下,6种食用菌生长速率从快到慢分别为金针菇>凤尾菇>香菇=杏鲍菇>黑木耳=银耳.菌丝长满整个培养皿所需要的时间顺序为金针菇需要11 d,凤尾菇需要15 d, 香菇和杏鲍菇均需要17 d, 黑木耳和银耳均需要25 d.在有植物共培的情况下,金针菇、凤尾菇和香菇的生长周期明显缩短,分别缩短2、2和6 d(表1~3).
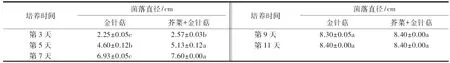
表1 芥菜与金针菇共培养对金针菇菌丝生长的影响1)Table 1 The effects of mustard co-cultivation on the colony diameter of F.velutiper
1)数据为平均值±标准误(n=3);同行数据后附不同字母者表示数据间存在显著差异(P<0.05),附相同字母者表示数据间无显著差异(P>0.05).

表2 芥菜与凤尾菇共培养对凤尾菇菌丝生长的影响1)Table 2 The effects of co-cultivation on the colony diameter of P.sajur-caju
1)数据为平均值±标准误(n=3);同行数据后附不同字母者表示数据间存在显著差异(P<0.05),附相同字母者表示数据间无显著差异(P>0.05).
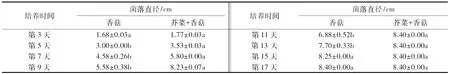
表3 芥菜与香菇共培养对香菇菌丝生长的影响1)Table 3 The effects of co-cultivation on the colony diameter of L.edodes
1)数据为平均值±标准误(n=3);同行数据后附不同字母者表示数据间存在显著差异(P<0.05),附相同字母者表示数据间无显著差异(P>0.05).
此外,对于杏鲍菇而言,芥菜种子的生长对其菌丝的生长无显著影响(表4).芥菜分别与黑木耳、银耳共培,从第11天起,蔬菜种子生长的过程开始促进黑木耳和银耳菌丝的生长,但从第19天开始,蔬菜种子的生长对这两种菌株菌丝生长的影响与对照相比无明显著差异(表5和6).
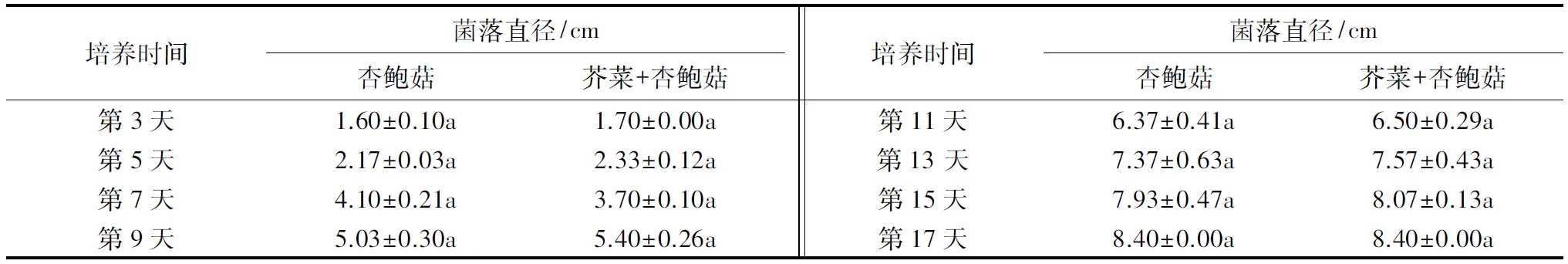
表4 芥菜与杏鲍菇共培养对杏鲍菇菌丝生长的影响1)Table 4 The effects of co-cultivation on the colony diameter of P.eryngii
1)数据为平均值±标准误(n=3);同行数据后附不同字母者表示数据间存在显著差异(P<0.05),附相同字母者表示数据间无显著差异(P>0.05).
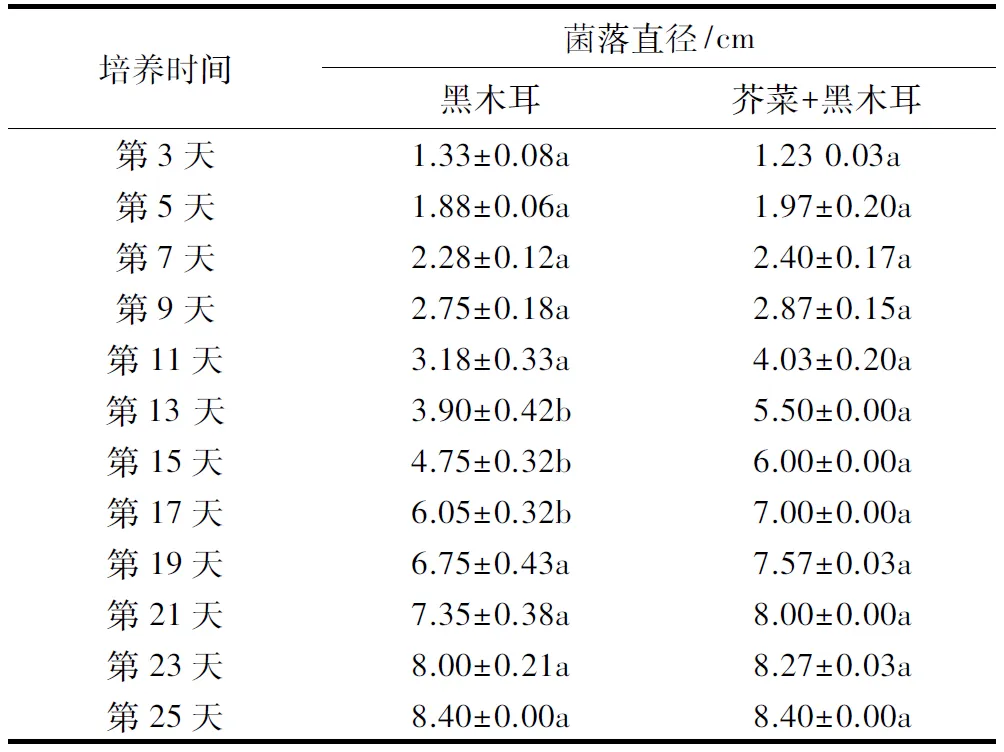
表5 芥菜与黑木耳共培养对黑木耳菌丝生长的影响1)Table 5 The effects of co-cultivation on the colony diameter of A.auricula
1)数据为平均值±标准误(n=3);同行数据后附不同字母者表示数据间存在显著差异(P<0.05),附相同字母者表示数据间无显著差异(P>0.05).

表6 芥菜与银耳共培养对银耳菌丝生长的影响1)Table 6 The effects of co-cultivation on the colony diameter of T.fuciformis
1)数据为平均值±标准误(n=3);同行数据后附不同字母者表示数据间存在显著差异(P<0.05),附相同字母者表示数据间无显著差异(P>0.05).
2.2 芥菜幼苗挥发物对凤尾菇、金针菇、香菇菌丝生长的影响
通过将芥菜和食用菌分隔培养,验证芥菜幼苗挥发物是否会影响食用菌生长.当芥菜种子长出子叶后分别接入凤尾菇、金针菇和香菇3种菌株,共培5天后,发现芥菜挥发物对3种食用菌菌丝的生长并无显著影响(图2).
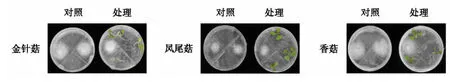
图2 芥菜挥发物处理5天后金针菇、凤尾菇和香菇菌丝形态Fig.2 Mycelial morphology of F.velutiper, P.ajur-caju and L.edodes after treated with mustard volatiles for 5 d
2.3 芥菜幼苗根系分泌物对凤尾菇、金针菇、香菇菌丝生长的影响
将芥菜根系分泌物添加到培养基中培养食用菌,验证芥菜根系分泌物是否会影响食用菌的生长.结果发现芥菜根系分泌物明显促进了凤尾菇、金针菇、香菇菌丝的生长(图3),试验处理7天后,在根系分泌物的影响下处理组的凤尾菇、金针菇和香菇的菌落直径均显著地大于无根系分泌物处理的对照,分别约为对照菌落直径的1.5、1.4和1.3倍(图4).
2.4 不同浓度的黑芥子苷对凤尾菇、金针菇、香菇菌丝生长的影响
根据2.3试验结果,可得知芥菜根系分泌物可以促进凤尾菇、金针菇和香菇菌丝的生长.芥菜根系分泌物中含有大量的硫苷类次生代谢产物,选取其中最常见的一种物质黑芥子苷,验证是否硫苷在芥菜促进食用菌菌丝生长中起着重要作用.金针菇菌株在含有黑芥子苷的培养基上生长5天,其菌落直径明显大于对照组;但从第6天开始,当浓度为2和4 mg·mL-1,金针菇菌丝生长明显受到抑制(图5A). 黑芥子苷浓度达到2 mg·mL-1,从第3天对凤尾菇菌丝的生长有抑制作用,当浓度为0.5和1 mg·mL-1时,黑芥子苷对凤尾菇菌丝的生长有促进作用(图5B);但是,黑芥子苷浓度达到4 mg·mL-1时,仅香菇菌丝的生长有促进的趋势(图5C).

图3 芥菜根系分泌物处理7天后金针菇、凤尾菇和香菇菌丝形态Fig.3 Mycelial morphology of F.velutiper, P.sajur-caju and L.edodes after treated with mustard root exudates for 7 d

图4 芥菜根系分泌物处理7天后金针菇、凤尾菇和香菇菌丝生长的影响Fig.4 The effects of mustard root exudates on colony diameters of F.velutiper, P.sajur-caju and L.edodes after 7 d

图5 不同浓度黑芥子苷对凤尾菇、金针菇和香菇菌丝生长的影响Fig.5 The effects of different concentrations of sinigrin on colony diameters of F.velutiper, P.sajur-caju and L.edodes
3 结论与讨论
十字花科芥菜发芽及生长过程明显促进了3种食用菌金针菇、凤尾菇和香菇株菌丝的生长,而对其余3种食用菌生长无明显的促生作用.为了确认是否是芥菜挥发物起促生作用,本研究设计试验将芥菜和食用菌用隔板隔开,排除根系分泌物的影响,结果发现芥菜的促生作用消失,进而证明芥菜的挥发物对食用菌菌丝生长无显著的影响,因此可以推断植物根系分泌物在刺激食用菌菌丝生长过程中起着关键作用.
芥子油苷主要存在于十字花科蔬菜当中,在众多的芥子油苷中,有4种常见的芥子油苷,分别是黑芥子苷、白芥子苷、葡萄糖芫菁芥素、葡萄糖异硫氰酸成-4-烯酯[18].芥子油苷分布于十字花科植物的几乎所有部位,它的组成和含量因品种、生境而异,其在同一株植物中组成和含量也会随着组织部分和生长阶段发生变化[19,20].它以及其降解产物具有多种生化活性,介导着植物与环境之间的相互作用,从而备受关注[21,22].对于芥子油苷化感作用的研究很多,主要集中在影响其他植物种子萌发、生长方面.在种过甘蓝的土壤上,豆科植物苜蓿产量降低,并且在土壤中放置甘蓝根块,苜蓿种子萌发也会受到明显抑制[23].将十字花科芸苔属植物残余体覆盖于土壤表面或与土混合,可以抑制杂草种子萌发,达到控制杂草的目的[24].随着对植物次生代谢产物认识的不断深入,发现芸苔属植物中起化感作用的物质主要是芥子油苷及其水解产物[25].已有研究证实[26],十字花科植物根系所分泌的芥子油苷的水解产物能够促进菌根真菌卷伞菌和彩色豆马勃菌丝的生长.本研究表明,黑芥子苷对食用菌菌丝的生长与其浓度有密切的关系,黑芥子苷浓度达到4 mg·mL-1时,对香菇菌丝生长有明显的促进作用,但浓度高于2 mg·mL-1时,金针菇和凤尾菇菌的生长会受到抑制,只有在浓度低于2 mg·mL-1时,3种食用菌的生长才表现出明显加快.植物分泌部分化学物质能够促进真菌的生长速率,这些有效化合物被称为“M-factor”[27].一些研究表明[28,29],植物根系未知的分泌物在一定的浓度范围内可以促进土壤真菌的繁殖,因此除了考虑光照和通气之外[30],在进行蔬菜与食用菌共培时,还应注意蔬菜的种植密度和布局,实现菌菜双丰收.
在实际生产中也可将十字花科植物根系分泌物或者幼苗提取物作物促生物质加入到培养基中,为食用真菌菌株的快速扩繁提供一种可行的途径.

