外源硅对植物抗盐性影响的研究进展
朱永兴,夏雨晨,刘乐承,尹军良,马东方
(1 长江大学园艺园林学院/湿地生态与农业利用教育部工程研究中心,湖北荆州 434000;2 植物病虫害生物学国家重点实验室/中国农业科学院植物保护研究所,北京 100193;3 长江大学农学院,湖北荆州 434000)
盐胁迫是世界范围内重要的非生物胁迫之一,严重影响作物的产量和品质。目前,全世界约有8亿hm2以上的土地受到盐害的威胁,占到全球面积的6%[1]。在我国盐碱地和次生盐碱地的面积达0.3亿hm2以上,占可用耕地面积的25%,并且呈现逐年增加的趋势[2]。因此,如何提高作物的抗盐能力已引起全世界科研工作者的关注。硅是地壳中第二大丰富元素,在植物体内广泛存在。尽管硅不是高等植物生长的必需元素,但大量研究表明,硅参与植物对多种逆境胁迫的响应,其中包括盐胁迫[3-5]、干旱[6]、高温[7]、重金属[8]和病虫害胁迫等[9](图1)。此外,硅是环境友好型元素,无腐蚀性且无污染,因此硅肥可以作为发展绿色有机农业的优质肥料,有利于农业的可持续发展[10]。研究硅缓解植物盐胁迫的机理,可为实际生产中解决农作物盐害问题提供理论基础。
1 硅与逆境胁迫相关研究大数据分析
借助大数据分析的方式,笔者对当前与硅参与调控逆境胁迫的相关研究进行了收集和汇总,总计检索到研究性论文近200篇,这些研究报道了硅对盐胁迫 (salt stress)、干旱胁迫 (drought stress)、重金属和非金属胁迫 (Al、As、Cd、Cu、Mn、Pb、Sb、Zn胁迫)、生物胁迫 (biotic stress)、冷害胁迫 (freezing stress)、低氧胁迫 (hypoxia stress)、营养缺乏胁迫(nutrient deficiency)、紫外胁迫 (UV-B stress)、酸雨胁迫 (acid rain stress) 的缓解作用;硅对植物细胞壁(cell wall) 和营养和吸收 (nutrient and absorbing) 的影响;以及硅转运体 (silicon transporter) 的克隆和在植物抗逆过程中所起的作用。从大数据分析结果 (图1)来看,目前硅与逆境胁迫的相关研究主要集中在硅与盐胁迫、重金属和非金属胁迫以及干旱胁迫三个方面,其中以盐胁迫研究最为系统和全面,研究材料涉及单子叶植物,如水稻、小麦、大麦、高粱、玉米,双子叶植物,如黄瓜、番茄、烟草、南瓜、花生,和木本植物,如芒果、苦楝树、香蕉等。研究内容涉及到硅与水分代谢 (water metabolic),光合(photosynthesis),氧化胁迫 (oxidative stress),离子含量 (ion content),激素 (hormone),多胺 (polyamine),以及硅转运体 (Si transporter) 等七个方面。因此,本综述重点关注与盐胁迫相关研究,并从目前研究较多的硅的吸收和转运、离子平衡、水分代谢、活性氧和光合、组学研究等方面对有关硅缓解盐胁迫的主要机制进行了综述,以及针对现有研究的不足提出了亟需进一步深入探索的研究方向,旨在为后续研究提供参考。
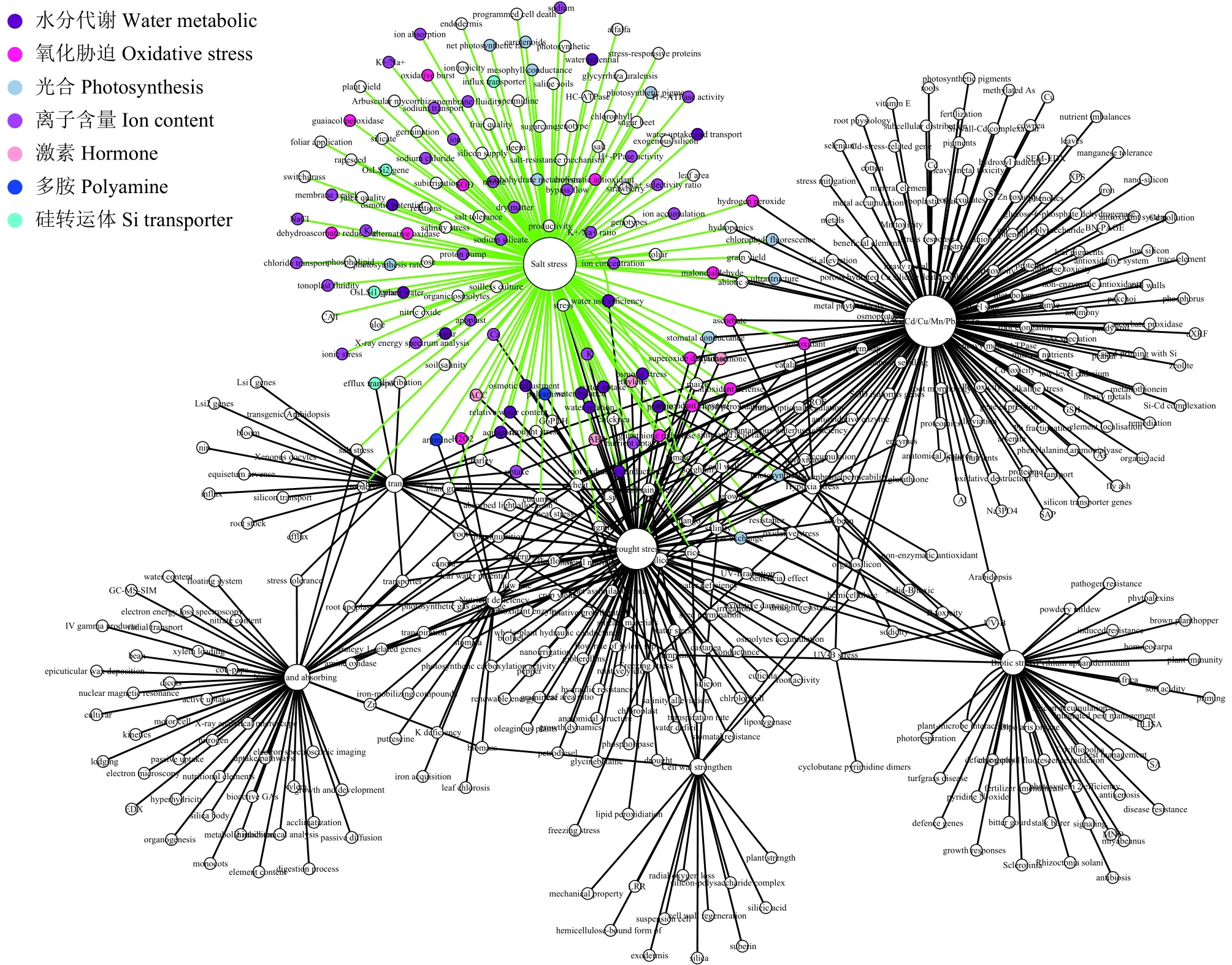
图 1 硅与逆境胁迫相关研究以及硅缓解盐胁迫的主要研究方向Fig. 1 Researches on the beneficial effects of silicon on abiotic and biotic stress and the main aspects that related to the alleviation effect of silicon on salt stress
2 植物对硅的吸收及转运
硅 (Si) 在土壤中的含量仅次于氧,占地壳的28%。植物主要吸收和利用单分子的硅酸Si(OH)4,但是在土壤中,硅主要以化合物如氧化物和硅酸盐的形式存在,单硅酸和可转化为单硅酸的盐类含量甚微,大部分都无法被植物吸收[11-12]。此外,随着各种化学肥料的大量使用和土地的过度种植,土壤中能被植株所吸收的硅被大量消耗,造成了许多土壤的供硅不足。研究植物对土壤中有效硅的吸收和转运的机理,可为实际生产中硅肥的合理使用提供理论依据。
尽管所有的植物都含有硅,但由于不同植物根系对硅吸收能力存在差异,植物体内硅含量在不同物种之间差异很大[13]。一般来说,植物中吸收硅的方式有主动、被动和拒绝三种,所对应的硅积累植物类型分别是:1) 高积累型 (Si accumulator) 这类植物对硅的吸收量大于随水分吸收进入植物的硅量,以干重计,SiO2在地上部的硅积累量大于1%,如水稻 (Oryza sativaL.)、高粱 (Sorghum bicolorL.) 等;2)中间型 (intermediate type) 该类植物对硅的吸收速率和对水分的吸收速率一致,以干重计,地上部硅积累量在0.5%~1%,如黄瓜 (Cucumis sativusL.) ;3)低积累型 (excluder) 这种类型的植物对硅的吸收速率低于对水分的吸收速率,以干重计,地上部硅积累量小于0.5%,如番茄 (LycopersiconesculentumMill.)[14-16]。但是,植物对硅的吸收方式往往并不是只有一种,例如水稻、玉米 (Zea maysL.)、向日葵(Helianthus annuusL.) 和冬瓜 (Benincasehispida) 中,硅的主动吸收和被动吸收是同时存在的,这可能与植物类型和外界环境中硅含量的不同有关[17]。此外,植物对硅的积累类型也可以用Si/Ca比值来划分,Si/Ca > 1的植物对硅的吸收为主动吸收类型,0.5 <Si/Ca < 1和Si/Ca < 0.5分别为被动和拒绝吸收硅的类型,但是这种分类方法存在一定的问题,例如当植株遭受盐胁迫时,植物对Ca的吸收会受到一定影响,此时用这个标准来划分硅吸收类型则是不合理的[14,18]。
通常认为,硅以单硅酸的形式从土壤溶液中被植物的根系吸收,通过木质部蒸腾流向地上部运输,最终经过蒸腾脱水以无定型硅 (SiO2·nH2O) 或植物蛋白石的形式沉积在植株不同组织的细胞壁和细胞间隙中,少量则以溶解态单硅酸或可溶性硅酸盐的形式参与植物生理生化过程[10,19-20]。近年来,关于植物对硅吸收和运输的研究取得了一定进展。到目前为止,已经从单子叶植物水稻[21-22]、玉米[23-24]、大麦 (Hordeum vulgareL.)[23,25-26]、小麦 (Triticum aestivumL.)[27]和双子叶植物南瓜 (Cucurbita moschataDuch.)[28]、黄瓜[29]以及木贼属植物木贼(Equisetum arvense)[30]等作物中鉴定到多个硅转运蛋白 (图2)。水稻中,Ma等 (2002) 利用锗和硅化学性质类似这一特点,筛选出了硅吸收量仅为野生型水稻十几分之一的硅突变体水稻,随后Ma等[21-22]利用该突变株克隆到了两个位于根系的硅转运蛋白OsLsi1和OsLsi2。OsLsi1及其同源基因编码硅输入蛋白,属于水通道蛋白家族的NIP亚家族 (Nod26-like major intrinsic protein),定位于根系外皮层和内皮层凯氏带细胞的外侧质膜上,负责将根系外面的硅转运到根系外皮层细胞。而OsLsi2及其同源基因则编码硅输出蛋白,属于阴离子转运体 (anion transporters),定位于根系外皮层和内皮层凯氏带细胞的内侧质膜上,负责将细胞内的硅转运到木质部[21-22]。
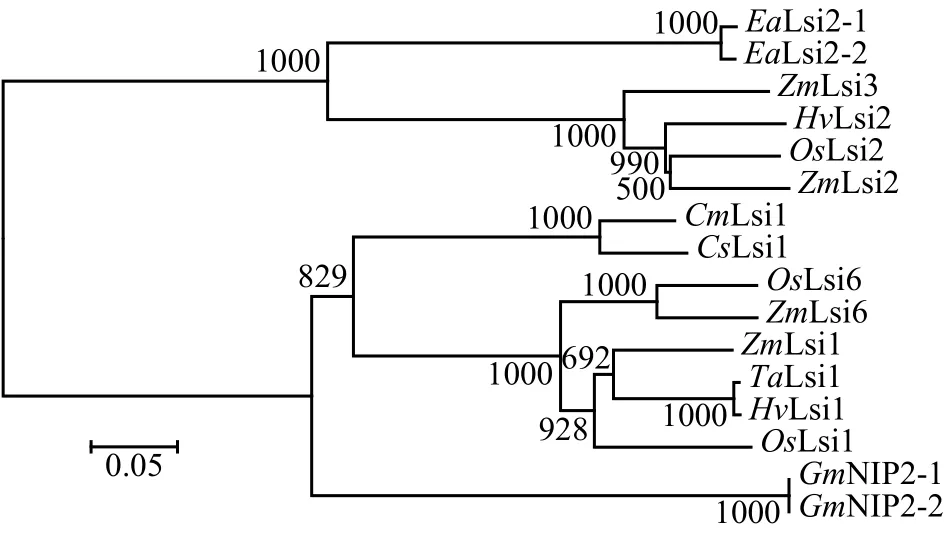
图 2 已克隆植物硅转运体的系统发育分析Fig. 2 The phylogenetic analysis of cloned Si transporters in plants
目前,在不同物种中鉴定到的Lsi1和Lsi2均定位于细胞质膜上,但是它们在根系细胞上的定位随着物种的不同而存在一定差异。例如,大麦中,HvLsi1定位在胚根表皮细胞和皮层细胞以及侧根下皮细胞的外侧,而HvLsi2仅定位于根系内皮层细胞质膜上,其分布没有极性[23,25-26]。Mitani等[28]在南瓜中鉴定到具有硅输入功能的硅转运蛋白CmLsi1,亚细胞定位结果表明CmLsi1定位在所有根系细胞的质膜上,其分布不具有极性。最近,Sun等[29]在黄瓜中鉴定到一个硅转运体CsLsi1,该转运体位于根尖和根毛细胞内皮层和外皮层细胞的远轴端,负责将硅从细胞外转运到细胞内。除了Lsi1和Lsi2外,Yamaji等[31-32]发现另外一个硅转运蛋白OsLsi6,该转运蛋白主要在水稻叶鞘和叶片靠近导管侧的木质部薄壁细胞质膜上表达,负责将木质部汁液中的硅卸载和分配到叶肉组织中[31-32]。此外,OsLsi6也在根尖的细胞质膜中表达,其功能不是将根系吸收的硅向地上部运输,而是将其留在根尖,从而提高根系对水分胁迫的耐受能力。这些硅转运蛋白在细胞定位上的差异可能是影响不同物种的硅吸收能力的主要因素之一,因此,更多物种中硅转运体的功能需要进一步的研究。
3 外源硅缓解盐胁迫的机理
盐胁迫是威胁全球农业的重要因素之一。盐胁迫对植物的影响主要体现在以下几个方面:1) 渗透胁迫。土壤中盐离子的浓度过高,会降低土壤溶液的渗透势,降低植株根系对水分吸收的能力,造成生理干旱。2) 离子毒害。盐胁迫造成的离子毒害主要是Na+和Cl-毒害,过多的Na+和Cl-在细胞内的积累会造成离子不平衡和代谢失调。3) 离子不平衡 (营养失调)。高盐环境中植物吸收过多的Na+离子,由于离子间的拮抗作用,抑制其他一些必需元素如Ca和K的吸收,引起生育障碍[10,33-34]。大量研究表明,硅在多种植物响应盐胁迫的过程中起到非常重要的作用[35-36]。在此,笔者对目前报道的硅缓解植株盐胁迫的主要机理进行了总结。
3.1 外源硅对盐胁迫下植物离子平衡的影响
高浓度的盐离子,特别是Na+和Cl-往往会影响植株对其他营养元素如K、Ca等的吸收,并且会导致细胞膜透性增加,电解质外渗,引起细胞代谢紊乱和失调[33-34]。目前,关于硅缓解植物盐胁迫机理的研究多集中在缓解离子毒害上。研究表明,加硅可以显著降低植株地上部和根系Na+的积累。在盐胁迫处理后的大麦中,加硅可以显著降低根系Na+和Cl-的水平,同时增加K+的含量,并且可以使Na+和K+更均匀的分布在整个根系中以降低其对根系的伤害,这也被认为是硅缓解大麦盐胁迫的主要机理之一[37]。在苜蓿中,同单独盐胁迫相比,加硅显著降低根系的Na+含量,增加地上部K+的含量,对地上部Na+积累没有影响[38]。但是,在水稻中,Gong等[19]研究表明,加硅没有改变水稻根系和地上部K+以及根系Na+含量,而是通过在根系内皮层和外皮层的沉积,降低根系Na+随木质部蒸腾流向地上部的运输。随后,Yin等[39]在短期盐胁迫处理后的高粱中也发现硅可以显著降低叶片Na+含量,但这一降低是否与改变根系结构和/或降低木质部蒸腾流有关尚不清楚。而在小麦中,Tuna等[40]报道加硅可以同时降低Na+在小麦地上部和根系的积累,促进盐胁迫下小麦的生长。Garg和Bhandari[41]发现加硅可以降低鹰嘴豆(Cicer arietinumL.) 根系对Na+的吸收以及向叶片的转运,提高K+/Na+比值。从这些研究可以看出,加硅可以通过降低根系对Na+的吸收和/或向地上部的转运来缓解盐胁迫带来的损伤,但是这一机理具有物种和品种间的差异,并且不同物种间硅对Na+吸收的调控可能受根系硅吸收能力的影响。
在高盐环境中,植物可以通过对离子的选择性吸收、外排和区域化分布来维持细胞正常生理代谢所需要的离子稳态。Na+/H+逆向转运蛋白在Na+的外排和区隔化分布到液泡的过程中起到非常重要的作用。在高等植物中,位于细胞质膜上的H+-ATPase利用ATP水解产生的能量将H+泵出到细胞外,由此产生一个跨膜的质子梯度,为质膜上的Na+/H+逆向转运蛋白提供驱动力,将H+顺电化学梯度转运至细胞的同时将Na+逆着其电化学梯度排至细胞外[42-43]。前人在大麦中的研究表明,同单独盐胁迫相比,加硅显著提高根系质膜H+-ATPase,以及液泡膜H+-ATPase和H+-PPase的活性[44-45]。硅介导的H+-ATPase活性的升高有利于Na+的外排,而液泡膜H+-ATPase和H+-PPase活性的升高则有利于根系Na+区隔化分布到液泡中,从而降低根系盐离子毒害[44-45]。但是,硅对Na+/H+逆向转运蛋白、质膜H+-ATPase和液泡膜H+-ATPase的活性是否具有直接调控作用仍需进一步研究。此外,土壤中盐离子浓度过高会影响植物对其他元素如N、Ca、P、Mg、Fe等的吸收,造成植株体内离子平衡失调。加硅可以提高多种植物根系和叶片大量元素如Ca、P、Mg和微量元素如B、Fe、Zn、Mn 等的含量[46-49]。
近期,一些研究者提出硅对盐胁迫下离子含量,特别是Na+和K+含量的影响可能与硅对多胺代谢的调控有关。多胺是生物中普遍存在的,它是在代谢过程中产生的一类低分子量脂肪族含氮物。在植物中主要以游离态、结合态和束缚态三种形态存在[50]。盐胁迫下,多胺可以调节植物体内Na+和K+经由非选择性离子通道 (non-selective cation channels) 的运输,降低Na+毒害[51]。在高粱中,Yin等[52]发现加硅可以通过提高游离态和总多胺含量,降低Na+积累,并且这一结果经过外源施加亚精胺 (spermidine,Spd)以及多胺合成抑制剂DCHA (dicyclohexylammonium sulphate) 的试验得到了进一步的验证。同加硅一样,外源施加Spd也可促进盐胁迫下高粱的生长,但是外源施加DCHA消除了硅对盐胁迫下高粱生长的促进以及硅对Na+积累的降低效果。Wang等[53]在黄瓜中也发现硅对盐胁迫下多胺含量具有一定的调控作用。但是,多胺对K+的调节作用与植物特别是根系的生长情况有关,在一定条件下,多胺不仅不会降低,反而会促进盐胁迫下K+的外流[54]。因此,硅是否通过调节多胺代谢,以及在何种条件下可以通过调节多胺代谢降低Na+积累需要更多的试验证据来支持。
越来越多的研究表明,降低Na+含量并不是硅缓解植物盐胁迫的唯一机理。例如在番茄中,Romero-Aranda等[55]研究发现,加硅并没有降低叶片Na+和Cl-浓度,而是通过提高组织含水量对已经吸收的盐离子起到稀释作用。Chen等[56]在小麦中的研究显示,加硅既可以缓解盐胁迫造成的离子毒害,又可以缓解其造成的渗透胁迫,并且对后者的缓解效果更加明显。在黄瓜中,Zhu等[4]认为,硅对黄瓜地上部和根系Na+含量的影响具有品种间的差异,并且在两个黄瓜品种中,降低植株Na+含量均不是硅缓解黄瓜盐胁迫的主要机理。但是,目前关于硅缓解盐胁迫造成的渗透胁迫的研究有限,不利于进一步揭示硅缓解盐胁迫的机理。因此,硅对盐胁迫下植株水分状况的调控机理亟需探讨。
3.2 外源硅对盐胁迫下植物水分状况的影响
盐胁迫下,外界环境和植物内部之间的渗透差会引起渗透胁迫,当外界环境的渗透势高于细胞内部的渗透势时,根系吸水困难,造成生理干旱。短期盐胁迫下,由于高浓度盐离子引起的渗透胁迫是影响植物生长的主要胁迫,但前期关于硅缓解盐胁迫的研究多集中在缓解离子胁迫方面,硅对盐胁迫下水分代谢的影响仅仅涉及到蒸腾速率、叶片含水量等方面,而对于硅调控水分吸收和转运调控规律的综合研究较少。早期的研究认为,硅可通过在植物叶片表面的沉积降低蒸腾速率,减少植株蒸腾失水,维持植株内较高的水分含量[57]。但是也有研究表明,加硅可提高叶片的蒸腾速率[19]。近期,越来越多的研究发现,盐胁迫下加硅可以促进根系对水分的吸收,增加植株含水量。Li等[47]在番茄中的研究表明,加硅可以促进根系生长,同时提高根系水力学导度和叶片水分含量。Liu等[58]报道,高粱中,硅可以通过调节水通道蛋白的活性缓解盐胁迫造成的根系水导的降低,促进根系水分吸收,提高叶片含水量,而叶片水分含量的升高有利于维持气孔处于开放状态,提高对CO2的利用效率,有利于光合作用的正常进行。Zhu等[4]在两个黄瓜品种‘津优1号'和 ‘津春5号' 中的研究发现,加硅可通过提高根系质膜水通道蛋白的表达提高盐胁迫下根系水力学导度,同时提高茎水导,促进根系对水分的吸收以及水分向地上部的转运,最终增加叶片含水量,对已经吸收的盐离子起到稀释的作用,缓解盐离子带来的毒害。此外,加硅还增加了黄瓜根系的活跃吸收面积和根系的水分吸收速率,但是硅的这一作用是否与根系结构的改善有关尚不清楚。Wang等[53]在另一个黄瓜品种,‘津春10号'中也发现了类似的结果,但不同的是,加硅在改善了黄瓜‘津春10号'地上部含水量的同时,还显著降低了叶片Na+含量,增加了K+含量,这可能和两个研究中所用黄瓜品种、盐胁迫时间和浓度不同有一定关系。在硅改善植株水分状况的研究中,有研究者认为硅在细胞壁上的沉积提高了木质部导管的亲水性,从而影响水分在木质部的运输能力[59]。但是Liu等[60]提出,在高粱中,茎水导不是影响水分胁迫条件下水分运输的主要限制因素。因此,硅对不同植物导管结构的影响需要进一步研究。此外,在证明硅可以通过提高质膜水通道蛋白的表达来提高根系水导的研究中,研究者均用到了水通道蛋白抑制剂HgCl2[4,58,60]。例如,在高粱中,盐胁迫下加硅处理可显著提高叶片的蒸腾速率,但是经HgCl2处理后,盐胁迫和盐加硅处理的蒸腾速率均大大降低,并且差异消失,但是经恢复剂恢复之后,蒸腾速率均上升,且不同处理间蒸腾速率的差异也得到恢复[60]。但需要注意的是,Hg2+既可以作为水通道蛋白抑制剂,也可以抑制K+的吸收,而K+是重要的渗透调节物质,对根系水分的吸收和运输具有调控作用[61-62]。硅对水通道蛋白表达和活性的调控机制需要更多的试验证据来揭示和证明。
为保证盐胁迫下水分的正常供应,细胞内会合成和积累一些分子量低、并且在较高浓度下对细胞没有毒性的有机溶质来提高植株的渗透调节能力。这些渗透调节物质主要包括脯氨酸、甜菜碱和可溶性糖等[34,63]。一些研究表明硅参与调控植株内渗透调节物质的积累,例如在高粱和烟草中,研究者均发现加硅可显著增加植株可溶性糖的含量,降低脯氨酸含量[39,64]。黄瓜中,同单独盐胁迫相比,加硅可以通过增加根系可溶性糖 (主要是蔗糖和葡萄糖) 的积累,降低根系木质部汁液渗透势,促进根系对水分的吸收,但硅的这种调控作用具有品种间的差异[3-4]。
从这些研究结果可以看出,加硅可以通过促进根系生长、调节根系水通道蛋白的表达、改善渗透调节能力和提高茎水导等一系列机理促进胁迫条件下植物对水分的吸收和向地上部的转运,维持胁迫条件下植株水分吸收和散失的平衡,缓解盐胁迫造成的渗透胁迫。
3.3 外源硅对盐胁迫下抗氧化系统和光合作用的影响
正常生长条件下,植物细胞内活性氧 (ROS),如超氧阴离子 ()、过氧化氢 (H2O2)、羟自由基 (·OH)等的产生和清除之间会保持一种动态平衡,而盐胁下这种平衡被破坏,造成活性氧在植物体内大量积累,引起氧化损伤[63]。植物中常见的自由基清除系统包括酶促系统和非酶促系统。酶促系统主要包括超氧化物歧化酶 (SOD)、过氧化物酶 (POD)、过氧化氢酶 (CAT) 和抗坏血酸过氧化物酶 (APX) 等。非酶促系统主要包括维生素E、抗坏血酸、谷胱甘肽还原酶 (GR) 等[63]。很多研究结果表明硅可调节盐胁迫下植株体内活性氧清除系统的活性以及非酶促抗氧化的能力。大麦中,硅可以提高CAT、SOD和GR的活性,但是对APX的活性基本没有影响[65]。而在黄瓜中,外源加硅能显著增强APX、SOD、GPX和GR的活性,但是对CAT的活性基本没有影响[5]。在番茄中,加硅可显著提高盐胁迫下SOD、CAT活性,以及抗坏血酸的含量,减少H2O2产生和质膜氧化损伤[47]。鹰嘴豆中,无论是单独加硅还是硅和丛枝菌根菌结合使用均可以通过增强抗氧化酶,如SOD、CAT、愈创木酚氧化酶 (GPOX) 等的活性,缓解盐胁迫造成的活性氧迸发[41]。甘草 (Glycyrrhiza uralensis) 中,Li等[66]研究表明,同单独盐胁迫相比,外源施加1、2、4和6 mmol/L的硅均可以提高POD活性,降低丙二醛 (MDA) 浓度,但是只有在硅浓度为4 mmol/L时才显著提高SOD的活性。类似的,在秋葵 (Abelmoschus esculentus)[67]、葡萄 (Vitis viniferaL.)[68]、水稻[69]等物种中也发现硅可以调节抗氧化酶活性,降低活性氧 (如H2O2) 和MDA的产生和积累,缓解盐胁迫引发的氧化损伤。这些结果表明,尽管硅对盐胁迫下抗氧化系统的调控作用因植物种类、处理时间、处理浓度和生长条件而异,但是总体来说,硅可以通过调节盐胁迫下植株的抗氧化能力降低活性氧的积累。此外,值得注意的是:1)上述很多结果都是通过水培试验得到的,硅缓解盐胁迫造成的氧化损伤的结果需要通过田间试验进行验证;2) 硅对盐胁迫下植株抗氧化酶系统具有直接的调节作用还是通过改善离子平衡后的间接影响仍需进一步研究。
光合作用是决定作物产量的关键,盐胁迫对植物生长的抑制可归因于胁迫造成的光合能力的降低[39]。盐胁迫造成植物光合速率降低的原因主要包括:1)改变负责光反应的细胞器的结构和功能;2) 离子毒害;3) 影响CO2扩散到结合部位;4) 抑制同化产物的转移[63,70]。研究表明,加硅可以提高盐胁迫下植株的净光合速率[3]。并且硅对盐胁迫下植物光合作用的改善机理可以从以下几个方面进行总结:首先,盐胁迫下加硅可通过降低离子毒害和活性氧的积累维持负责光反应的细胞器的结构和功能。叶绿体是进行光合作用的主要场所,叶绿素是光合作用的重要物质,参与光能的吸收、传递、分配和转化,其含量在一定程度上可反映植物光合作用的强弱[3]。盐胁迫下,活性氧在叶绿体的积累会破坏叶绿体膜结构,影响光合功能。而盐离子如Na+含量的增加影响叶绿素的生物合成,加剧色素降解[3,33]。研究表明,加硅可以通过降低活性氧和Na+积累来降低盐胁迫对植物叶片叶绿体类囊体结构的破坏,保持叶绿体结构的完整性,同时增加植株叶片叶绿素含量[71]。其次,盐胁迫会影响CO2扩散到结合部位,降低CO2利用效率。朱永兴等[72]报道,番茄中,盐胁迫下气孔导度的降低限制了CO2向叶绿体输送,而加硅可在一定程度上提高气孔导度,降低光合作用的气孔限制,维持叶片较高的光合速率。同样,在抗盐性不同的两个秋葵品种中,Abbas等[67]研究发现,加硅可以提高叶片气孔导度、蒸腾速率、气孔数目和体积。这些结果表明,盐胁迫下加硅有利于维持光合器官和光合色素的完整性,同时提高植株的CO2利用率,保证光合的正常进行。最后,盐胁迫会影响光合产物的转运和分配,使光合产物如可溶性糖和淀粉等在叶片中大量积累,导致光合作用的反馈抑制,造成植株生长缓慢甚至停止[73]。目前,关于硅对碳水化合物代谢的系统研究较少,在黄瓜中,Zhu等[3]研究发现加硅可通过调节碳水化合物代谢相关酶的活性,降低可溶性糖和淀粉在叶片中的积累,同时促进同化产物从地上部向地下部的转运,由此缓解光合产物积累对光合作用的反馈抑制,提高净光合速率,并且为盐胁迫下根系的生长提供能量。但是关于硅对碳水化合物代谢的分子机理有待进一步研究。近年来,叶绿素荧光参数已被广泛的用来反映胁迫条件下植株光合作用中各个反应过程[74-75]。黄瓜中,盐胁迫显著降低PSII最大光化学效率Fv/Fm,PSII有效光化学效率Fv'/Fm',PSII实际光化学效率ΦPSII,以及光化学猝灭系数qP,同时提高非光化学猝灭系数 (NPQ),而加硅可提高盐胁迫下Fv/Fm、Fv'/Fm'、ΦPSII和qP,降低NPQ,这些结果表明外源加硅可增大PSII反应中心开放程度和活性,有利于将更多的能量用于PSII电子传递,提高光合色素将光能转化成化学能的效率[3]。类似的,芦荟 (Aloe veraL.) 中,Xu等[48]报道,同单独盐胁迫相比,加硅可以降低光下最小荧光Fo,增大可变荧光Fv和PSII潜在活性 (Fv/Fo),提高盐胁迫下芦荟的光合效率。
总之,硅可以通过降低盐离子含量以及活性氧的产生和积累以及调节碳水化合物代谢来提高植株的光合能力,维持胁迫条件下植株的正常生长。但是硅对活性氧和碳水化合物代谢调控的分子机理,如对相关酶基因表达水平的调控作用,需要进一步深入研究。
3.4 外源硅对盐胁迫下植物蛋白质组和基因表达的影响
尽管关于硅缓解盐胁迫的生理机制已经有较多研究,但是硅缓解盐胁迫的分子机理尚不清楚,在此,本文对已报道的硅对盐胁迫下植物基因表达、蛋白组和转录组的调控机理进行了总结。
Kim等[76]研究表明,盐胁迫处理6 h和12 h后,加硅显著上调水稻ABA合成相关基因ZEP (zeaxanthin epoxidase)、NCED1 (9-cis-epoxycarotenoid dioxygenase 1) 和NCED4 (9-cis-epoxycarotenoid dioxygenase 4) 的表达,但是在处理24 h之后显著降低了这些基因的表达。在高粱和黄瓜中,加硅可以通过提高根系质膜水通道蛋白的表达,促进根系导水率,提高根系吸收水分的能力[4,58]。在烟草 (Nicotiana tabacum) 中,Liang等[77]研究认为,硅和乙烯信号途径存在互作,加硅可以迅速上调乙烯合成关键基因1-氨基环丙烷-1-羧酸氧化酶 (1-Aminocyclopropane-1-carboxylic acid (ACC) oxidase,ACO) 和 1-氨基环丙烷-1-羧酸合成酶 (1-Aminocyclopropane-1-carboxylic acid (ACC) synthase,ACS) 的表达,提高乙烯的含量,调控植株对盐胁迫的响应。但是在没有乙烯存在的情况下,加硅不仅不能提高细胞对盐胁迫的抗性,还会促进H2O2的产生,导致细胞死亡。
随着现代分子生物学的迅速发展,对植物耐盐性的研究也深入到基因组学、转录组学、蛋白质组学等组学水平。但是目前关于硅缓解盐胁迫的研究在组学水平的报道较少。在番茄中,Muneer和Jeong[78]研究发现盐/非盐胁迫下加硅处理共检测到40个蛋白差异表达,这些差异表达的蛋白大多同响应胁迫、激素和转录调控等通路相关,同时,硅可通过调控响应盐胁迫的转录因子 (leDREB-1、leDREB-2和leDREB-3)、抗氧化酶相关基因(leSOD、leCAT和leAPX) 和硅转运体 (leLsi-1、leLsi-2和leLsi-3) 等一系列基因的表达,调控激素含量和抗氧化酶活性,缓解盐胁迫带来的伤害。非胁迫条件下,Chain等[79]和Watanabe等[80]的研究发现,加硅仅诱导小麦和水稻中少数的基因差异表达(小麦中47个,水稻中20个)。同样,在拟南芥(Arabidopsis thaliana) 中,单独加硅仅诱导2个基因差异表达[81]。但是也有一些研究表明,非胁迫条件下,硅也可调控大量基因上/下调表达。Van Bockhaven等[82]和Brunings等[83]报道,水稻中,加硅分别可诱导221和1822个基因差异表达,证明硅对水稻的正常生长代谢起到非常重要的作用[82-83]。水稻中这些研究的差异可能和研究所用测序平台、水稻品种以及培养条件不同有关。黄瓜中,Holz等[84]运用RNA-seq技术研究了硅对黄瓜组培苗基因表达的影响,结果显示,加硅分别诱导572和564个基因上/下调表达,功能分析表明这些差异表达的基因主要参与到植物光合、生物合成和离子转运等初级代谢过程。最近,Zhu等[85]利用RNA-seq研究了硅对盐胁迫下黄瓜叶片基因表达的影响,结果表明,盐胁迫诱导大量基因差异表达,而盐胁迫下加硅后,这些差异表达的基因倾向于恢复到对照水平,暗示硅可能起到类似于激发因子(elicitor)的作用,使植物为可能的逆境条件做好准备。利用转录组、代谢组和离子组等技术开展硅对植物盐胁迫的研究有助于揭示硅提高植物耐盐性的分子机理,但是目前这方面的研究仍然较少。
3.5 硅突变体水稻在研究硅缓解盐胁迫机理中的应用
锗 (Ge) 和硅具有相似的积累方式,植物对两者的吸收具有一定的竞争作用。利用锗的这一特点,Ma等[86]筛选出了硅吸收量远低于野生型的硅突变体水稻,为后续研究硅对水稻生长发育的影响奠定了基础。例如,Isa等[87]研究发现,尽管硅突变体水稻叶片中仅仅形成了较少的植硅体,加硅仍然可以显著促进硅突变体水稻的生长,这可能与硅参与改变细胞壁结构有关,证明硅参与到水稻的生理生化代谢过程。张文强等[88]利用该突变体研究了硅对盐胁迫下野生型和硅突变体水稻种子萌发的影响,结果表明,外源硅对突变体水稻的芽长、芽重和发芽率的提高幅度要显著大于野生型水稻,这可能是由于突变体种子胚和种皮发生了变化,可以更高效率地利用硅。但是,关于硅对盐胁迫下突变体和野生型水稻幼苗营养元素吸收和生物量的影响的研究结果表明,盐胁迫下加硅没有显著改善植株干物质积累和各种元素的吸收,这可能是由于突变体对硅的吸收量远远小于野生型导致的[89]。硅吸收突变体的应用可以帮助研究者更好的揭示植物对硅的吸收、转运以及硅在植株生长发育过程中发挥的作用。
4 结语与展望
硅在地壳中丰富的含量和它对植物生长的有益作用奠定了其在农业生产中的重要地位。目前,关于硅缓解植物盐胁迫的机理已经有大量报道,本文针对已有的研究,从硅调节离子平衡、水分状况、活性氧和光合、组学等四个方面进行了整理和汇总。值得注意的是,在硅缓解盐胁迫的过程中,这些机理并不是独立存在的,相互之间均具有一定的联系,例如,硅可以通过改善离子平衡和水分状况减少活性氧的产生,提高光合效率,最终保证胁迫条件下生长的正常进行。此外,通过已有的研究结果可以看出,硅对植物抗盐能力的调控具有物种和品种间的差异,这可能主要是由于不同植物吸收硅的能力不同。其次,不同的研究中所用硅浓度、胁迫时间和强度、试验材料培养方式 (水培和土培)、硅的施加方式 (喷施和根施) 以及测试所用的材料 (根系、叶片和茎) 也会影响到硅的作用效果。再者,由于盐胁迫对植物的伤害包括渗透胁迫和离子毒害,研究表明,硅对盐胁迫造成的渗透胁迫和离子毒害的缓解机理不同,而在实际操作中不容易对两者进行区分,因此这也会导致相同物种在不同的处理时期对外源加硅的响应不同。尽管如此,总体来说,硅可以显著缓解盐胁迫对多种植物的伤害。根据已有的研究进展,笔者认为关于硅缓解盐胁迫的研究在以下四个方面需要深入:1) 随着组学研究方法的不断发展,硅缓解植物胁迫的分子机理也深入到了转录组、蛋白质组等水平,但是目前研究多集中在硅缓解生物胁迫方面,利用组学手段研究硅缓解非生物胁迫,包括盐胁迫的报道较少,且不够深入,此外,代谢组和离子组等水平的研究尚未见报道;2) 越来越多的研究发现硅可以改善盐胁迫下植株的水分状况,鉴于硅转运体本身也是属于NIPs (nodulin26-like intrinsic proteins) 水通道蛋白家族,因此,硅对不同植物水分代谢的调控机理亟需解析,而不同物种中硅转运体的克隆和功能研究可为我们更好的解释硅对水分代谢的调控奠定基础;3) 一些研究表明,加硅可以促进胁迫条件下根系的生长[47]、改变根系结构 (如促进凯氏带的形成和木质素的沉积[88]、调节离子在根系不同部位的分布[37]),但是目前关于硅对根系结构 (包括细胞壁成分) 和根系离子吸收调控的分子机理尚不清楚;4) 盐胁迫下碳水化合物,如可溶性糖和淀粉的积累可以作为能量储存、渗透调节物质和信号物质发挥重要作用,因此硅对胁迫条件下碳水化合物的调控作用和调控机理值得进一步研究。这些研究有助于增加我们从分子层面对硅缓解盐胁迫的机理的认识,为硅肥在生产实践中的应用奠定理论基础。

