酒精性肝硬化患者的肝癌筛查
唐芳馨 王炳元
肝脏疾病的流行病学多种多样,但是过量和长期饮酒是导致终末期肝病的主要原因,也是全世界与肝脏疾病相关住院的一个主要因素[1]。我国新生儿乙型肝炎疫苗的强制性接种和有效的抗乙型肝炎病毒(HBV)药物的广泛应用,使HBV感染的发生率急剧下降;直接抗病毒小分子药物的出现使消灭丙型肝炎病毒(HCV)的目标近在咫尺;随着经济体量的迅速增加和对饮酒的宽容(缺乏政策或法律的限制),中国和印度饮酒人群迅速增多,包括肝脏损伤在内的有害饮酒已凸显;此外,近20年肥胖症的世界范围内的流行,非酒精性脂肪性肝病(NAFLD)也成为全球肝病的主流,在中国占肝病病因的49.3%,酒精性肝病(ALD)也占14.8%[2]。另外,青少年肝损伤的原因中增长最快的就是肥胖和饮酒,狂饮与肥胖具有相似的肝脏病理组织学特点,相互作用加重肝损伤、加速疾病的进展[3]。酒精消费、儿童和成人的肥胖以及慢性肝炎病毒感染所导致的肝硬化和肝癌的患病率和病史率的增加,都将使世界范围内肝病负担持续加重[1-3]。
一、酒精性肝硬化与肝癌
肝细胞癌(HCC)的发病率正在上升,它是全球第五大最常见的癌症和第三大最常见的癌症相关死亡原因。在西方国家,肝硬化是HCC发展的一个主要危险因素,在非肝硬化肝脏中很少发生这种变化,持续的高饮酒量是导致肝硬化的主要原因[1]。HCC患者的预后是严重的,因为HCC往往只有在晚期才被发现。
5%~15%的酒精性肝硬化(AC)患者有发展为HCC的潜在风险,AC患者每年发生HCC的累积风险约为1%~1.5%,接近HCC的监测阈值(1.5%)[4],5年累积风险约为8%。发达国家32%~45%的肝癌病因是AC[3]。一项基于人群的近7 000例美国HCC患者和25万以上的对照组研究发现, ALD患者发生HCC的风险(odds ratio, OR)增加了4倍。
酒精也是慢性HCV感染患者发生HCC的公认潜在因素。长期饮酒超过80 g/d,持续10年以上,患HCC的风险增加了近5倍;每天饮酒量大于120 g,HCV感染的AC患者10年累计HCC发生率为80.7%,无HCV感染的AC患者为18.5%,单纯HCV感染者为56.5%。慢性HBV感染是亚洲国家的重要疾病负担[2]。在HBV感染的死亡病例中,肝硬化和HCC分别为93%和35%,其中5%的患者有酗酒史。与不饮酒者或适度饮酒者相比,过度饮酒的HCV和HCV感染者的平均死亡年龄显著降低[3]。
二、AC发生HCC的危险因素和机制
饮酒量和饮酒模式是AC的重要危险因素,影响HCC风险的每日饮酒量阈值目前尚无确定,也没有关于饮酒持续时间或模式(持续与狂饮)对HCC发展的数据。单纯嗜酒的部分患者即可发生HCC,说明除了酒精及代谢产物直接或间接的致癌机制外,可能还有宿主固有的(基因多态性)因素。
酒精可以通过诱导肝微粒体同工酶细胞色素P4502E1(CYP2E1)激活烟草烟雾作为共致癌物,酒精饮料和食品中存在的原致癌物,乙醛毒性和活性氧(ROS)加剧脂质过氧化、改变生长因子和细胞因子环境导致免疫反应失控,氧化应激副产物引起的DNA损伤等,都可以促进HCC的发生。长期饮酒还可以调节影响ALD进展的microRNAs(miRNA/miR)表达,在AC相关的HCC中发现了一些异常表达的小RNA,包括上调了miR-221、miR-21、miR-22和miR-517a,下调了miR-29、miR-24a、miR-26a、miR15-a/b、miR-150、miR-195、miR-122、miR-20家族、miR-124和let-7家族[3]。
宿主基因异常也与ALD相关的HCC有关。中国学者荟萃分析了14项病例对照研究,包括3 527例HCC患者和7 184例对照患者,结果显示,在等位基因模型下,PNPLA3 rs738409 的基因多态性与所有研究人群病因类型的HCC风险增加相关(OR=1.59,P=0.001),其中病毒相关肝硬化的HCC患者 OR为1.19,AC相关的OR为3.35,AC患者发生HCC的风险等位基因CC为GG的11.02倍;说明 PNPLA3基因多态性(C>G)可能是ALD相关HCC的重要危险因素,并且使人群病因分值(population etiologic fraction, PEF)提高到43.5%[5]。其他基因还包括跨膜6超家族成员2(TM6SF2)的基因变异、与ROS形成有关的髓过氧化物酶和超氧化物歧化酶2和炎症有关的CCL5等基因的多态性,均可以改变ALD的脂肪变性、坏死、纤维化和HCC[5]。
尽管女性平均酒精摄入量低于男性,但肝硬化和HCC的发生概率仍比较高;HCC常发生在酒精和病毒(HBV和/或HCV)合并的肝病患者中。老年、男性和晚期肝病更是重要的预测因素[3]。吸烟在酗酒患者中很常见,显著增加患HCC的风险,酒精、烟草和肥胖已被证明是肝硬化患者发生HCC的独立和协同危险因素。而且重度饮酒与糖尿病(OR=9.9)有显著的协同作用,人类免疫缺陷病毒感染是饮酒的另一个重要共同因素,铁超负荷也显著增加ALD患者发生HCC的风险[3]。
三、AC患者HCC筛查的误区和难点
肝硬化患者HCC的监测是一个备受争议的话题,监测是否具有成本效益是关键。虽然肝硬化是与HCC相关的最常见的潜在疾病,但由于不同病因导致的肝硬化中的HCC发病率还不完全清楚。美国肝病研究协会(AASLD)基于评估成本效益的研究制定了指导建议,即:监测只应在HCC风险为每年1.5%或更高的人群中进行[4]。
一项在法国和比利时的22个肝病中心进行了AC患者HCC发病率的大型前瞻性研究[6],经活检证实的代偿性AC患者参与入选。所有患者至少有10年的过量饮酒史,排除病毒和代谢综合征等其他病因,入选前的腹部超声筛查排除已经发生的HCC。根据临床实践指南,对肝癌的监测基于6个月的超声检查,而对肝癌的诊断则基于增强CT扫描或MRI或肝活检。入选患者652例,平均随访29个月(IQR 12.2~41.4)。153例患者失访,43例发生HCC,1年和2年累积风险分别为1.8%和5.2%,整体年发病率为1.4%,接近AASLD的1.5%指导建议,研究者认为AC患者应该接受HCC监测。
英国的一项对3 107例肝硬化患者的研究中,与AC患者相比,病毒性和自身免疫/代谢病因患者的HCC校正相对风险增加了2~3倍。每种病因10年预测的肝癌累积发病率估计值为酒精1.2%,慢性病毒性肝炎4.0%,自身免疫或代谢性疾病3.2%,隐源性疾病1.1%。这项研究认为,肝硬化患者的HCC累积10年发病率估计为4%或更低,酒精或隐源性肝硬化患者发生HCC的风险最低,没有达到AASLD的指导建议,从而不支持AC的HCC筛查[4]。
仔细分析这两项所谓的大型研究,无不存在着明显的局限性。英国的研究者对于肝硬化的定义依赖于初级保健医师在其患者的电子健康记录中的诊断,还可能不包括通过急诊入院诊断为失代偿性AC的死亡患者,而住院患者可能没有将其诊断转移到初级保健机构,以便对其记录进行回顾性补充。也就是说不是在一个规范管理的中心内纳入的病例,所以病例选择不可避免存在偏倚。法国的证据主要基于22个小规模的研究中心进行,病例选择上也存在显著的偏差。参与中心每年的患者数量相对较低(即5~6人),根据研究方案,入选病例数仅占预测样本总数的一半(652/1 200);此外,在706例符合条件的患者中,排除的54例尚无解释;此外153/652例患者失访,也无任何明确的解释。与整个队列相比,尽管失访患者的肝病状态和基线饮酒量没有差异,但是活动性饮酒患者容易促发HCC的发生和进展,这些患者也更易失访[1]。
不少相关文献还存在一些不客观的问题。包括其队列选择的不同和(或)某些地理区域肝硬化病因分布的不同,在诊断时的疾病严重程度、饮酒量和NAFLD等疾病的潜在流行率方面的肝硬化病例组合不同,均是影响AC患者HCC筛查的重要因素。
此外,病毒标志物、自身免疫抗体等相关的肝硬化很容易被确诊,但饮酒史的询问影响因素较多,如酗酒、过量饮酒、嗜好或依赖、戒酒时间等均无统一的定义和标准,过度饮酒常常是隐蔽的,症状差异又较大,使得早期发现、及时诊断很困难。迄今还没有ALD的诊断性测试,所以获得准确的饮酒史对诊断至关重要,但“准确”的获得可能具有非常大的挑战性,因为酒依赖者往往存在人格分裂,长期的被歧视和偶尔的自责,患者可能不会直率地提供真实的饮酒史、近期饮酒频率和饮酒量,甚至夸大戒酒时间,少报饮酒频率和饮酒量,容易误诊为病毒性肝炎、药物性肝损伤或NAFLD等,有些还被归类到“原因不明”的行列,严重降低了ALD的诊断,导致ALD患者HCC的筛查频率较低,确诊的AC相关HCC的程度也较重。
AC和NAFLD相关的肝硬化在病理上与其他原因的肝硬化有明显的不同。前者是发生在脂肪肝的基础上,肝脏往往不是缩小反而肿大,纤维化发生在肝小叶中央静脉周围和窦周,很少发生大的纤维间隔,所以很多患者已经表现出肝硬化的表现,超声波也提示门脉高压,但CT却诊断为脂肪肝。肝活检是一种具有潜在并发症的侵入性手术,由于高胆红素血症、凝血的异常和/或血小板的减少,以及伴随的腹水等,又增加了肝活检的疑虑。重型酒精性肝炎往往发生在肝硬化的基础上,临床上总是因高胆红素血症、凝血的异常而单纯诊断酒精性肝炎和慢加急性肝衰竭,多数忽略肝硬化的存在,导致AC的诊断率往往被低估。
虽然AC患者肝癌的发病率低于病毒性肝炎和NAFLD(NAFLD年增加9%)等其他病因[1],似乎不符合“对于不同病因的肝硬化患者,当肝癌的风险为每年1.5%或更高时,应根据成本效益模型进行监测”的指导意见,但是ALD患者的依从性较差,临床医生的筛查意识也较低,纳入研究归因的假定病因或HCC事件的确定可能在某种程度上是错误的,疾病队列研究中可能低估了肝癌的发病率,使大多数HCC患者延误到晚期才被确诊,贻误了治疗的最佳时机,即使戒酒仍然有很高的死亡率[1]。
考虑到医患双方的消极因素(甚至不排除对酗酒者/酒依赖者的歧视),鼓励AC患者主动定期接受HCC筛查是非常明智的,特别是应该在ALD早期无症状阶段强制性监测HCC。
四、临床HCC筛查方法的建议
许多非侵入性血清模型或影像学已用于预测肝纤维化的严重程度。考虑到实用性、可操作性和成本效益,推荐如下建议:
(一)α-甲胎蛋白(AFP) 尽管由于敏感性较差(尤其是疾病早期),AFP血清水平>200 ng/mL对肝硬化患者的HCC诊断和影像学所见的局灶性结节的诊断具有很高的特异性;排除肝细胞炎症因素(ALT、AST持续在正常范围),每4周化验一次血清AFP,如果低水平持续增高,也要高度怀疑异型增生结节或癌变的可能。
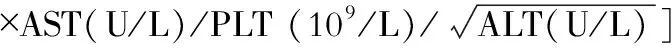
(三)影像学 HCC是唯一不需要通过组织学确诊,超声、CT或/和MRI检测到肝脏肿块或结节就可直接确定治疗指征的一个肿瘤,阳性预测值和特异性>90%~95%,在测量1~2 cm的肿块时,需要使用两种成像技术(CT和MRI),其准确率为73%~88%,也有大约20%的误诊率。具有非典型成像特征的局灶性结节或在非肝硬化肝脏中检测到的局灶性结节应动态监测AFP,有条件时进行肝活检[3]。
(四)组织学 疑似肝癌的肝活检具有较高的诊断敏感性(86%~93%)和特异性(100%),但结节<1 cm的敏感性下降至83%,大约2%~11%的病例由于样本不足,无法做出诊断。肝小叶内可以出现多种组织学特征,如脂肪变性和混合性实质性炎症,脂肪性肝炎时出现肝细胞气球样变,伴或不伴MDB以及靠近中央静脉周围的窦周/细胞周围纤维化。核密度比增加>1.5、具有小细胞和透明细胞改变特征者,与影像检测到的肝结节进展为肝癌的风险增加相关,轻度核多形性和/或多核的大细胞,已被报道为肝癌的独立危险因素[3]。
(五)其他 当常规组织学不确定时,免疫组织化学染色glypican-3、热休克蛋白-70和谷氨酰胺合成酶等可帮助诊断[3]。基于HCC组织材料的基因表达谱的分子标记, 将来可能成为HCC预后和/或治疗分层的生物标志物。
(六)建议监测的筛选指证和程序
1.筛选的指证 符合下列任何一项都需要监测HCC:(1)明确诊断肝硬化;(2)影像学提示有结节;(3)血小板<100×109/L和/或mFIB-4 ≥2.0;(4)重型酒精性肝炎病史仍在持续过量饮酒者(所谓活动饮酒者);(5)任何原因肝活检有MDB存在者。
2.监测的程序 具有筛选指征的患者,至少每半年进行血细胞、肝脏生化、AFP和超声波检查,每年进行一次增强CT或MRI检查。国内这些常规检查价格低廉和基层医院的普及,使进行HCC筛查趋于合理[1,6]。难以确诊的结节可进行超声引导下肝活检和免疫组织化学及基因检测。

