Tau蛋白显像剂18F-THK5317的合成与初步临床应用
张晓军,付华平,李云钢,刘 健,崔孟超,富丽萍,张锦明
(1.中国人民解放军总医院 核医学科,北京 100853;2.北京师范大学 放射性药物重点实验室,北京 100875)
阿尔茨海默病(Alzheimer’s disease, AD)约占所有痴呆症的50%~70%,具有高发病率、高患病率和高致残率的特点[1]。AD主要神经病理改变是淀粉样(Aβ)斑块的沉积和神经纤维的缠结(NFTs),只有脑组织的病理学检查才是当前AD诊断的金标准[2]。PET显像利用多种特征性显像剂,以脑内特异病理、生化改变为靶点进行结合,可从分子水平上早期无创伤诊断AD[3]。其中,葡萄糖代谢显像剂18F-FDG在AD患者脑内表现为特征性皮质代谢降低,但无法证实AD特异病理改变[4];11C-PIB以及三种获美国FDA批准的18F-Flutemetamol、18F-Florbetapir和18F-Florbetaben能特异结合Aβ斑块,但Aβ显像结果与患者认知受损程度不相关,只作为脑内Aβ斑块水平的评估,辅助医生诊断,不直接应用于阿尔茨海默病的诊断[5-7]。过度磷酸化的tau蛋白构成的NFTs是AD另一主要病理变化,tau蛋白在脑内的水平与认知损伤程度高度相关,近年来tau蛋白显像剂的研究受到了科学界的广泛关注[8]。自18F-FDDNP应用于tau蛋白显像以来,许多新型显像剂的研究有很大进展,主要以THKs、T807/08、PBBs、MK-6240和ROs为代表,但tau蛋白存在6种同分异构体,只有不溶性双螺旋丝聚集的tau(PHF-tau)蛋白与NFTs密切相关[9],探针是否只特异结合PHF-tau是评价显像剂优劣的关键,如T807结合tau的同时能非特异结合脑内单氨氧化酶(MAO-A),在一定程度上降低了该探针的临床价值[10-12]。18F-THK5317与tau亲和力高(Kd=5.19 nmol/L),能快速入脑及清除且无毒副作用,是THKs系列中极有潜力应用于临床的tau蛋白显像剂[13-14]。目前国际上针对该探针已有少量临床研究,但药物制备均采用自制模块合成或手动标记,未见商用模块自动化合成报道,不利于该类探针的推广,而国内tau蛋白显像剂的临床前与临床研究正处于起步阶段,未见相关报道。本研究在文献报道的基础上,通过优化合成条件,建立可靠高效的18F-THK5317自动化合成方法,经质量控制和动物实验后,对比了18F-THK5317在AD患者和健康人脑内的PET/MR结果,初步探讨了其临床应用价值。
1 主要材料
1.1 试剂
前体(S)-2-(4-甲氨基苯基)-6-[[2-(四氢吡喃基-)-3-对甲苯磺酰氧基]丙氧基]喹啉((2-(4-methylaminophenyl)-6-[[2-(tetrahydro-2H-pyran-2-yloxy)-3-tosyloxy]propoxy]quinoline))、标准品(S)-6-[(3-[氟19]-2-羟基)丙氧基]-2-(4-甲基氨基苯基)喹啉:北京师范大学放射性药物教育部重点实验室提供;氨基聚醚(K2.2.2):德国ABX公司产品;无水乙腈和碳酸钾:美国Sigma-Aldrich产品;Light QMA、SPE C18柱:美国Waters公司产品;H218O:丰度98%:江苏华益化工有限公司;其他试剂均为国产分析纯。
1.2 仪器
Sumitomo HM-20S加速器:日本驻友;PET-MF-2V-IT-1型多功能合成模块(配备Alltech 626双泵和UVSI 200全波长紫外检测器,Grace Alltima C18, 10 mm×250 mm, HPLC柱):派特(北京)科技有限公司;内毒素快速检测仪(PTS):美国charles river湛江安度斯生物有限公司;高效HPLC分析仪:美国Waters公司,配515泵,2487紫外检测器,分析柱Phenomenex Gemini 5 μ 100 A C18(4.6 mm×150 mm),BioScan流动放射性检测器;Hidex Automatic Gamma Counter:芬兰Hidex公司;PET/MR-MAGNETOM Biograph mMR:德国西门子公司。
1.3 实验动物
KM小鼠:雄性,25只,体重(25±2) g,北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2014-0004。
2 实验方法
2.1 试剂准备
1号至13号瓶分别预装以下试剂。
1号为15 mg的K2.2.2和3 mg的K2CO3
溶解在1.2 mL的90%乙腈水溶液;2号为2 mL的无水乙腈;3号为5 mg(S)-2-(4-甲氨基苯基)-6-[[2-(四氢吡喃基-)-3-对甲苯磺酰氧基]丙氧基]喹啉溶解于0.8 mL乙腈;4号为1 mol/L HCl 1 mL;5号为1 mol/L NaOH 1 mL;6号为2 mL HPLC流动相或10 mL注射用水;7号为20 mL注射用水;8号为4 mL HPLC流动相;9、10号为空瓶;11号为10 mL注射用水;12号为1 mL无水乙醇;13号为50 mL注射用水;QMA柱处理同合成18F-FDG一致,依次通过10 mL 0.5 mol/L的NaHCO3和10 mL水;C-18柱依次通过10 mL无水乙醇和10 mL水;HPLC流动相:45%乙腈水溶液,含20 mmol/L NaH2PO4。
2.2 18F-THK5317合成流程
对比两种合成18F-THK5317的流程,分别是直接HPLC分离粗产品和C18预处理粗产品后再HPLC分离,流程如下。
粗产品直接HPLC分离:Sumitomo HM-20S加速器经18O(p,n)18F反应生产的18F-被QMA捕获后,以K2.2.2/K2CO3乙腈水溶液洗脱入反应管,共沸除水至干,2号瓶内2 mL乙腈分两次加入共沸除水至干。冷却后加入3号瓶前体,100 ℃加热8 min进行亲核反应,之后将溶剂浓缩至0.3 mL,加入1 mL的1 mol/L HCl,90 ℃下密闭水解3 min,冷却后,加入1 mL 1 mol/L NaOH中和,混匀后转移到中转瓶,用6号瓶2 mL HPLC流动相清洗反应管内残余放射性至中转瓶。启动半制备HPLC纯化,纯化柱为Grace Alltima C18(10 mm×250 mm)HPLC柱,流动相为V(乙腈)∶V(水)=45∶55溶液中含20 mmol/L NaH2PO4,流速为6 mL/min,收集产品的放射性,进入13号固相萃取瓶(瓶中预装50 mL注射用水),产品转移并被C18吸附,用11瓶内10 mL水清洗C18柱,最后用12瓶中无水乙醇从C18柱上洗脱产品,用生理盐水稀释至产品中乙醇低于10%。

图1 合成18F-THK5317的国产模块Fig.1 Domestic module for synthesis of 18F-THK5317
粗产品经C18柱纯化后进行HPLC分离:与上述步骤相同,至加入NaOH中和后,加入6号瓶10 mL水,并将混合液转移至2号反应管,混合液经过V16、V15、C18柱、V17至废液,再用8号20 mL水清洗C18柱后,以4 mL流动相溶液将纯化的产品洗脱至中转瓶10,HPLC分离和溶剂转换得到最终产品溶液与上述相同。
2.3 18F-THK5317的质量控制
采用分析型HPLC进行产品鉴定、放化纯度和比活度测量,分析柱为phenomenex luna C18 5 u(4.6 mm×150 mm),紫外波长为254 nm,流动相为V(乙腈)∶V(水)=45∶55溶液中含20 mmol/L NaH2PO4,流速为1 mL/min,产品鉴定采用标准品19F-THK5317与18F-THK5317共进样;每隔1 h分析一次产品的放化纯度至2个半衰期,得到18F-THK5317的体外稳定性;以快速内毒素检测仪测量产品溶液细菌内毒素含量;以氯铂酸显色法测定杂质K2.2.2的含量;以气相色谱测定溶液中有机溶剂乙腈的残留;小鼠异常毒性实验:KM小鼠5只,将稀释至10 mCi/mL18F-THK5317注射液(比活度为23.1 Ci/μmol,载体浓度为0.141 mg/L),每只小鼠尾静脉注射0.2 mL的18F-THK5317,合计放射性为:2 mCi/只,载体为:0.028 2 μg/只,于注射后48 h观察小鼠是否正常。
2.4 正常KM小鼠体内18F-THK5317分布
20只KM小鼠编号后,计算机随机分成四组,每组5只,每只小鼠经尾静脉注射18F-THK5317溶液,每只7.4 MBq/0.2 mL。不同组别注射后于不同时相(1、30、60、90 min)脱颈处死,取血、心、肝、脾、肺、肾、脑,称重后置于Hidex Automatic Gamma Counter自动计数并衰减校正,计算每克组织百分注射剂量(%ID/g)。
2.5 18F-THK5317初步临床实验
该研究已通过中国人民解放军总医院伦理委员会的审查。
分析18F-THK5317在AD患者、健康老年人对照的分布特点。一名78岁女性AD患者(MMSE=16)和一名72岁男性健康志愿者(healthy control, HC)(MMSE=29)签署知情同意书后进行实验,经肘静脉注射18F-THK5317后,在待检室内安静休息35 min,利用西门子公司PET/MR扫描仪(MAGNETOM Biograph mMR)完成给药后40~60 min头部动态采集数据,均接受PET分子探针18F-THK-5317以及MRI结构和功能成像扫描,并进行基于核磁共振成像的PET图像重建,比较HC与AD之间脑放射性摄取的区别。
3 结果与讨论
3.1 18F-THK5317的自动化合成
采用国产的PET-MF-2V-IT-1型多功能合成模块,能全自动完成亲核反应和水解,HPLC纯化和固相萃取采用半自动方式。若采用第一种方法,中和后产品直接进入中转瓶并用HPLC分离,耗时较短,合成时间约为40 min,但加入NaOH中和后,混合液含有不溶物呈黄色浑浊状态,直接上柱分离一方面使反相C18柱压异常升高,另一方面混合液pH难以保持恒定,当偏碱时,反相C18柱固定相中的硅醇基可与THK5317的胺基结合,使产品峰拖尾且保留时间不定,引起分离度降低,灵敏度和精密度变差,并且放射性分离图包含18F-等杂质峰,最终产品18F-THK5317的放化产率低于15%。在HPLC分离前,增加C18柱预纯化,该步骤耗时约3 min,可除去盐、K2.2.2、18F-等杂质,利用流动相(45%乙腈水溶液,含20 mmol/L NaH2PO4)将18F-THK5317洗脱至中转瓶,上柱样品溶剂与流动相相同,pH偏酸,呈淡黄色透明,能够有效的保护HPLC半制备柱,并获得较高HPLC分离稳定性和重复性,此时HPLC分离放射性峰示于图2,18F-THK5317的保留时间为12.1 min,未见18F-峰等杂质,未校正合成效率为(18.7±5.3)%(n=7),另有文献报道利用中性Al2O3柱纯化混合液的方法,该法能简便地除去混合液中氟离子和大部分盐,但过柱后中转瓶样品略浑浊,上柱后柱压升高,放射性分离图呈现氟离子峰和其余杂质峰,合成效率与本文方法相当。
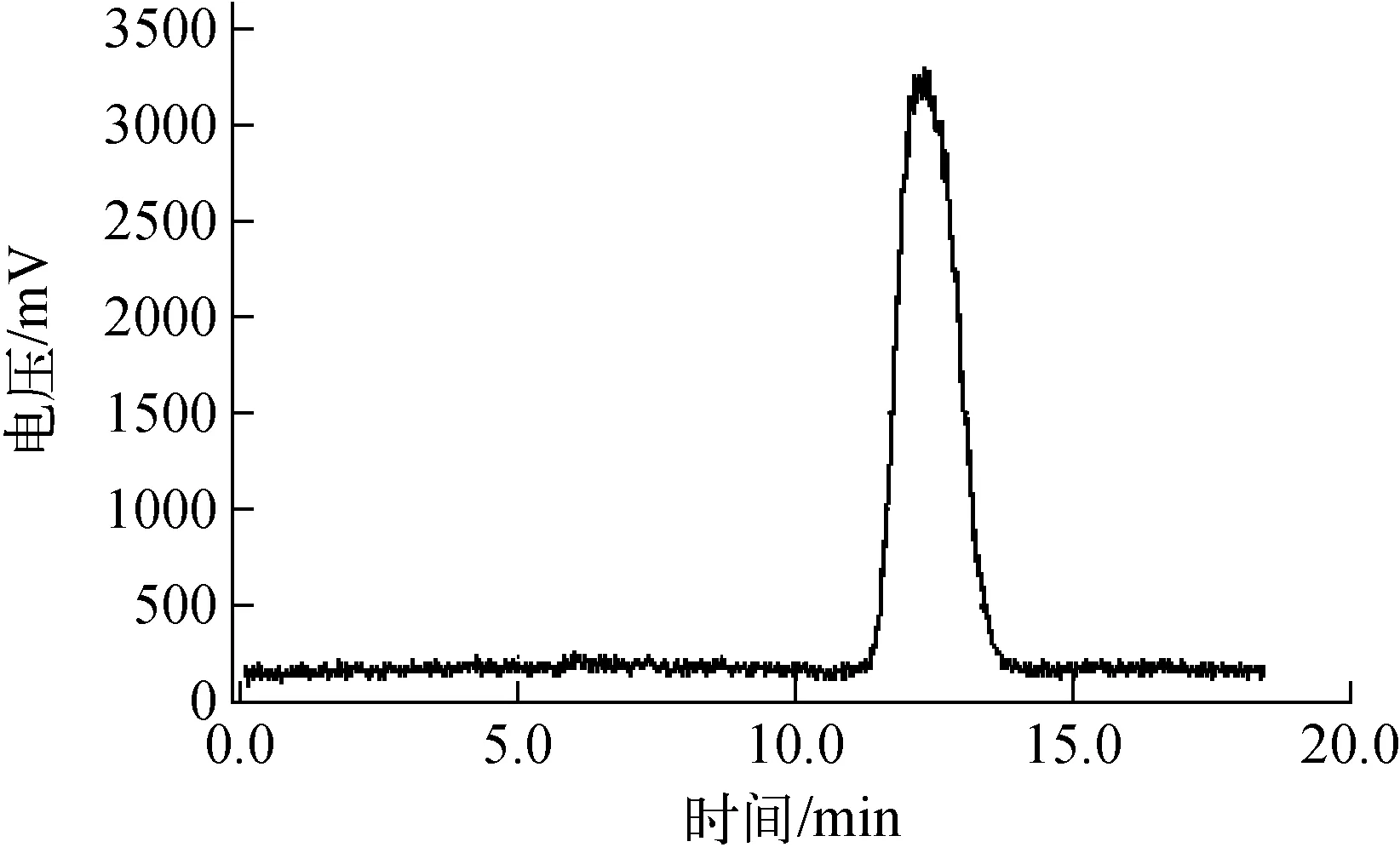
图2 半制备HPLC的放射性分离图Fig.2 Radioactive chromatogram of semiprep HPLC
3.2 18F-THK5317的质量控制
18F-THK5317溶液无色透明,pH为6~7;将产品与标准品共进,18F-THK5317的放射性峰与19F-THK5317的相对保留时间一致(图3);产品放化纯度大于97%;18F-THK5317比活度为(20.6±5.0) Ci/μmol(n=7);2个半衰期后产品放化纯度仍大于95%;内毒素含量小于5 Eu/mL;K2.2.2含量低于25 mg/L;乙腈残留为(0.083±0.066) g/L;小鼠注射后48 h全部存活,未见异常毒性反应(小鼠注射剂量按公斤体重计算约为人体注射剂量的650倍)。产品质量符合要求。(依据15版《中国药典》中18F-FDG的质量标准)

图3 产品18F-THK5317的HPLC质控图(下为放射性峰,上为UV峰)Fig.3 Analytical HPLC profiles of 18F-THK5317
3.3 18F-THK5317的生物学分布
18F-THK5317在正常KM小鼠体内生物分布示于图4。小鼠尾静脉注射18F-THK5317后,放射性迅速从血液清除,到30 min时,血液仅存(0.76±0.11)%ID/g,药物主要经肝脏代谢,直至90 min,肝脏仍有较高摄取值,其余重要脏器心、脾、肺、肾在灌注相放射性摄取高峰后均迅速下降,由于药物脂溶性较高(LogP=2.32)[13],在靶组织脑内,1 min入脑量高达(8.67±0.99)%ID/g,并且在正常小鼠脑内迅速被清除,30、60、90 min放射性摄取值分别为(0.77±0.17)、(0.25±0.04)、(0.16±0.02)%ID/g,Brain1 min/Brain60 min摄取比为34,可见该探针易穿透血脑屏障,并且能迅速从正常脑组织清除,在THK系列探针中脑清除速率最快。文献报道,与另外两种具转化潜力的tau蛋白显像剂—嘧啶并吲哚类18F-T807(18F-AV1451)和苯并噻唑类11C-PBB3—相比,三者均表现出良好的药代动力学特征,在脑内特异的结合AD病理的tau蛋白,但18F-T807存在体内脱氟现象,以及非特异结合MAO-A;11C-PBB3与非AD病理型tau蛋白也能特异结合,且应用受限于11C的短半衰期[10]。区分生物分布的优缺点有赖于进一步横向对比三种显像剂的在体应用。

图4 18F-THK5317在KM小鼠体内的分布数据(n=5)Fig.4 Biodistribution of 18F-THK5317 in KM mice (n=5)
3.4 18F-THK5317初步临床实验
78岁女性AD患者(MMSE=16,第一行)与72岁男性HC(MMSE=29,第二行)18F-THK5317 PET/MR显像图示于图5。第一行:MRI见患者双侧颞叶及海马体积缩小,Tau-PET显示双侧颞叶皮层显著放射性浓聚,脑干及双侧丘脑轻度放射性滞留,MIP图显示皮层异常放射性滞留,以右侧为著。第二行:MRI见双侧海马形态未见显著异常,Tau-PET显示脑干及双侧丘脑轻度放射性滞留,MIP图显示皮层无异常放射性滞留,白质、脑干及基底节区弥漫性放射性摄取。二者比较而言,AD患者双侧颞叶、皮层的放射性滞留均高于健康对照,但健康老年人脑干与基底节呈弥漫性非特异放射性摄取。18F-THK5317为外消旋体18F-THK-5117的S型对映异构体,(S)-18F-THK-5117与(R)-18F-THK-5117初始入脑量相似,在脑内滞留区域与tau蛋白病理区域相一致,但S构型THK5117洗脱速度更快,皮层下白质的非特异摄取显著低于18F-THK-5117[13]。另据文献报道,18F-THK5317 PET显像不仅能提供tau蛋白在脑内沉积信息,还与脑内18F-FDG葡萄糖代谢结果一致,能够提供AD患者脑血流灌注信息[15]。另一种新型THK类显像剂18F-THK5351与tau蛋白亲和力更强,具有较快的动力学参数,基底神经节和皮层下白质放射性摄取低于18F-THK5317,图像具有更高的信噪比,同样具有临床转化潜力[16]。
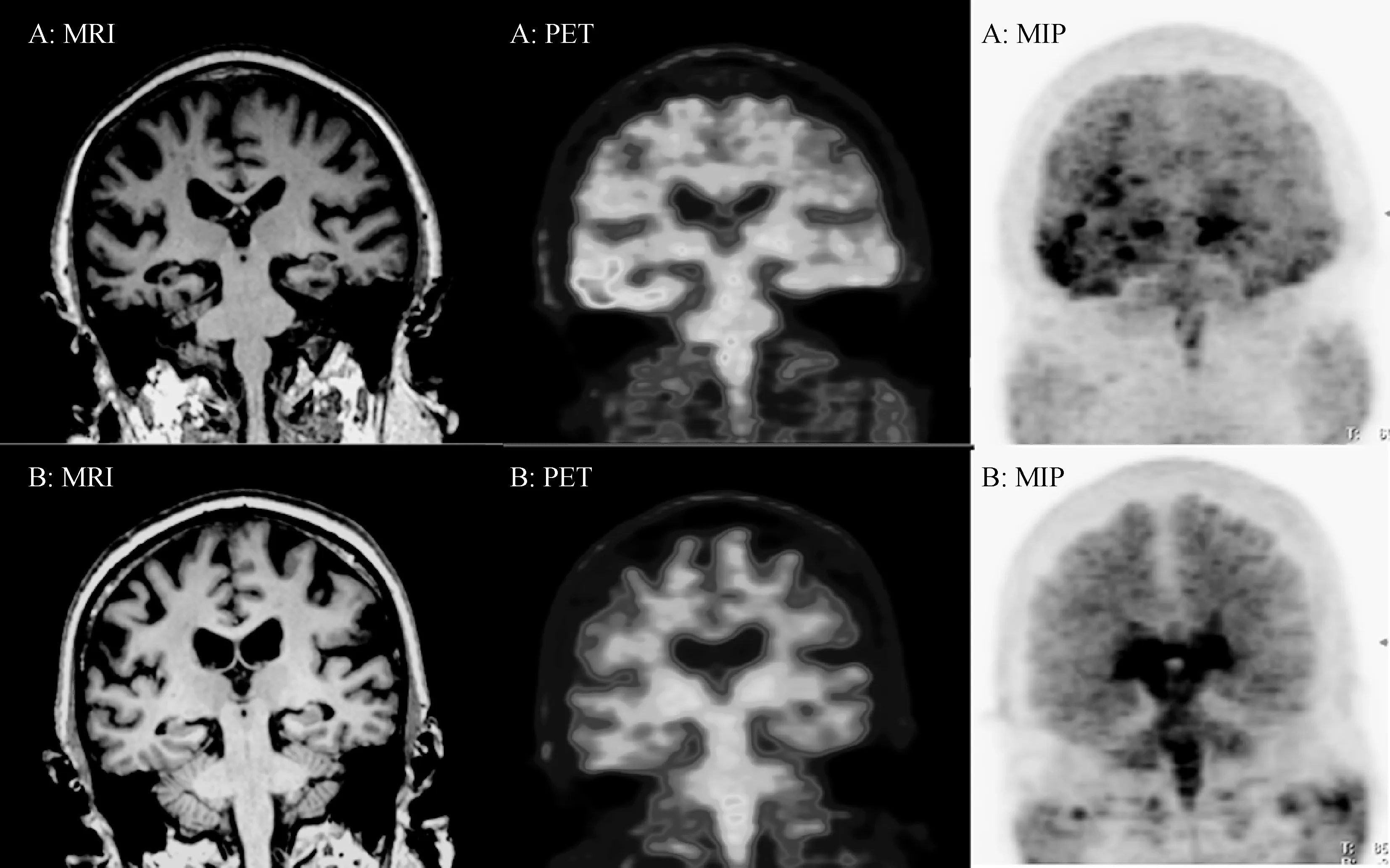
图5 AD患者与HC对照的PET/MR显像图(A为AD患者,B为HC对照组)Fig.5 PET/MR images of AD patient and health control (A: AD patient, B: Health control)
4 小结
18F-THK5317为外消旋体18F-THK-5117的S型对映异构体,其标记前体即为手型分子,经由18F-亲核取代-Tos及水解-THP保护基团得到18F-THK5317,国产氟多功能模块能自动化、稳定、高效的合成该探针;动物分布实验表明,18F-THK5317能迅速穿透血脑屏障并清除,体内重要脏器也能迅速洗脱放射性;初步临床研究表明,AD患者在双侧颞叶、皮层的放射性滞留均高于健康对照,与tau蛋白的分布区域一致,该探针适合作为tau蛋白显像剂,具有临床转化潜力。

