SPECT/CT与MRI对鼻咽癌颅底骨侵犯诊断价值的比较
钟锦绣,付德顺,陶绪长,李海峰,田 安,陈志军
1.江西省肿瘤医院核医学科,江西 南昌 330029;
2.南昌大学第三附属医院核医学科,江西 南昌 330008
鼻咽癌(nasopharyngeal carcinoma,NPC)为头颈部常见恶性肿瘤,好发于中国南方地区,如广东、江西,占比高达15%~18%,男女比例约为3∶1[1-2]。NPC常发生于咽隐窝及鼻咽腔顶后壁,解剖位置隐藏极深,周边组织如神经、血管、骨质等常易受侵,不易早期发现,就诊时病变多处于进展期(T3或T4)。李贻卓等[3]发现,NPC颅底受侵高达65.51%,常侵犯枕骨斜坡、蝶窦及蝶鞍。临床诊断主要依赖影像学检查,一般不做病理学诊断,加上骨质受侵类型多样,侵犯骨质的方向、范围和程度不同,因此精确判定颅底骨是否受侵对临床分期有重要意义,在是否增加放疗照射剂量、扩大靶区照射范围及增加化疗药物等方面起关键作用,而不恰当的治疗方案与肿瘤局部复发、远处转移及预后密切相关。
目前常用的颅底检查主要是影像学检查,通过CT、磁共振成像(magnetic resonance imaging,MRI)、全身显像(whole body imaging,WBI)、单光子发射计算机断层显像(single-photon emission computed tomography,SPECT)/CT及正电子发射断层显像(positron emission tomography,PET)/CT[4]来显示NPC颅底骨质受累情况,了解肿瘤病灶范围,可为正确放疗提供其他方法难以提供的直观影像学资料。本研究比较SPECT/CT与MRI在NPC颅底检查中的应用。
1 资料和方法
1.1 临床资料
回顾性分析2015年3月—2016年10月于江西省肿瘤医院就诊的317例NPC住院患者的资料。排除标准:① 治疗后未进行复查和治疗前、后影像学资料不全的100余例;② 有明显金属伪影的4例;③ 非初诊患者100余例。
共83例患者纳入研究,根据美国癌症联合会(American Joint Committee on Cancer,AJCC)标准,其中T3期68例,T4期15例。所有患者均为初诊患者,检查前未接受任何治疗,并经医院伦理委员会批准同意,签署SPECT/CT及MRI检查知情同意书后行SPECT/CT、MRI平扫和增强扫描,两种检查间隔时间不超过1周。所有患者均经鼻咽镜活检病理学确诊,接受根治性放疗(常规于面颈联合+颈前切线,70~75 Gy),放疗结束1个月后行MRI平扫、增强及扩散加权成像(diffusion weighted imaging,DWI)。患者年龄16~72岁,平均年龄(49.3±11.7)岁。其中男性57例,年龄16~72岁,平均年龄(49.6±11.5)岁;女性26例,年龄23~70岁,平均年龄(49.5±11.8)岁。
将患者进行如下分组:NPC颅底侵犯阳性63例,NPC颅底侵犯阴性20例。另设10例健康者为对照。
1.2 检查方法
1.2.1 SPECT检查
采用德国Siemens公司Symbia T2双探头SPECT/CT仪,配低能通用型准直器。患者准备按骨扫描常规检查,静脉注射740~1 110 MBq99mTc-亚甲基二膦酸盐(methylene diphosphonate,MDP)3~4 h后全身显像,进床速度为18 cm/min。头颅SPECT结合定位CT扫描:将患者头颅可疑病灶静置于探头视野中心,仪器自动采集,矩阵128×128,放大倍数为1.0,双探头各旋转180°,共采集32帧,每帧20~30 s。然后行CT检查,扫描参数:电压130 kV,螺距2,层厚2~5 mm。最后利用SPECT/CT附带的专用软件,将SPECT断层图像和CT解剖图像进行融合。
1.2.2 MRI检查
采用美国GE公司HDI-1.5T超导型磁共振设备,应用头颈部联合线圈,扫描范围自额窦至第三颈椎水平。常规扫描采集序列为横断位T1加权像、T2加权脂肪抑制像,矢状位T1加权像,冠状位T2加权像。参数:T1加权像重复时间(repetition time,TR)400~500 ms,回波时间(echo time,TE)10~20 ms;T2加权脂肪抑制像SPIR序列的TR为2 000~2 500 ms,TE为100 ms)。横断位层厚5.0 mm,间距1.0 mm;冠状位及矢状位层厚4.5 mm,间距0.5 mm;扫描野220 mm,矩阵260×280。所有患者均行钆喷酸葡胺(gadolinium-diethylenetriamine pentaacetic acid,Gd-DTPA)增强扫描,经肘静脉注射Gd-DTPA,剂量0.1 mmol/kg,流率2.5 mL/s,行横断位、冠状位及矢状位T1WI增强扫描,参数同上。根据鼻黏膜及垂体强化程度判断增强效果,全部满意。MRI与SPECT/CT检查时扫描体位相同。
1.2.3 图像处理及分析
用FLASH 3D法重建SPECT图像,得到横断面、冠状面及矢状面三维图像,然后与定位CT图像结合(每层厚5 mm)。由2名从事10年以上核医学或MRI工作的医师阅片,共同分析,意见不一致时协商统一。在所得SPECT矢状位图像中,于颅底骨质放射性分布最高层面(L)与高位颈椎体(C1-C3,S)处勾画大小相同的感兴趣区(region of interest,ROI),计算L/S。L/S值参考Chan等[5]的报道。0级与l级(L/S≤1):考虑颅底骨质结构完整,未见明确侵犯和轻微的骨膜反应;2级[L/S>1或L/S≤1但同机CT(调为骨窗后)于2个断层连续2个以上层面出现骨质破坏]:考虑颅底骨侵犯(skull-base bone invasion,SBBI);WBI示颅面区显示异常放射性核素浓聚或不对称显像考虑异常。浓聚部位的定位依据Israel等[6]的报道。对所有患者随访6~12个月,根据临床、鼻咽MRI结果明确最终诊断。SPECT/CT判断SBBI的方法:SPECT为颅底骨质放射性核素分布较对侧或邻近正常骨质增浓(异常浓聚灶)或明显稀疏甚至缺损;颅底骨皮质中断,骨小梁稀疏缺损、骨质增生硬化及软组织肿块代替正常骨质结构。MRI诊断SBBI的标准:T1WI上呈低信号,增强扫描明显强化,则判定为SBBI;否则判为阴性。SBBI的最终判断参考Jadvar等[7]的方法,以复查的MRI为“最终判断标准”,分析最初的SPECT/CT和MRI对NPC患者SBBI的诊断效能。
1.3 统计学处理
采用SPSS 19.0软件,对原始数据行统计学处理。计量资料以x±s表示,组间比较采用独立样本t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
对照组中,颅底骨质未见明确放射性分布浓聚,且示踪剂分布略淡于上位颈椎体,L/S值为0.915±0.397。病变组中,头颅显像示SBBI者(阳性组),其颅底骨质放射性分布增浓,示踪剂分布高于上位颈椎体(图1);头颅显像示颅底骨无侵犯者(阴性组),其颅底骨质放射性分布减淡,示踪剂分布低于上位颈椎体。阳性组与阴性组的L/S值分别为2.05±0.876和0.529±0.218,差异有统计学意义(t=0,P<0.01)。
比较SPECT和MRI诊断结果与随访结果,随访确诊SBBI 64例,MRI检查真阳性64例,假阳性1例,真阴性18例,SPECT/CT检查真阳性60例,假阳性3例,真阴性16例,假阴性4例。MRI诊断SBBI的灵敏度为100%(64/64),特异度为94.74%(18/19),漏诊率为0(0/64),误诊率为5.26%(1/19);SPECT/CT诊断SBBI的灵敏度为93.75%(60/64),特异度为84.21%(16/19),漏诊率6.25%(4/64),误诊率为15.79%(3/19);MRI诊断SBBI的灵敏度、特异度高于SPECT/CT,漏诊率、误诊率低于SPECT/CT(表1)。
83例NPC中,随访确诊SBBI共64例。MRI诊断蝶骨受累的灵敏度为85.93%,低于SPECT/CT的90.63%,但差异无统计学意义(P>0.05);MRI诊断颞骨受累的灵敏度为73.44%,高于SPECT/CT的53.13%,差异有统计学意义(P<0.05);MRI诊断枕骨受累的灵敏度为89.06%,高于SPECT/CT的82.81%,但差异无统计学意义(P>0.05,表2)。
83例NPC患者中,头颅SPECT/CT诊断SBBI的阳性率与MRI差异无统计学意义(P>0.05)。诊断不一致的6例患者接受随访,其中1例假阳性患者以后确诊为SBBI阴性,4例假阴性患者经MRI随访示为阳性。
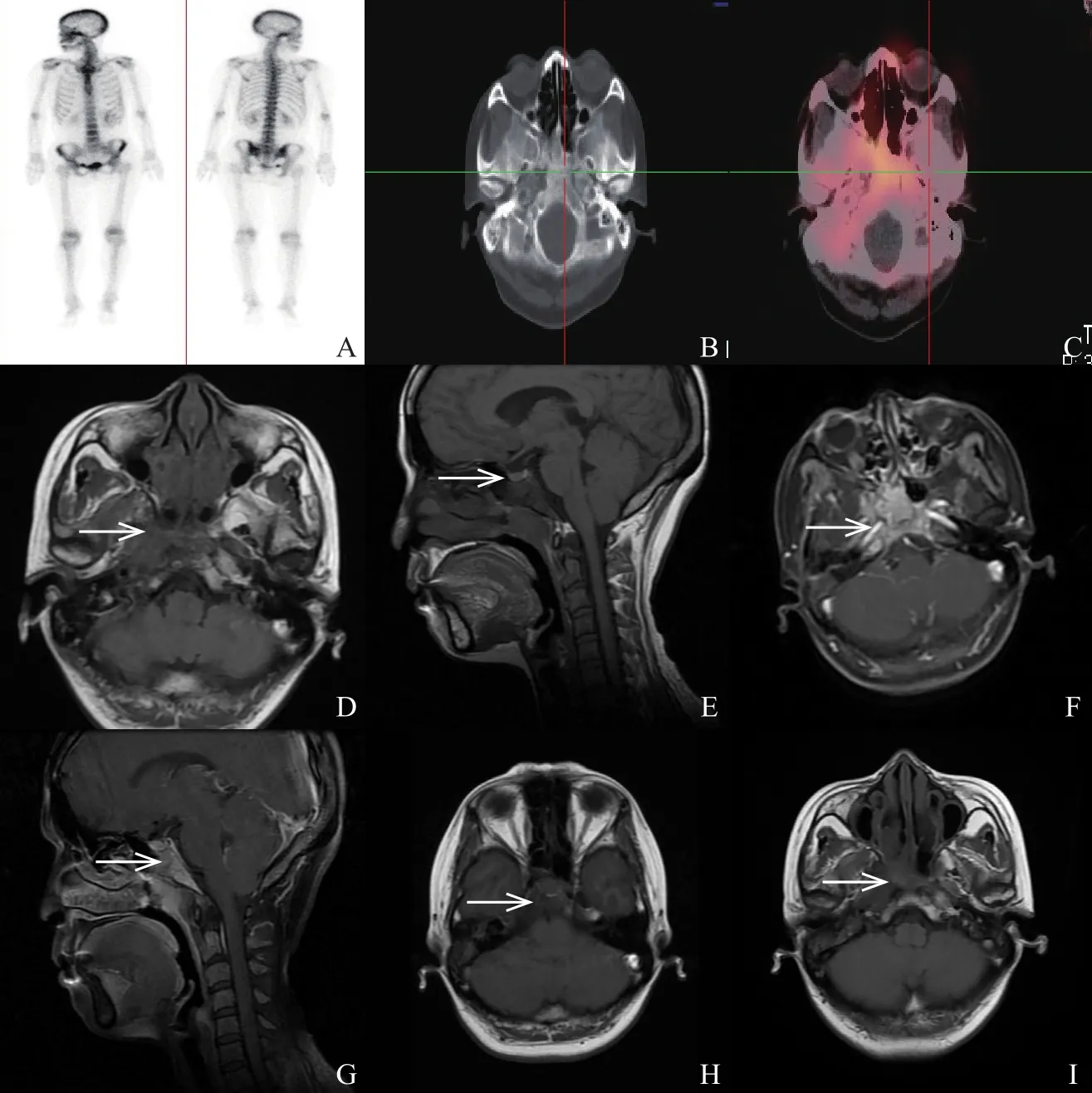
图 1 NPC患者,33岁,女性
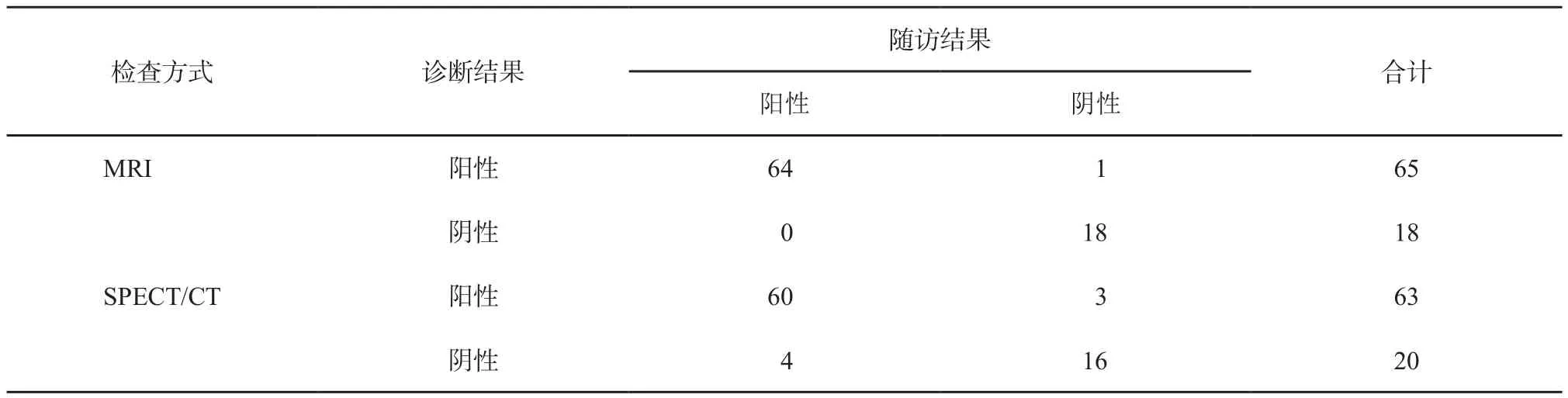
表 1 SPECT和MRI诊断结果与随访结果的比较(n)

表 2 SPECT/CT和MRI检查颅底骨质各部位受累情况(n)
根据中国NPC 2008分期,MRI已被确立为鼻咽癌T、N分期的首要影像学检查手段和诊断依据,其扫描规范参照中国NPC 2008分期[8]。CT可作为诊断肿瘤侵犯颅底骨质结构的重要补充手段。
MRI在NPC诊断方面具有极大的优势:可清晰显示颅底侵犯部位、范围和骨髓变化,尤其能较早显示骨质破坏前的骨髓变化。Zhang等[9]研究认为, MRI诊断SBBI的灵敏度为96.7%,而CT为66.7%,MRI显著高于CT。随着影像学技术的不断发展,其临床应用也面临挑战。SPECT/CT是SPECT与CT融合产生的影像,SPECT图像显示局部骨骼对显像剂的摄取,与该部位血流量和骨盐代谢水平成正比。SPECT/CT是在全身骨扫描的基础上加脏器断层扫描。李伟等[10]研究认为,NPC侵犯颅底首先引发的是颅底骨质代谢异常活跃,当骨盐代谢变化达5%~15%时[11],可能导致病变部位99mTc-MDP骨显像剂摄取增多而形成放射性浓集的“热区”,反之形成放射性分布缺损的“冷区”。也有人认为,骨钙流失>1%时即可在SPECT上显示异常[12],而CT图像可显示容易忽略的骨转移瘤细微改变,两者结合可发挥各自优势,有利于实现并推动精准医疗,为患者带来福音。本研究探讨NPC患者颅底显像阳性在SPECT/CT与MRI上的不同表现,比较两种检查的诊断意义。
本研究结果显示,SPECT/CT和MRI检测NPC患者SBBI均具有很高的灵敏度、特异度和准确率。枕骨斜坡是SBBI最好发部位。在SPECT/CT检出SBBI的解剖位点中,居前的分别为蝶骨、枕骨及颞骨,MRI分别为枕骨、蝶骨及颞骨,与李贻卓等[3]提到的侵犯模式基本一致。在侵犯的5个方向中,最多的为向上和向后上侵犯,其次是向前和向外上,最少为向后下,枕骨基底部受侵最常见,斜坡、翼突基底、翼突内侧板及岩尖破坏紧随其后。
本研究MRI检查中有1例假阳性和0例假阴性,其诊断SBBI的灵敏度高。此例假阳性的产生与图像质量、信号干扰、报告医师诊断水平有关。误判原因如下:SBBI位于蝶骨翼突,翼突体积小,骨质最薄,形态不规则,病变信号混杂,不利于影像观察,因此受侵骨质与肿瘤均表现为高信号,导致MRI医师难以诊断。此外,若合并其他良性骨质病变,如中耳炎、慢性鼻窦炎及放疗所致颅底骨坏死等也是导致假阳性的原因。
本研究SPECT/CT检查中有4例假阴性和3例假阳性,表明其易漏诊。假阴性的产生可能与图像质量差(低剂量CT分辨率低,SPECT图像欠清)、报告医师诊断水平有关。未能准确判断的原因如下:成骨修复骨质的速度慢于破骨速度,赶不上破骨细胞对正常组织的破坏速度。此外,姚红霞等[11]提到假阳性也可能由良性病变所致:原发肿瘤浸润邻近血管、软组织;外照射后骨质内血管发生一系列病理性改变,如炎性反应、内膜肿胀、血管栓塞、骨黏膜水肿渗出,逐渐造成颅底骨质局限性血供减少,最终导致微循环障碍。
本研究中L/S阈值的设定:按照严格的要求选择10例对照进行勾画并计算各自L/S值,同时行描述性统计学计算,其范围上限为0.915,因此参照文献[13]将L/S>1作为诊断阈值是客观、切实可行的。
头颈部SPECT/CT矢状位重建融合图像利用CT重建技术,在不增加费用的前提下即可得到相当于头颈部局部静态显像,利用半定量分析方法获得L/S值,能大致诊断SBBI,方法简单,阈值设定也客观可行,值得在临床上推广。
综上所述,MRI检出的颅底骨质病灶多于SPECT/CT,但发现翼突上病灶的能力低于SPECT/CT。由此可见,MRI显示颅底细微骨质(如翼突、犁骨等)处病灶存在缺陷,而SPECT/CT可发挥CT的优势,显示骨质微小病变的变化,且SPECT/CT只是在全身骨扫描的基础上进行,无需另外注射药物(但增加检查费用,除非两项断层扫描均免费),因此将SPECT/CT与MRI结合,可取长补短,提供更准确的影像学诊断,发挥更积极的作用。

