葛根增效丹参在脑缺血再灌注中的保护作用研究
马和硕 ,吕 杰 ,刘 淼,钟顺杰,张婷婷,彭 超,罗礼容
(西南医科大学:1临床医学本科2016级;2基础医学院机能实验室,四川泸州 646000)
缺血性脑血管病(ischemic ceebral vascular disease,ICVD)是指大脑中的血液供应障碍,从而相应血供区域缺血、缺氧,导致脑组织坏死、软化,引起短暂或永久性损伤。其机制复杂,目前抗脑缺血药物的作用无法取得理想效果[1]。丹参作为传统活血化瘀药具有广泛的生物活性并且其在脑缺血再灌注损伤治疗中的作用日益受到关注。研究表明,丹参及其主要活性物质能够改善血管内皮祖细胞的生物活性从而减轻缺血再灌注损伤[2]。
丹参与葛根配伍能够有效治疗血瘀并主要用于心脑血管疾病,有研究表明,丹参配伍葛根能够更好的改善血瘀大鼠的血液流变性[3]。葛根属代表性风药有医者认为祛风药在血瘀证的治疗中具有重要意义。风药在很多方面能够增强活血化痰药的疗效,尤其是头部和肌肉上的血瘀往往非用风药难获佳效[4]。
本课题拟采用现代手段建立大鼠MCAO 模型并进行相预,初步证明丹参可以对脑缺血再灌注损伤起到一定保护作用并且葛根可以增强丹参在脑缺血再灌注损伤中的保护功效,并通过检测VEGF 的变化,探讨这种增效作用的机制,为脑缺血再灌注损伤的防治提供新的配伍与临床治疗思路。
1 材料与方法
1.1 实验材料
材料清洁级240 g雄性SD大鼠60只(重庆腾鑫科技),MCAO 线栓(北京西浓科技有限公司2432A2),TTC 染液(上海信裕),10%水合氯醛(上海恒远)兔抗大鼠VEGF(武汉博士德),山羊抗兔二抗(北京中杉金桥生物技术有限公司),丹参,葛根。
1.2 方法
1.2.1 分组
采用随机分组的方法将60只SD雄性大鼠分成6 组,MCAO 模型组丹参组、葛根组、双药组,对照组、假手术组。
1.2.2 给药
①葛根组:取葛根100 g 放入水中,浸泡20 min后分两次水煎,用文火慢慢熬煎,头煎从汤沸后再熬45 min,滤出药汤;二煎则在沸后再煮25 min,两次汤液混合均匀,浓缩至水煎剂与生药比为1:1,存入4 ℃冰箱保存[5]。②丹参组:称取丹参100 g按上述方法配置水煎剂。③双药组:以1∶1 的比例称取双药各100 g,充分混合、重复上述方法。丹参组术后给予丹参水煎剂,按照每公斤体重,给予于相当于生药5 g的水煎剂,给药7 d,每日灌喂一次。葛根组按上述给药方法给药葛根水煎剂。双药组按上述给药方法给药混合水煎剂。其余各组每天喂食5 mL 生理盐水,灌喂7 d。
1.2.3 MCAO模型制造
根据林军[6]等总结的MCAO线栓经验采用改良线栓栓塞法制作大鼠MCAO模型。按每公斤体重4 mL使用10%水合氯醛腹腔注射法麻醉大鼠。自大鼠颈部中线处行手术切口,向右侧分离皮下组织与肌层,游离右侧颈总动脉(CCA)后,沿CCA上行游离颈内动脉(ICA)与颈外动脉(ECA)并结扎ECA与CCA近心端(不结扎翼腭动脉)后自CCA插入栓塞线,栓塞线标记处约位与ECA、ICA分叉处(18~20 mm),固定栓塞线,分层缝合。栓塞两小时后抽出栓塞线。
1.2.4 检测指标
1.2.4.1 神经功能评分
采用经典Longa 评分方法,正常为0 分,提起尾巴无法伸展对侧前爪评为1 分,行走时向一侧转圈评为2分,倾倒评为3分,意识水平下降,不能自发行走评为4分。
1.2.4.2 测定梗死面积
大鼠深度麻醉,断头取脑,去小脑低位脑干,-21℃冷冻20 min 后,将剩余部分冠状面切成厚薄相同的6 片后置于2%TTC 溶液中,37 ℃恒温染色25 min,拍照,采用IPP 6.0 图像分析软件分析图像,计算梗死面积。
1.2.4.3 免疫组化发检测VEGF表达
使用4%多聚甲醛固定大鼠脑组织并存放至蔗糖中(沉底)后使用OTC包埋。冰冻后切片,切片厚度约为0.2 cm。切片后将组织用丙酮浸泡25 min,PBS反复冲洗3次。置于甲醛(30 mL)、PBS(10 mL)、30%H2O2(0.5 mL)混合液中浸泡15 min,PBS冲洗3次。先加入兔抗大鼠VEGF 抗体(1∶1 000),置于室温6 h后PBS冲洗,再加入山羊抗兔二抗置于室温1 h,PBS 冲洗、显色、脱水、透明后中性树胶封片后置于高倍显微镜下,随机选取2个视野,读取VEGF阳性细胞个数,取平均数。
1.2.5 统计学方法:
2 结果
2.1 神经功能评分比较
与假手术组比较,MCAO 组神经损伤程度明显提高(P<0.05)。与模型组比较,丹参组,葛根组神经评损伤程度均有所下降(P<0.05);双药组大鼠与丹参组相比,神经评分明显下降(P<0.05),见表1。
表1 各组大鼠神经功能评分及脑梗死面积的比较(±s)
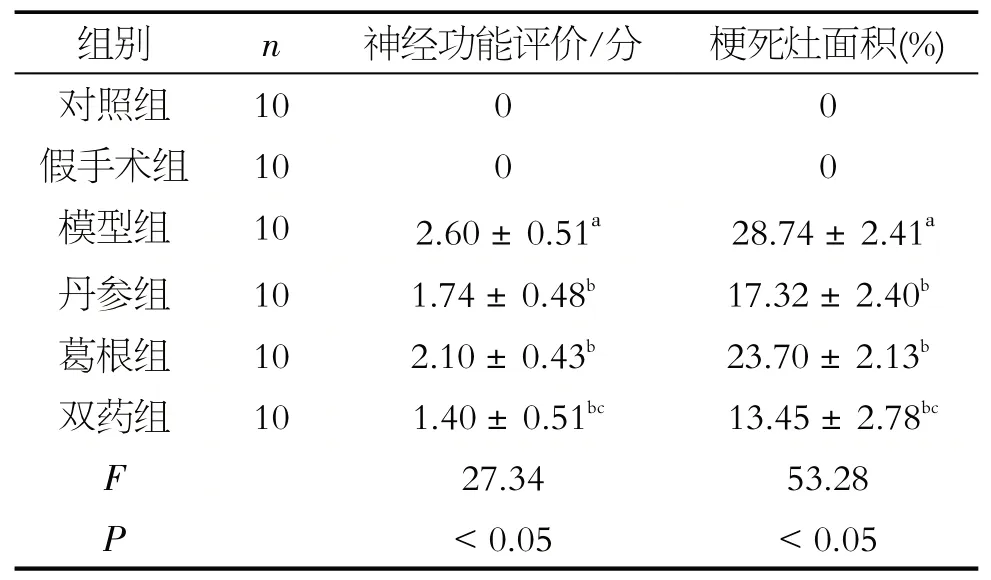
表1 各组大鼠神经功能评分及脑梗死面积的比较(±s)
注:a表示与假手术组比较,P<0.05;b表示与MCAO模型组比较,P<0.05;c表示与相丹参组比较,P<0.05
2.2 大鼠脑梗死面积比较
除对照组与假手术组外,各组大鼠右侧脑组织均出现明显苍白色梗死灶。与假手术组比较,模型组大鼠切片梗死区域明显(P<0.05);丹参组、葛根组大鼠与模型组大鼠相比,梗死面积均有所减少(P<0.05),葛根组与丹参组之间不存在明显差异(P>0.05)。双药组大鼠与模型组大鼠相比,梗死面积下降(P<0.05);双药组大鼠与丹参组大鼠相比梗死面积下降(P<0.05)见表1,图1。
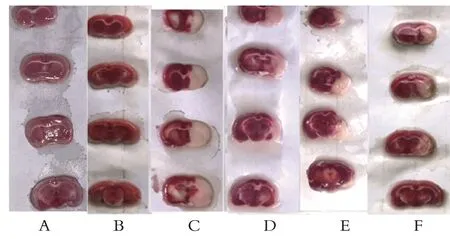
图1 各组大鼠脑梗死情况
2.3 免疫组化发检测VEGF表达结果:
各组大鼠均存在VEGF 表达,对照组与假手术组之间不存在统计学差异(P>0.05)。与对照组与假手术组比较,模型组、丹参组、葛根组与双药组VEGF 表达均升高(P<0.05);双药组VEGF 阳性表达明显高于丹参组(P<0.05)见表2。
表2 大鼠缺血部位VEGF表达(±s)
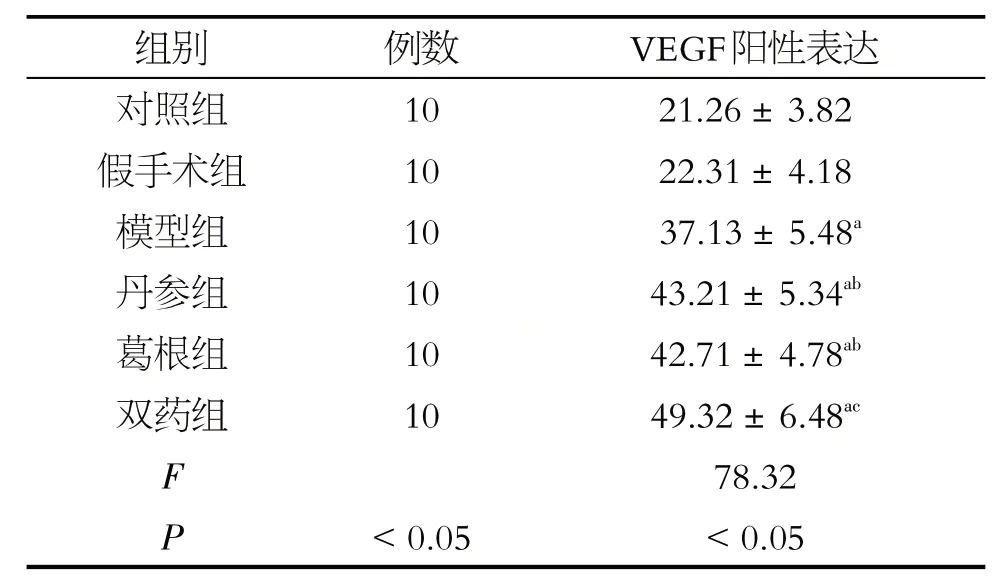
表2 大鼠缺血部位VEGF表达(±s)
注:a表示与假手术组比较,P<0.05;b表示与模型比较,P<0.05;c表示与丹参组比较,P<0.05
3 讨论
脑缺血,即脑血液供给不足,局部氧供应下降,能量代谢失衡所导致的脑组织损伤,较长时间的脑缺血会导致脑神经细胞坏死,这种坏死是不可逆的[7-8]。目前临床上治疗脑缺血的首要原则是即时进行再灌注治疗,恢复缺血部位的血供。然而,目前研究表明,当脑缺血再灌注发生时会诱导大量氧自由基引起脂质过氧化加速并诱发局部炎症反应,从而加重脑组织损伤[9-11]。因此,寻找减轻脑组织损伤或在缺血再灌注中提供保护作用的方法成为新的要求。经过大量的基础实验与临床研究后发现中药复方能够通过多种靶点与通道发挥作用,在预防和治疗脑缺血再灌注损伤方面具有独特的优势,其临床应用前景广阔。作为传统的血瘀药,丹参,因其疗效较好,不良反应轻已广泛运用于临床治疗。当前研究表明丹参可以抑制细胞凋亡,缓解炎症反应,抗氧化应激损伤和血小板聚集抑制,同时改善血脑屏障病理性开放[12],同时,基础研究及临床试验均表明,丹参可以在脑缺血再灌注期间保护脑组织[13]。但是,这种保护作用尚不足以在临床实践中起到理想的保护效果[14],因而本研究旨在寻找对丹参这种保护作用增效的方法,并研究其增效程度是否能够取得理想效果。
丹参配伍葛根不仅符合李东垣所创升阳化瘀法而且符合风药对活血化瘀药功效的增效作用,同时现代研究表明,葛根(pueraria)的主要成分葛根(pueraria lobata)和葛根素(葛根素)可引起血管舒张;丹参的主要成分丹参酮则具有改善血液循环并且提高机体缺氧耐受能力的作用,二者配伍,葛根能够促进血管的运动而丹参主要作用于血液本身,促进血液循环,消除血液淤滞,确保血管通畅[15]。通过本次研究发现,丹参葛根配伍后能够对丹参的脑缺血再灌注保护起到显著的增效作用其神经损伤与脑梗死面积均明显降低。
另外,丹参能够改善内皮祖细胞活性,它还激活PI3-K/AKT 途径以防止脑缺血再灌注损伤[16]。通过检测VEGF 的表达发现,丹参葛根配伍可以促进VEGF表达的上调。而VEGF表达上调可能与AKT/mTOR/Hif-1α信号通路表达有关该信号通路是与内皮祖细胞增殖、迁移、归巢相关的信号转导通路,通过促进骨髓内皮祖细胞归巢至缺血脑组织区,促进该区域血管再生[17]。其中雷帕霉素(mtor)具有促进血管生成的作用,它可以作为Hif-1α上游,调控其mRNA合成与蛋白质表达,从而促进血管发生[18-19]同时蛋白激酶B(AKT)可以直接调节Hif-1α与VEGF蛋白的表达,也可以作为mTOR 的上游因子,启动mTOR表达[20]。而葛根也可以激活AKT相关信号通路,因此可推测,这种保护作用以及葛根丹参配伍所起到的增效机制很可能与AKT/mTOR/Hif-1α信号通路有关。但由于本课题组经费限制,未能做进一步研究
本次研究发现了丹参葛根配伍能够对丹参的脑缺血再灌注后保护作用起到明显的增效作用,是否与AKT/mTOR/Hif-1α信号通路有关,有待进一步探究。
4 结论
丹参葛根配伍能够促进VEGF 表达上调,减轻缺血再灌注损伤大鼠脑梗死灶面积,证实葛根能够增效丹参在脑缺血再灌注中的保护作用。在一定程度上证实了风药对活血化瘀药功效的增效,有利于临床应用。

