苜蓿、小麦自毒及他感作用机理
郑 瑞,师尚礼,马史琛
(甘肃农业大学草业学院 / 草业生态系统教育部重点实验室 / 中-美草地畜牧业可持续研究中心, 甘肃 兰州 730070)
植物生长代谢途径中会产生一些次生物质,他们通过植物根系分泌、茎叶挥发和残体分解等途径释放到环境中,这些物质若对后茬同种作物生长产生影响,这种现象被称为自毒作用,若对后茬其他种植物的生长发育造成影响则称之为他感作用[1-2]。被誉为牧草之王的苜蓿(Medicago sativa)作为最重要的饲草之一,不仅填补了优质蛋白饲料的空缺,并且对促进奶产品、肉制品的优良发展做出了重要的贡献。然而,植株矮小、根系受损、幼苗死亡等现象在苜蓿连作后发生频繁[3],说明苜蓿连作极不利于他的发育生长,而自毒作用是造成苜蓿连作幼苗死亡和产量下降的主要原因[4]。有研究发现苜蓿植株的水浸提液抑制苜蓿种子的萌发和幼苗的生长,而且随着水浸提液浓度的增加抑制作用增强,说明苜蓿水浸提液中含有自毒物质[5]。研究者[6]发现苜蓿自毒物质香豆素和肉桂酸在处理浓度高于6 μg·mL-1后,抑制作用显著。苜蓿的自毒物质是由苜蓿的活体和残体产生并分泌或释放到周围环境,并且不是单一的某种物质,而是几种物质的混合物,这些物质的存在对下茬苜蓿种子萌发及幼苗生长造成了不可避免的伤害[7]。苜蓿体内自毒物质产生的影响因素有很多,例如苜蓿的品种、株龄、密度、土壤环境、田间管理、耕作制度等因素都会对自毒作用产生不同程度的影响[8]。由于自毒物质通过一般田间管理措施很难对其进行彻底消除,所以,对于由自毒作用引起的苜蓿连作障碍至今缺少有效的调控措施。
小麦(Triticum aestivum)是一种典型的他感型禾本科作物,也是存在连作障碍的作物之一,其主要通过根系分泌、残体分解等方式影响自身或邻近植物的生长发育。Kimber[9]研究发现小麦残体对小麦的生长有抑制作用,小麦的自毒作用在秸秆还田中表现十分明显,秸秆还田是为了改善土壤条件,然而这种措施往往会导致小麦本身发芽和生长受阻,产量下降[10]。进一步研究发现,小麦秸秆和种植过小麦的土壤浸提液明显抑制小麦的发芽和幼苗生长,并且已从小麦秸秆中分离出了香豆酸、对一羟基苯甲酸、丁香酸、香草酸、阿魏酸等他感物质[11]。有研究表明苜蓿与猫尾草(Phleum pretense)、燕麦(Avena sativa)等饲用禾本科谷物或玉米(Zea mays)、小麦等禾本科作物轮作一季后几乎能彻底降解苜蓿自毒作用[12-13]。
苜蓿和小麦轮作后苜蓿相对发芽率均达97%以上,有效刺激了苜蓿胚芽、胚根伸长,苜蓿轮作1年小麦可以全部解除自毒效应并且提高土壤微生物多样性,促进土壤由真菌型向细菌型转化,土壤肥力和酶活性也明显增加[14-15]。近年来,关于自毒物质在植物体内的含量和种类的研究收获颇多,然而对于自毒物质的侵害途径以及受体植物的中毒机制研究报道较为少见,苜蓿、小麦间他感作用的机理研究较为鲜见。本研究以苜蓿和小麦两种作物为试验材料,通过室内培养和生理生化指标的测定,研究两种作物的自毒、他感效应和其生理生化机制,为降解毒害以及合理轮作奠定理论基础。
1 材料与方法
1.1 试验材料
试验选用甘农2号紫花苜蓿(Medicago sativa‘Gannong No.2')、 陇 春 BJ103 小 麦 (Triticum aestivum‘longchunBJ-103')两种作物,种子来自甘肃农业大学草业学院,试验在甘肃农业大学草业学院实验室进行。
1.2 试验方法
1.2.1 浸提液制备
在直径为 180 mm × 350 mm 的花盆中采用沙培法种植苜蓿 (甘农 2号)和小麦 (陇春 BJ103)各10盆,每盆50粒,定时浇灌等量蒸馏水和营养液(霍格蓝氏营养液),培养40 d后,将幼苗连根取出,用自来水冲洗根部,晾干,放置于105 ℃的烘箱中杀青15~20 min,之后降低烘箱温度,维持在70~80 ℃,烘干,之后用碾槽碾碎至粉末。然后准确称取苜蓿干粉 0、0.1、0.25、0.5、1 g,分别加入 1 000 mL 蒸馏水溶解,在 24 ℃ ± 1 ℃ 条件下振荡浸提24 h,浸提物经过4层纱布过滤,初步去除其中的植物纤维,再经 3 000 r·min-1离心 2 h,取上清液真空抽滤,通过一层定量滤纸,最后,以蒸馏水分别定容[16-17],使苜蓿浸提液浓度分别为0(CK)、0.1、0.25、0.5、1 g·L-1,小麦各浓度浸提液制备同上。
用苜蓿浸提液浇灌下茬苜蓿种子和幼苗为苜蓿
自毒试验,浇灌下茬小麦种子和幼苗为苜蓿-小麦他感试验;用小麦浸提液浇灌下茬小麦种子和幼苗为小麦自毒试验,浇灌下茬苜蓿种子和幼苗为小麦-苜蓿他感试验。
1.2.2 种子萌发试验
取苜蓿(甘农2号)和小麦(陇春BJ103)种子,在0.05%的次氯酸钠溶液中消毒15 min,取出种子,用蒸馏水反复冲洗(约5~6次)至次氯酸钠完全冲洗干净。在9 cm的培养皿中铺上滤纸,用少量的蒸馏水浸湿滤纸,使滤纸和培养皿底部完全贴合。每个培养皿放置苜蓿种子(甘农2号)30粒,小麦种子(陇春BJ103)20粒,用各个浓度的苜蓿幼苗浸提液分别将苜蓿和小麦种子完全浸没,每个浓度做3次重复,蒸馏水处理作为对照。小麦幼苗浸提液处理同上。培养皿加盖后放置于24 ℃,14 h光照10 h黑暗的光照培养箱中,期间定时定量添加浸提液少许,保证种子发芽的湿润环境。120 h后测定发芽率、下胚轴长度(苜蓿)、胚芽鞘长度(小麦)及胚根长[18]。
3.1.3 坝料摊铺 粘土心墙料铺筑沿坝轴线进行,铺料时严格控制铺土厚度,土料采用推土机及装载机摊铺平整,并随时进行铺料厚度测量,确保厚度满足要求。
1.2.3 幼苗生长试验
将消毒后的苜蓿、小麦种子分别种于直径为180 和350 mm的花盆,苜蓿每盆30粒,小麦每盆20粒。定期浇灌不同处理的浸提液30 mL(苜蓿浸提液分别浇灌苜蓿和小麦,小麦浸提液分别浇灌小麦和苜蓿),以蒸馏水为对照,3次重复,常规方法管理。4周随机选取苜蓿、小麦幼苗各20株,测定幼苗株高、根长、苗鲜重、根鲜重。计算化感效应指数(RI):
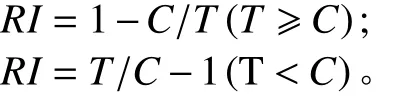
式中:C为对照值,T为处理值。当RI>0 时,表示促进作用;当RI<0 时,表示抑制作用。RI绝对值的大小代表化感作用强度[19-20]。
1.2.4 生理指标的测定
采用氮蓝四唑(NBT)法、愈创木酚法和高锰酸钾滴定法分别测定超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)的活性[21]。采用李合生[18]的方法测定细胞膜相对透性、丙二醛(MDA)含量;采用Mukherjee和Choudhuri[22]的方法测定H2O2含量。
1.3 数据统计分析
试验所得数据采用Excel 2010对数据进行整理,采用 IBM SPSS Statistics 19.0 进行数据处理和方差分析。
2 结果与分析
2.1 浸提液对苜蓿、小麦种子萌发的自毒和他感效应
浸提液种内浇灌,随着浸提液浓度的增加发芽率呈逐渐下降趋势;种间浇灌随着浸提液浓度的增加发芽率呈先增后减趋势(图1)。与对照相比,苜蓿浸提液浓度为0.1 g·L-1时,受体苜蓿种子发芽率无明显变化,浓度为0.25、0.5和1 g·L-1时,受体苜蓿种子发芽率分别降低8.58%、17.46%和41.41%,且差异显著(P<0.05);与对照相比,苜蓿浸提液
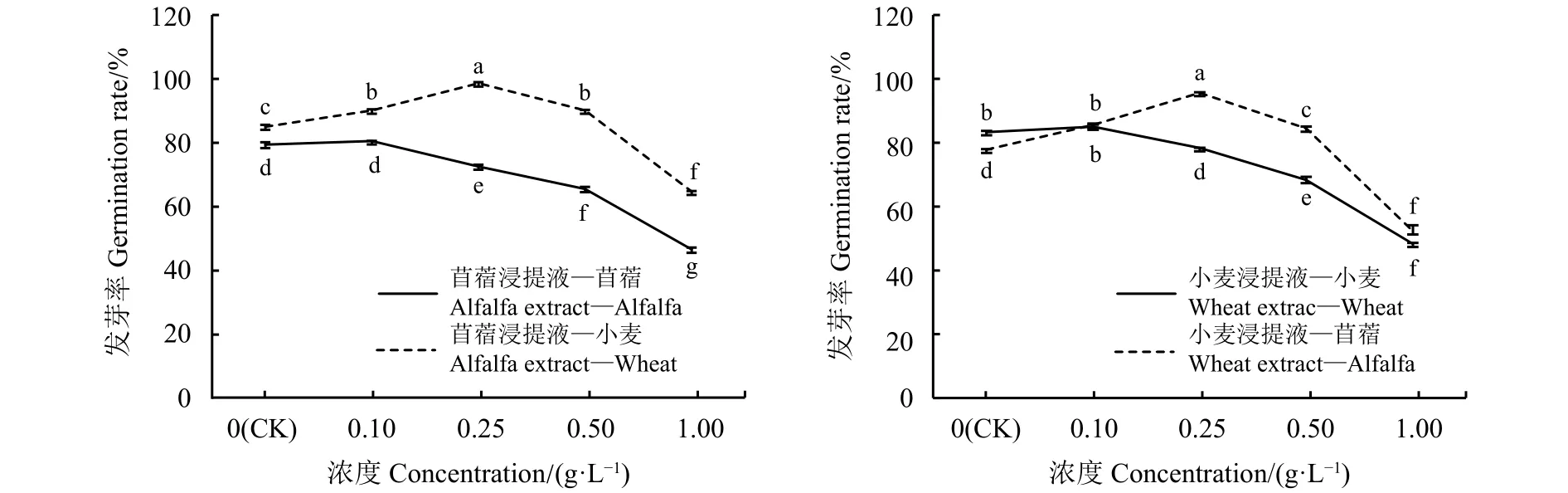
图 1 浸提液浓度处理的苜蓿、小麦种子发芽率Figure 1 Different concentrations of leaching solution on alfalfa and wheat germination rates
自毒效应使苜蓿、小麦胚根长度随着浸提液浓度增加而降低,当浓度大于0.5 g·L-1后,下降明显;他感效应使苜蓿、小麦胚根长度随着浸提液浓度增加呈先增后减趋势,相比受体小麦胚根长度的变化,受体苜蓿变化幅度较大(图2)。与对照相比,苜蓿浸提液浓度为0.1 g·L-1时,受体苜蓿胚根长度与对照差异不显著(P>0.05),浓度为0.25、0.5和1 g·L-1时,受体苜蓿胚根长度分别降低 18.18%、25%和79.92%,且差异显著(P<0.05),自毒作用明显;与对照相比,苜蓿浸提液浓度为0.1、0.25和 0.5 g·L-1时,受体小麦胚根长度升高 7.77% 、18.45% 和 10.16%,0.5 g·L-1时 促 进 效 应 开 始 减弱,浓度为1 g·L-1时,受体小麦胚根生长受到抑制,降低 25.53%,且差异显著 (P<0.05)。与对照相比,小麦浸提液浓度为0.1 g·L-1时,受体小麦胚根长度与对照差异不显著(P>0.05),小麦浸提液浓度为0.25、0.5和1 g·L-1时,受体小麦的胚根长分别降低 0.79%、4.73%和43.15%;与对照相比,小麦浸提液浓度为 0.1、0.25 和 0.5 g·L-1时,受体苜蓿的胚根长度升高 17.57%、32.13%和15.92%,0.5 g·L-1时促进效应开始减弱,当小麦浓度为 1 g·L-1时,苜蓿胚根生长受抑,降低 49.63%(P<0.05)。综上所述,浸提液种内处理,胚根长度随着浸提液浓度的增加而减小,自毒效应明显,且苜蓿自毒效应大于小麦;种间处理,浓度为0.1、0.25和0.5 g·L-1时,促进胚根生长,存在他感正效应,且0.25 g·L-1时达到最佳,0.5 g·L-1的促进效应开始减弱,表现为低促高抑的他感浓度效应。
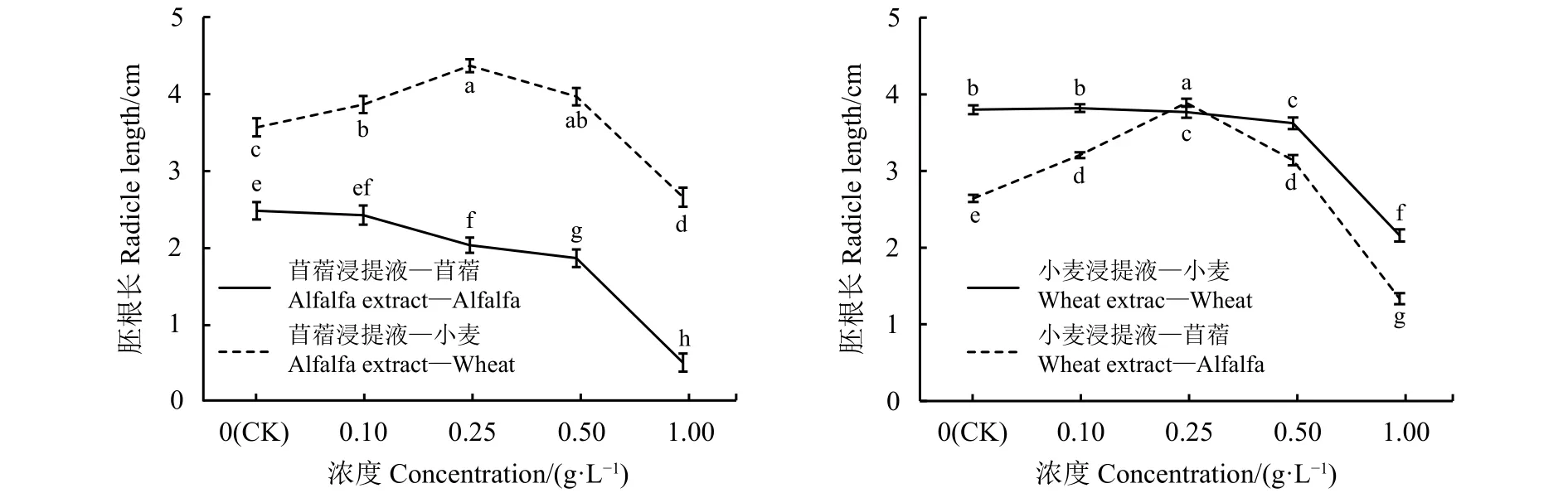
图 2 浸提液浓度处理的苜蓿、小麦胚根长Figure 2 Different concentrations of leaching solution on alfalfa and wheat radicle length
小麦浸提液对苜蓿下胚轴长的影响较苜蓿浸提液对小麦胚芽鞘长的影响明显,说明苜蓿下胚轴长较小麦胚芽鞘对他感作用更敏感(图3)。与对照相比,苜蓿浸提液浓度为0.1 g·L-1时,受体苜蓿下胚轴长度与对照差异不显著(P>0.05),浓度为0.25、0.5和1g·L-1时,受体苜蓿下胚轴长度分别降低 20%、32.73%和 67.27%,且差异显著 (P<0.05);与对照相比,苜蓿浸提液浓度为0.1、0.25和 0.5 g·L-1时,受体小麦的胚芽鞘长度分别升高 5.9%、 15.16%和1.95%,只有 0.25 g·L-1时与对照差异显著 (P<0.05),浓度为1g·L-1时,小麦胚芽鞘生长受抑,降低24.83%(P<0.05)。与对照相比,小麦浸提液浓度为0.1 g·L-1时,受体小麦的胚芽鞘长与对照差异不显著 (P>0.05),浓度为 0.25、0.5 和 1 g·L-1时,受
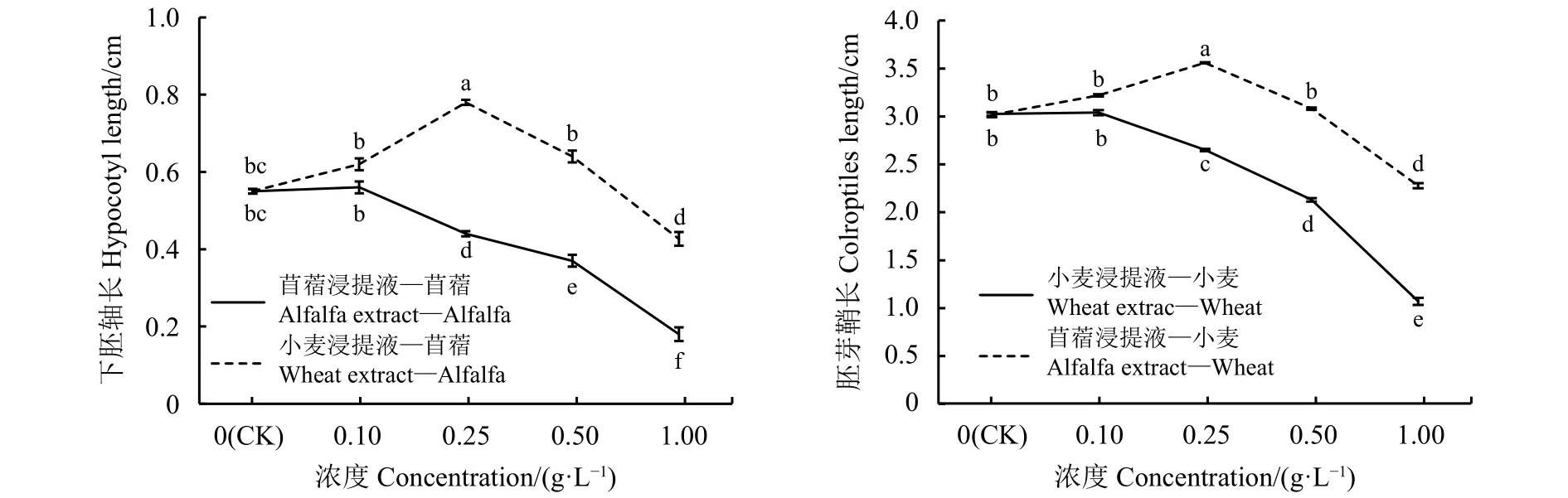
图 3 浸提液浓度处理的苜蓿下胚轴长和小麦胚芽鞘长Figure 3 Lengths of alfalfa hypocotyls and wheat coleoptiles in plants treated with extracts
体小麦的胚芽鞘生长受到抑制,降低 12.54%、29.7%和64.69%,且差异显著(P<0.05);与对照相比,小麦浸提液浓度为0.1、0.25和0.5 g·L-1时,受体苜蓿下胚轴长度分别升高11.29%、29.48%、14.06%,只有0.25g·L-1时与对照差异显著 (P<0.05),小麦浸提液浓度为1 g·L-1时,受体苜蓿下胚轴伸长受抑,降低 21.82%(P<0.05)。综上所述,浸提液种内处理,苜蓿下胚轴和小麦胚芽鞘长度随着浸提液浓度的增加而减小,自毒效应明显,苜蓿自毒效应大于小麦;异种间处理,浓度为0.1、0.25和0.5 g·L-1时,苜蓿下胚轴和小麦胚芽鞘长度高于对照,但只有0.25 g·L-1处理时他感正正效应显著(P<0.05),浓度为 1 g·L-1时,他感负效应显现。
2.2 浸提液对苜蓿、小麦幼苗生长的自毒和他感效应
苜蓿、小麦幼苗生长的自毒效应随着浸提液浓度的增大而增强,其化感指数均为负值。他感效应在浸提液浓度为 0.1~0.5 g·L-1时表现为正效应,化感指数为正值,且浓度为0.25 g·L-1时他感正效应最明显,0.5 g·L-1时正效应开始减弱,浓度为 1 g·L-1时,表现为他感负效应 (表 1)。苜蓿浸提液使受体苜蓿幼苗生长受抑,且随着浸提液浓度的增大抑制作用增强;苜蓿浸提液浓度为0.1、0.25和 0.5 g·L-1时,促进受体小麦幼苗生长, 0.25 g·L-1时苜蓿浸提液促进作用最明显,与对照相比,受体小麦的苗高、根长、苗鲜重和根鲜重分别升高23.3%、14.25%、17.10%和13.40%,且差异显著(P<0.05),0.5 g·L-1时正效应开始减弱,1 g·L-1的苜蓿浸提液抑制受体小麦的幼苗生长,其苗高、根长、苗鲜重和根鲜重分别降低9.53%、10.20%、7.38%和3.11%,表现出低促高抑的他感浓度效应。与对照相比,小麦浸提液浓度为0.1、0.25和0.5 g·L-1时,促进受体苜蓿幼苗生长,其中 0.25 g·L-1时小麦浸提液使苜蓿的苗高、根长、苗鲜重和根鲜重分别显著升高 49.38%、59.60%、78.05%和110.93%(P< 0.05), 小 麦 浸 提 液 浓 度 为 1 g·L-1时,苜蓿幼苗生长受抑,其苗高、根长、苗鲜重和根鲜重降低 4.83%、19.29%、2.99%和16.29%,表现为低促高抑的浓度效应,与苜蓿浸提液对小麦幼苗生长的他感作用一致。
2.3 浸提液对苜蓿、小麦自毒和他感作用的生理机制
2.3.1 浸提液浓度对苜蓿、小麦SOD、POD和CAT活性的调控
SOD酶活性强弱代表植物体预防活性氧毒害的程度,对植物细胞起保护作用。苜蓿浸提液浓度为0.1 g·L-1时,受体苜蓿的SOD酶活性无明显变化,浓度为 0.25、0.5 和 1 g·L-1时,受体苜蓿SOD酶活性显著低于(P>0.05)对照13.18、33.92%和54.62%,苜蓿浸提液浓度为 0.1、0.25 和 0.5 g·L-1时,受体小麦SOD活性较对照高出9.51%、16.34和 6.06%(P<0.05),浓度为 1 g·L-1时,受体小麦SOD酶活性开始减弱,低于对照5.88%(图4)。小麦浸提液浓度为 0.1、0.25 g·L-1时,受体小麦的SOD酶活性与对照差异不显著(P>0.05),浓度为0.5、1 g·L-1时,受体小麦SOD酶活性分别显著低于对照8.75%和23.28%;小麦浸提液浓度为0.1、0.25和 0.5 g·L-1时,苜蓿 SOD酶活性显著高于对 照 28.96%、42.54%、34.05%(P<0.05),浓度为 1 g·L-1时,SOD酶活性减弱,低于对照8.49%。综上,浸提液种内处理,浓度超过0.1 g·L-1后,苜蓿即刻表现出明显的自毒效应,浓度超过0.25 g·L-1后,小麦才表现出自毒效应,表明自毒效应对SOD酶活性的影响,苜蓿比小麦更敏感;浸提液种间处理,浓度为 0.1、0.25 和0.5 g·L-1时,SOD 酶活性增强,表现为他感正效应,其中0.25 g·L-1的浸提液使 SOD酶活性增强最多,浓度为 1 g·L-1时,SOD活性减弱,表现为他感负效应。
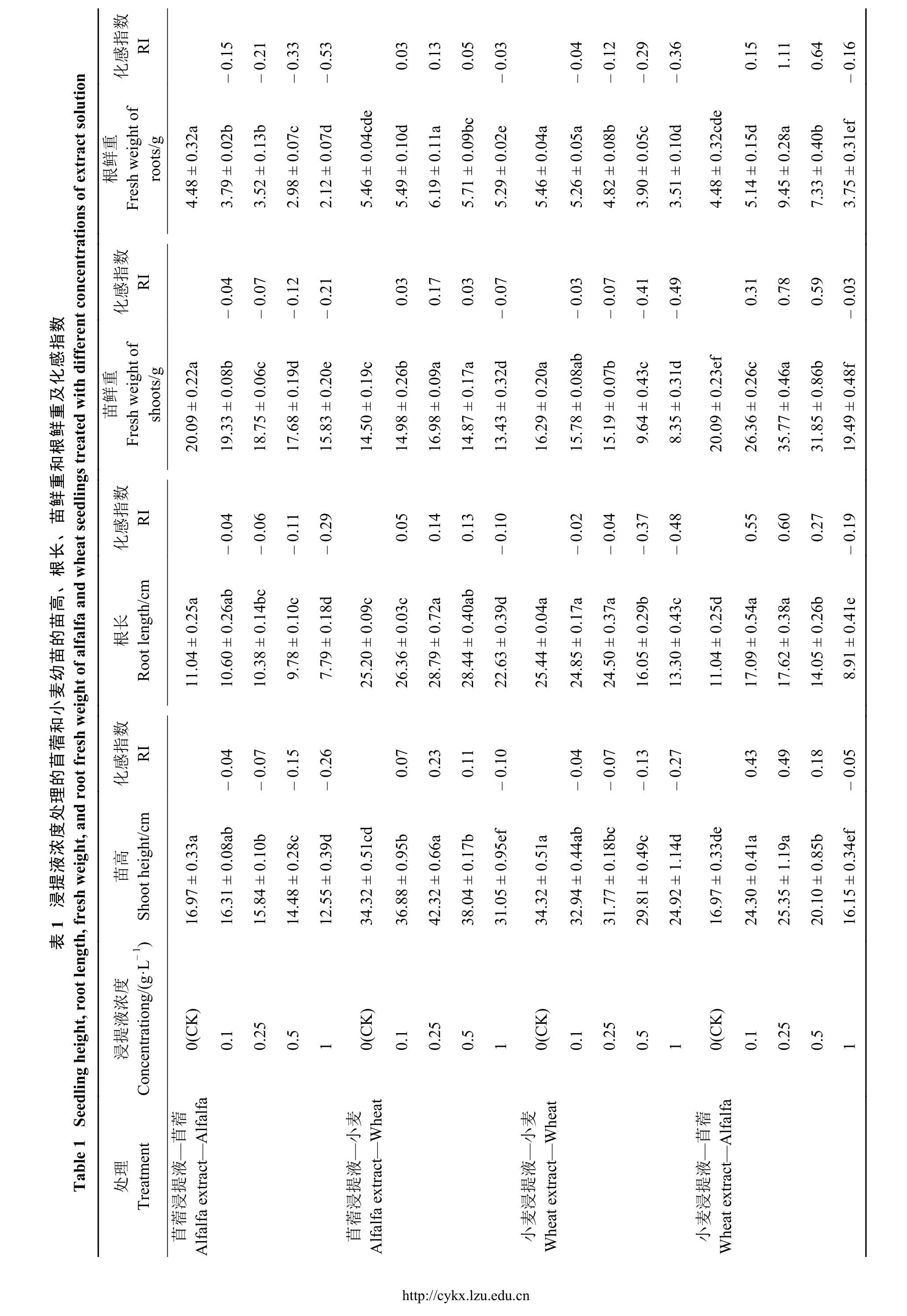
?
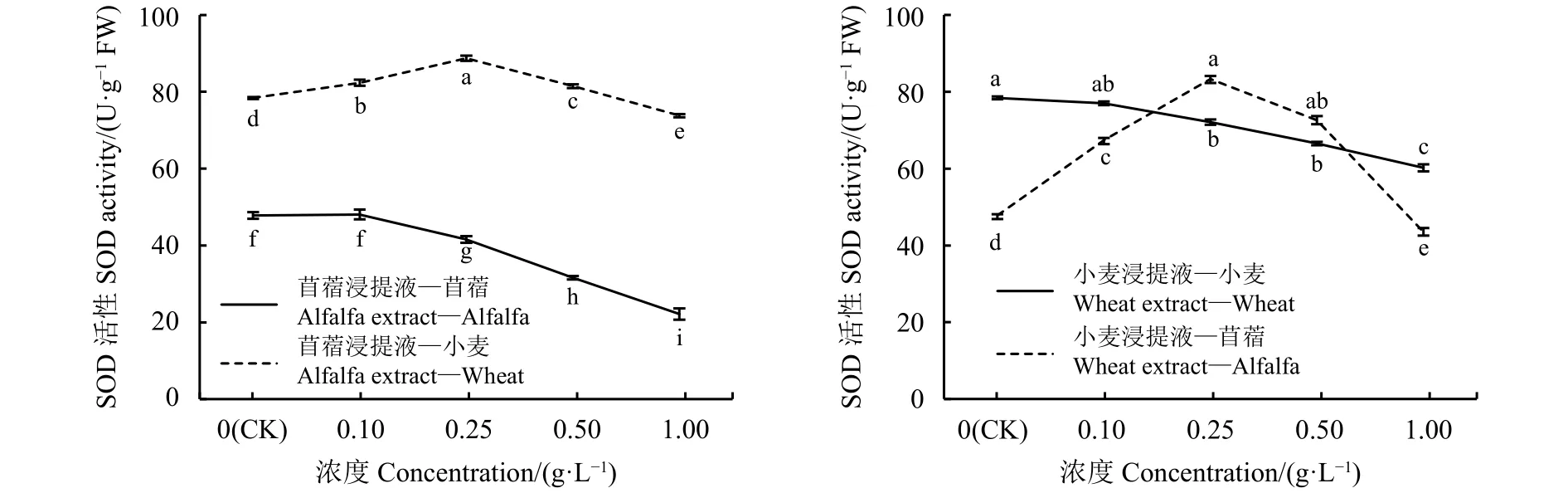
图 4 浸提液浓度处理的苜蓿、小麦超氧化物歧化酶(SOD)活性Figure 4 Superoxide dismutase (SOD) activity of alfalfa and wheat treated with different concentrations of leaching solution
POD酶是植物体内普遍存在的、活性较高的,并避免活性氧的产生和积累的保护酶之一。苜蓿、小麦的自毒效应对POD酶活性的影响变化趋势一致,随着浸提液浓度增大POD酶活性减弱;他感效应对POD酶活性的影响呈先增后减趋势,苜蓿浸提液浓度为0.5 g·L-1时小麦POD酶活性达到最大值,而小麦浸提液浓度为0.25 g·L-1时苜蓿POD酶活性达到最大值,表明苜蓿POD酶活性对他感效应较小麦敏感(图5)。苜蓿浸提液浓度为0.1 g·L-1时,受体苜蓿POD酶活性与对照差异不显著 (P>0.05),浓度为 0.25、0.5 和 1 g·L-1时,POD酶活性随苜蓿浸提液浓度的增大而减弱,分别低于对照9.01%、15.5%和25.09%;苜蓿浸提液浓度为 0.1、0.25和 0.5 g·L-1时,受体小麦 POD 酶活性随苜蓿浸提液浓度增大而随之增强,分别高于对照 4.27%、11.71%和 16.63%(P<0.05),浓度为1 g·L-1时,POD 酶活性受抑,低于对照 14.38%。小麦浸提液浓度为0.1 g·L-1时,受体小麦POD酶活性与对照差异不显著(P>0.05),浓度为0.25、0.5和 1 g·L-1时,POD酶活性随小麦浸提液浓度的增大而减弱,分别低于对照8.06%、21.83%和29.34%;小麦浸提液浓度为 0.1 g·L-1、0.25 g·L-1和0.5 g·L-1时,受体苜蓿 POD酶活性较对照高出6.64%、16.85%和8.48%,小麦浸提液浓度为1 g·L-1时,受体苜蓿的POD酶活性减弱,低于对照21.97%。
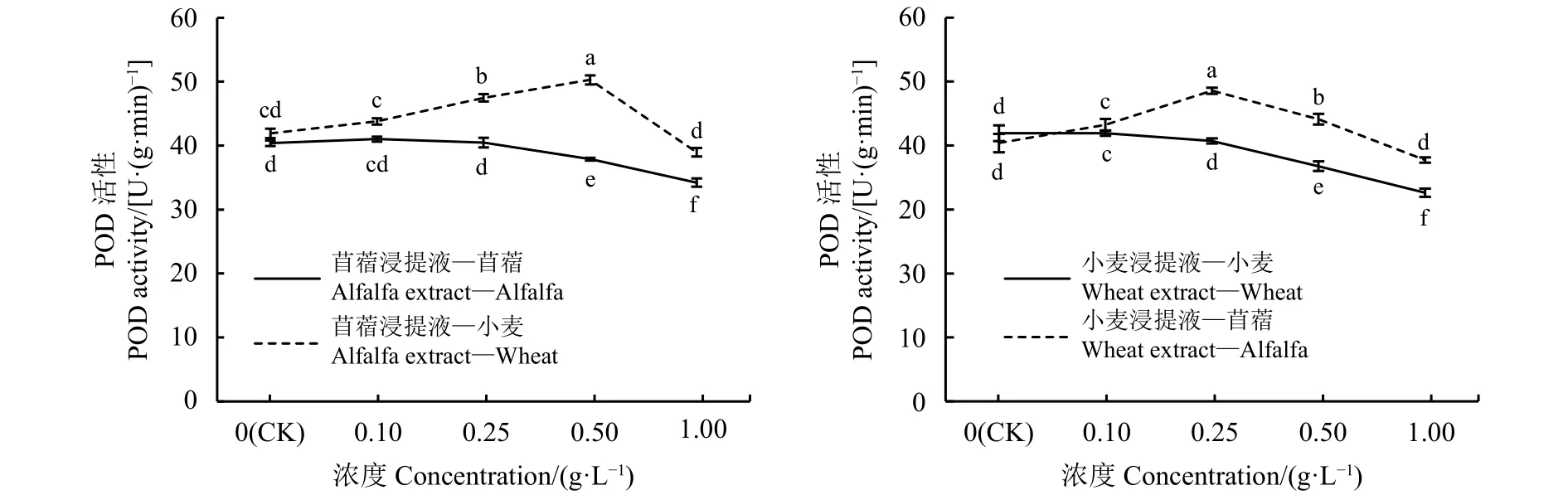
图 5 浸提液浓度处理的苜蓿、小麦POD活性Figure 5 Peroxidase (POD) activity of alfalfa and wheat treated with different concentrations of leaching solution.
CAT酶可促使H2O2分解为分子氧和水,清除体内的过氧化氢,从而使细胞免于遭受H2O2的毒害,是生物防御体系的关键酶之一,其活性大小代表了植物的代谢强度。苜蓿、小麦CAT酶活性在自毒效应影响下,均随浸提液浓度增大而下降,但受体苜蓿CAT酶活性降低更明显;苜蓿、小麦他感作用中,随浸提液浓度增大CAT酶活性呈先上升后下降趋势(图6)。苜蓿浸提液浓度为0.1、0.25 g·L-1,受体苜蓿的 CAT 酶活性与对照差异不显著 (P>0.05),浓度为 0.5、1 g·L-1时,受体苜蓿CAT酶活性分别低于对照12.13%和26.89%;苜蓿浸提液浓度为 0.1、0.25 和 0.5 g·L-1时,受体小麦CAT酶活性增强,分别显著高于对照14.88%、39.49% 和 35.72%(P< 0.05), 浓 度 为 1 g·L-1时 ,CAT酶活性减弱,低于对照7.14%。小麦浸提液浓度为0.1、0.25g·L-1,受体小麦CAT酶活性与对照差异不明显 (P>0.05),小麦浸提液浓度为 0.5、1 g·L-1时受体小麦的CAT酶活性受抑,分别低于对照9.08%、32.26%;小麦浸提液浓度为0.1、0.25、0.5 g·L-1时,受体苜蓿的CAT酶活性分别显著高于对照 19.30%、40.71% 和 37.82%(P<0.05),浓度为1 g·L-1时,受体苜蓿CAT酶活性减弱,低于对照22.65%。
图 6 浸提液浓度处理的苜蓿、小麦CAT活性Figure 6 Catalase (CAT) activity of alfalfa and wheat treated with different concentrations of leaching solution
2.3.2 浸提液对苜蓿和小麦MDA、H2O2含量和相对膜透性的影响
MDA的含量是反映膜质过氧化程度的重要依据。自毒效应导致MDA含量呈上升趋势,他感效应使MDA含量呈先减后增趋势(图7)。苜蓿浸提液浓度为0.1 g·L-1时,受体苜蓿的MDA含量与对照差异不显著 (P<0.05),浓度为 0.25、0.5 和 1 g·L-1时,受体苜蓿MDA含量较对照高出 18.42%、24.39%和 48.33%(P>0.05);苜蓿浸提液浓度为 0.1、0.25和0.5 g·L-1时,受体小麦MDA含量随着苜蓿浸提液浓度的增大而减少,显著低于对照 28.85%、44.23% 和 50.00%(P<0.05),浓度为 1 g·L-1时,小麦MDA含量较对照高出3.85%。小麦浸提液浓度为0.1 g·L-1时,受体小麦的MDA含量与对照间无显著差异 (P<0.05),浓度为 0.25、0.5 和 1 g·L-1时,受体小麦MDA含量分别较对照高出7.14%、14.75%和 26.76%,且差异显著 (P>0.05);小麦浸提液在浓度为 0.1、0.25 和 0.5 g·L-1时,受体苜蓿的MDA含量分别低于对照3.2%、32.26%和12.9%,浓度为1 g·L-1时 ,受体苜蓿MDA含量增加,较对照高出27.91%。
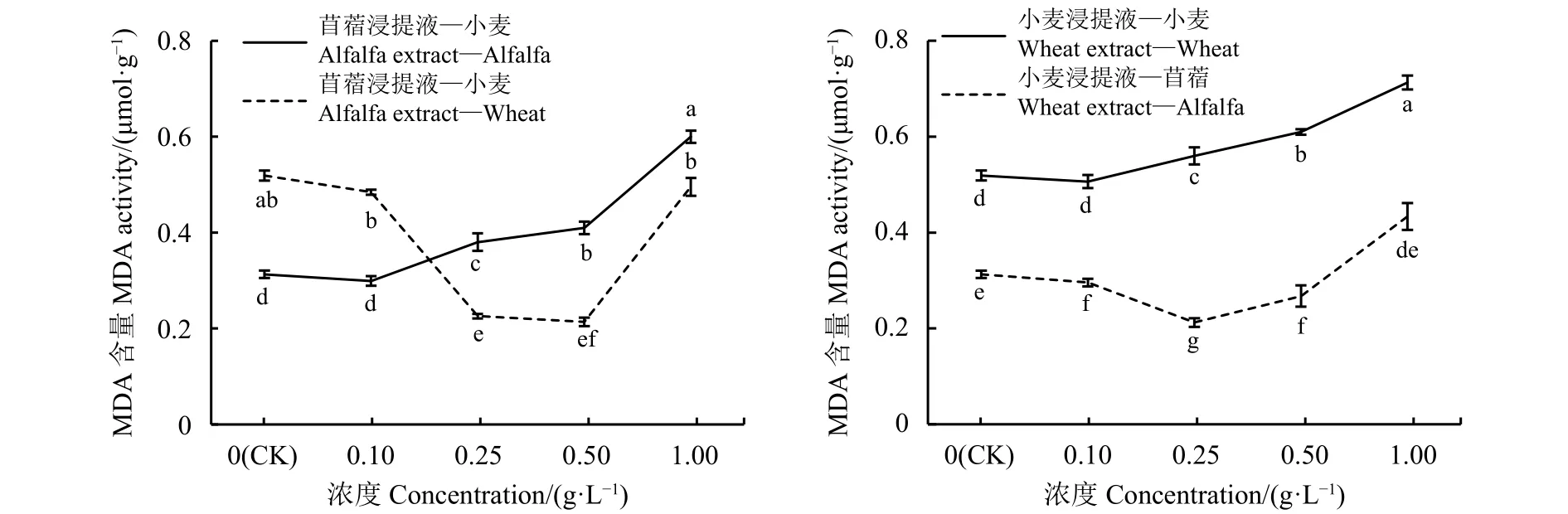
图 7 浸提液浓度处理的苜蓿、小麦MDA含量Figure 7 Malondialdehyde (MDA) content of alfalfa and wheat treated with different concentrations of leaching solution
H2O2具有较强的氧化性,如果其含量打破平衡并有效积累,则会造成细胞内大分子氧化损伤。苜蓿、小麦的自毒效应使H2O2含量呈上升趋势,并且浸提液浓度大于0.5 g·L-1之后急剧增加;他感效应使H2O2含量呈先降低后上升趋势(图8)。苜蓿浸提液浓度为0.1 g·L-1时,受体苜蓿的H2O2含量与对照无显著差异 (P<0.05),浓度为 0.25、0.5和1 g·L-1时,受体苜蓿 H2O2含量随浓度的增大而增加,分别高于对照3.62%、7.67%和31.36%;苜蓿浸提液浓度为 0.1、0.25 和 0.5 g·L-1时,受体小麦H2O2含量显著低于对照8.16%、44.67%和17.73%(P<0.05),浓度为 1 g·L-1时,小麦 H2O2含量增加,较对照高出17.25%。小麦浸提液浓度为0.1 g·L-1时,受体小麦的H2O2含量与对照差异不显著 (P<0.05),浓度为 0.25、0.5 和 1 g·L-1时,受体小麦H2O2含量分别高于对照4.23%、12.79%和30.43%;小麦浸提液浓度为 0.1、0.25 和 0.5 g·L-1时,苜蓿的H2O2含量显著低于对照 18.95%、48.97%和 21.74%(P<0.05),浓度为 1 g·L-1时,苜蓿 H2O2含量较对照高出22.64%。
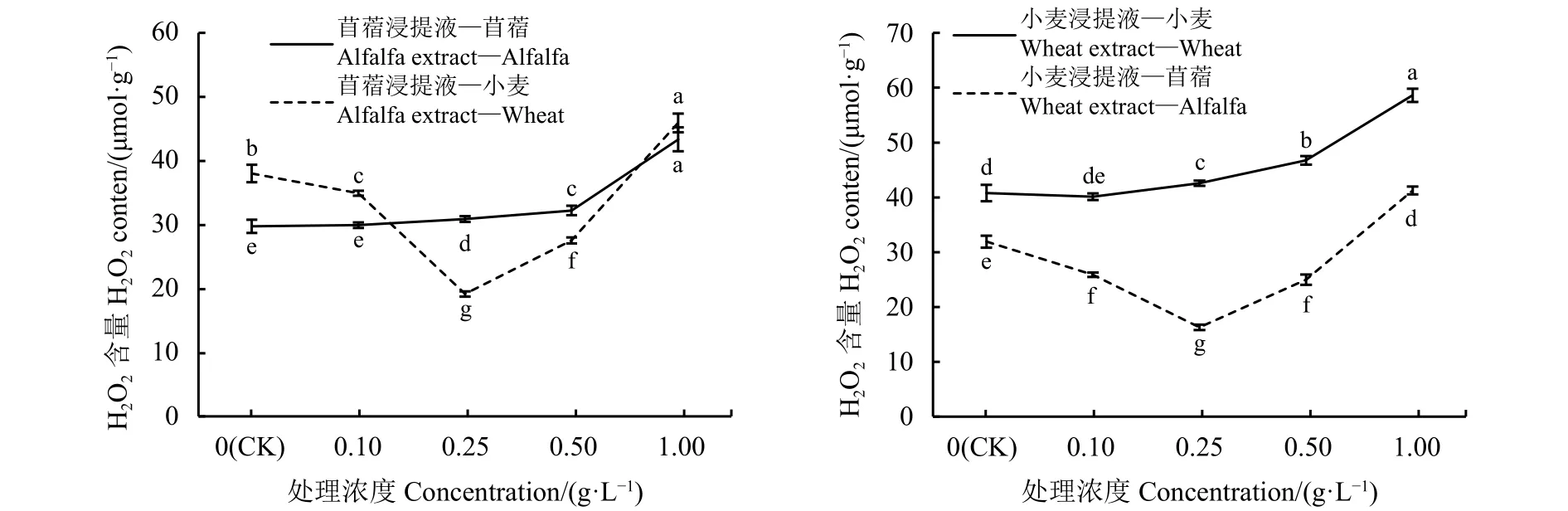
图 8 浸提液浓度处理的苜蓿、小麦H2O2含量Figure 8 Hydrogen peroxide (H2O2) content of alfalfa and wheat treated with different concentrations of leaching solution
相对膜透性的大小与植物抗逆性的强弱有关。苜蓿、小麦的自毒效应对相对膜透性的影响趋势一致,随浸提液浓度增加而增大;他感效应对相对膜透性的影响趋势也大体一致,呈先减少后增加趋势(图9)。苜蓿浸提液浓度为 0.1 g·L-1时,受体苜蓿的相对膜透性与对照无显著差异(P<0.05), 浓度为0.25、0.5和1 g·L-1时,受体苜蓿的相对膜透性分别较对照高出8.30%、12.85%和24.76%;苜蓿浸提液浓度为 0.1、0.25 和 0.5 g·L-1时,受体小麦的相对膜透性分别低于对照8.79%、15.33%和4.92%,浓度为1 g·L-1时,相对膜透性显著高于对照 22.69%(P<0.05)。小麦浸提液浓度为 0.1 g·L-1时,受体小麦相对膜透性与对照无显著差异(P<0.05),小麦浸提液浓度为 0.25、0.5 和 1 g·L-1时,受体小麦的相对膜透性分别较对照高出12%、16.88%和29.05%;小麦浸提液浓度为0.1、0.25和0.5 g·L-1时,受体苜蓿的相对膜透性分别低于对照11.10%、25.44% 和 12.75%,浓度为 1 g·L-1时,苜蓿的相对膜透性高于对照9.18%。
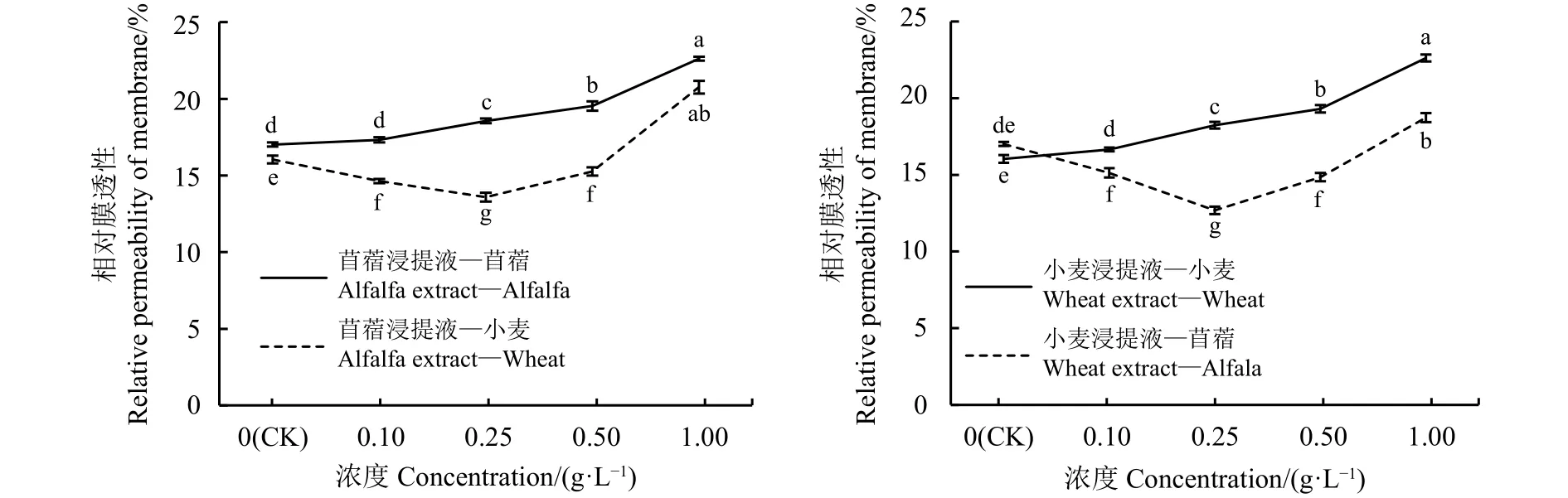
图 9 浸提液浓度处理的苜蓿、小麦相对膜透性Figure 9 Relative membrane permeability of alfalfa and wheat treated with different concentrations of leaching solution
3 讨论与结论
Rice[23]认为,他感作用是指由植物或微生物释放到环境中的化学物质而对其他植物或微生物的生长发育所产生的有利或不利的作用,他涵盖了各种植物之间、微生物之间生化相生及相克作用。自毒作用是植物种内相互影响的方式之一,是一种特殊的生存竞争[24],当自毒物质积累到一定程度并超过某一临界浓度以后会产生自毒效应,抑制了体内某些重要酶的活性,从而使膜质受到过多自由基的伤害,损伤了体内的膜系统,导致各项生理代谢受阻,抑制生长[25]。有研究发现刀豆氨酸(canavanine)具有自毒效应,但含量低于1%,自毒效应不严重,当含量高于1%时,自毒效应明显。说明自毒物质具有“高抑低促”的浓度效应[26]。植物在正常生长条件下体内活性氧的产生和消除处于动态平衡中,自由基浓度较低,不会引起植物伤害[27],但在逆境下会产生活性氧的积累,加剧膜脂的过氧化而导致膜系统受损,影响细胞功能[28]。SOD、CAT和POD酶组成有效清除活性氧自由基的抗氧化酶系统,维持体内的活性氧代谢平衡,保护膜结构[29]。本研究结果显示,苜蓿浸提液抑制受体苜蓿的整体生长,并且随着浸提液浓度增大,抑制作用增强。小麦浸提液对受体小麦的自毒效应与苜蓿浸提液对受体苜蓿的自毒效应类同。说明浸提液浓度是自毒效应强弱的重要依据,浸提液通过降低酶活性,影响细胞膜的透性,促进过氧化物含量增多,产生毒害作用[30-31]。
苜蓿和小麦浸提液异种间处理,浓度为0.1、0.25和 0.5 g·L-1时,SOD、POD、CAT 酶活性增强,MDA、H2O2含量和相对膜透性减少,保护酶类活性增强可以有效清除活性氧并将其维持在降低的水平,保护细胞不受伤害,从而对种子萌发和幼苗生长有促进作用,浓度为1 g·L-1时,SOD、POD、CAT酶活性开始减弱,MDA、H2O2含量和相对膜透性增加积累,活性氧得不到有效清除,从而导致种子萌发和幼苗生长受到抑制。有研究表明苜蓿植株浸提液对苜蓿有“高抑低促”的浓度效应,在达到某“阈值”浓度时表现出自毒作用,超过此阈值越大,自毒效应越显著[32]。有研究发现,苜蓿-小麦轮作能够显著提高小麦的籽粒产量,与小麦-小麦连作比较,小麦籽粒产量增加[14],本研究结果显示,当苜蓿和小麦浸提液浓度在0.1、0.25和0.5 g·L-1时,能够有效缓解小麦和苜蓿的自毒效应,且浸提液浓度为0.25 g·L-1时达到最佳,并且小麦浸提液对苜蓿的他感促进作用较苜蓿浸提液对小麦的他感促进作用强烈。
植物在逆境环境中,体内活性氧代谢平衡会被打破,过氧化物质大量产生并积累,导致膜系统损伤和细胞氧化,并大量积累过氧化产物MDA,从而引起植物的氧化伤害。幼苗浸提液是一种混合液,其可能包含多种单个物质或混合物质,自毒作用和他感作用都具有两面性,而浸提液的浓度往往是促进或抑制受体生长的综合因素。自毒作用和他感作用的机理是复杂多样的,还需要更广泛、深层次的研究去继续探明其发生的反应和次生变化,为粮草合理轮作及开发利用提供有力的理论依据。

