淋球菌体外感染单个核细胞对IL-1β、NLRP3表达的影响
陈剑云 张 方 阳慧芝 陈嵘祎
淋病奈瑟菌(简称淋球菌)是一种革兰阴性双球菌,人类是唯一自然宿主。其主要侵犯泌尿生殖黏膜,引起宫颈、宫腔、尿道、输卵管及盆腔感染,但女性患者大多表现为无症状,除了延误治疗引发不孕等严重后遗症,更会加速淋病蔓延甚至促进HIV感染。淋球菌感染的活菌数量是影响实验效果的关键指标,添加经过定量的活菌有利于实验效果的评估及提高实验的可重复性,并有利于炎症因子表达实验条件的优化。然而淋球菌感染实验如何定量,淋球菌体外感染单核细胞对炎症因子的影响,特别是IL-1β、NLRP3(核苷酸结合寡聚化结构域样受体蛋白3)表达的研究目前国内未见报道。本文通过研究淋球菌定量方法以及不同浓度淋球菌感染单个核细胞对IL-1β、NLRP3表达的影响,为淋球菌感染致病机制研究及该病的防治提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验菌株、C57/BL6J小鼠 淋球菌菌株,购于上海宜醇化工有限公司(菌种编号19424),C57/BL6J小鼠,购于广东省医学动物中心。
1.1.2 主要仪器与试剂 SW-CJ-2FD型超净工作台(苏净集团苏州安泰空气技术有限公司),酶标仪、CO2培养箱(美国Thermo SCIENTIFIC公司),高速低温台式离心机(美国Thermo公司)、VininTM7 Dx Real-Time PCR仪(Life)、倒置显微镜(CKX41,OLYMPUS)、分光光度计(德国Eppendorf公司);小鼠单个核细胞分离液(LTS1092PK-200,天津市灏洋生物制品科技有限责任公司)、淋球菌选择培养基(15098,江门凯林公司)、澳洲源胎牛血清(10099-141,Gibco公司)、RPMI 1640完全培养基(C11875500BT,Gibco公司)、PBS, pH 7.2(20012-043,Gibco公司)、Trizol、qRT-PCR试剂盒(日本TaKaRa)、SYBR® Premix ExTaqTMII(Tli RNaseH Plus)(RR820A,Takala公司)。
1.2 方法
1.2.1 菌液OD值测定 将淋球菌接种于淋球菌选择培养基,置于37℃、5% CO2培养箱中培养24小时,用接种环挑取单个菌落于含10%胎牛血清的1640培养液中制成细菌悬液。以未加菌的培养液为空白对照液调零,波长450 nm测量OD值,选取OD值在0.6~1.0之间的菌液进行1∶1.0、1∶1.2、1∶1.4、1∶1.6、1∶1.8、1∶2.0梯度稀释,并测量其OD450值。
1.2.2 菌落平板计数 将各组菌液进行10、102、……10n倍比稀释,吸取1 mL稀释后的菌液均匀涂布于固体培养基上,置于37℃、5% CO2培养箱中培养24小时。选取培养基上菌落数为30~300 CEU/mL为最佳稀释倍数10n,准确计数培养基上菌落数,再乘以稀释倍数10n,为1 mL菌液中的活菌数(CEU/mL),即菌液中淋球菌活菌的浓度。
1.2.3 回归方程计算 以菌落数为y值,菌液OD450值为x值,计算相关回归方程。
1.2.4 小鼠脾脏单个核细胞获取 于超净工作台中无菌操作取出C57/BL6J小鼠脾脏,以PBS漂洗2次后,以磨砂玻片轻轻研磨,用细胞筛过滤获得细胞悬液4 mL。将细胞悬液移至已盛有单个核细胞分离液的滤液离心管中,细胞悬液与单个核细胞分离液体积之比为1∶4,以500×g离心30 mim,分四层,取上数第二层,即单个核细胞层。加入适量PBS液漂洗1次,加入红细胞裂解液2 mL,吹打混匀2 min,再加入PBS漂洗1次即可获得高纯度的单个核细胞。
1.2.5 RT-qPCR检测IL-β、NLRP3基因表达 将OD450值为0.2、0.6、1.0、1.4的淋球菌菌液与单个核细胞置于含10%胎牛血清的1640培养基中共培养6 h,为感染组;设置不加淋球菌的空白对照组计OD450值为0。培养结束后,采用梯度离心去除淋球菌,收集单个核细胞。采用Trizol法提取细胞总RNA,采用随机引物法反转录为cDNA,以SYBY Green核酸染料为荧光探针,用Real-time PCR检测细胞IL-1β的表达。以GAPDH基因为内参照,引物由生工生物工程(上海)股份有限公司设计,PCR反应条件:94℃预变性2 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min,40个循环检测荧光信号。每个样品均设置3个复管,重复试验三次。分别测定对照组和试验组目的基因与内参基因的Ct值,实验结果取其均值,按照2-△△Ct相对定量公式计算实验组相对于空白组的各基因mRNA转录水平,其中△△Ct=(实验组目的基因平均Ct值-实验组内参基因平均Ct值)-(对照组目的基因平均Ct值-对照组内参基因平均Ct值)。
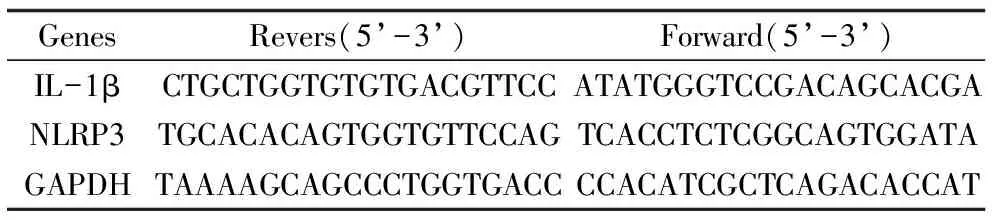
表1 引物序列

2 结果
2.1 建立淋球菌OD450值(x)——菌落数(y)回归方程 经过计数培养基上菌落数目,选择最佳稀释倍数为106,计数此稀释倍数下不同OD值菌液接种于固体培养上的菌落数,计算OD值与菌落数的回归方程。见表2。

表2 淋球菌菌落平板计数
2.2 不同浓度淋球菌感染单个核细胞对IL-1β、NLRP3表达的影响 实时荧光定量PCR显示,目的基因与内参基因的熔解曲线峰均为单一峰且峰形锐利,未见其他峰值。扩增曲线均光滑平稳,荧光吸收图谱的S形曲线图形状完整,符合定量检测要求。相对定量分析显示,将菌液OD450值为0的空白对照组IL-1β基因表达量设为1,则感染组IL-1β基因相对表达量随淋球菌浓度升高出现先升高后下降的趋势,感染6 h菌液OD值为0.6的实验组IL-1β基因相对表达量最高,而感染6 h菌液OD值为1.0的实验组NLRP3基因相对表达量最高(图1)。
3 讨论
淋球菌LOS(脂寡糖)与DC(树突状细胞)的TLR4受体结合经MAPKs、NF-кB、IRF3信号传导通路激活固有免疫,诱导IL-1β、IL-6、TNFα产生;接着DC启动适应性免疫分泌IL-23、前列腺素(PGE2)上调CD4+T趋化因子受体,促进RORγt表达来使T细胞分化为Th17细胞;最终分泌大量IL-17A、IL-17F并引起中性粒细胞趋化至病灶吞噬淋球菌,促使活性氧(ROS)产生及iNOS(诱导型一氧化氮合酶)合成NO,诱导抗菌肽释放,以清除淋球菌[1-4]。我们既往研究发现雌二醇可下调淋球菌感染诱导的人HeLa中il-6、il-8、nlrp3 mRNA等趋化因子、促炎因子的表达起到抑制黏膜免疫及使单核细胞无法趋化至病灶来杀灭淋球菌,促进其感染的作用[5]。因为不同浓度的淋球菌活菌刺激单核细胞可引起各种炎症因子的表达出现各异,摸索合适的淋球菌定量感染条件不仅能使炎症因子表达更稳定,更有利于淋球菌对宿主感染免疫影响的研究,还有利于提高实验的重复性。因此我们使用了不同浓度淋球菌体外感染单核细胞对IL-1β、NLRP3表达影响进行了相关研究。
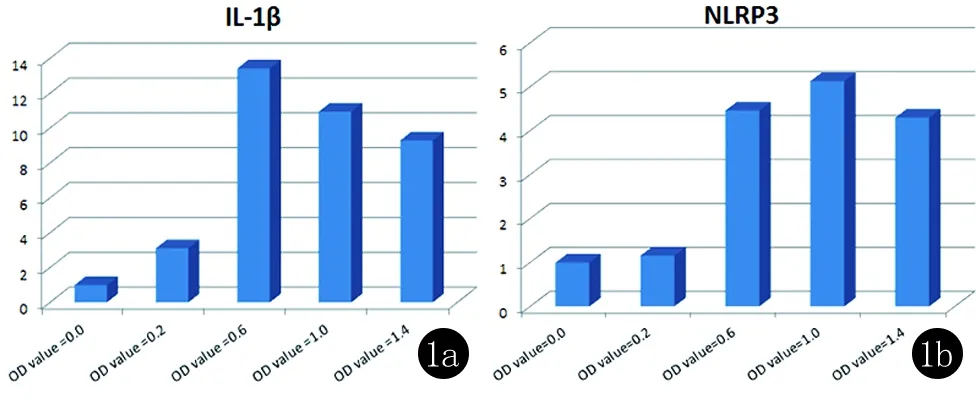
1a:感染6 h后IL-1βmRNA的表达;1b:感染6 h后NLRP3 mRNA的表达
图1 PCR结果
淋球菌有黏附宿主黏膜的特性,感染人类泌尿生殖道主要表现为局部黏膜反应,大部分为固有免疫反应[2]。固有免疫包括4种模式识别受体,其中的NOD样受体(NOD like receptor, NLRs)能识别淋球菌表面糖蛋白,激活下游分子进而活化NF-κB和MAPK通路以及参与炎性小体的组成与活化诱导机体产生多种细胞因子如IL-1、TNF等[6-8]。NLRP蛋白家族作为NLRs家族中最大的一个亚族,分布广泛,典型代表NLRP3受到相应刺激后,在胞内组装成炎性小体,通过街头蛋白ASC募集促Caspase酶快速转化为活性的蛋白酶,导致促炎因子IL-1释放以及细胞死亡[9]。国外有研究证实淋球菌可通过组织蛋白酶B蛋白水解酶激活NLRP3炎症复合物/ASC/Caspase-1轴来促进IL-1β分泌[10]。与上述研究相一致的是本实验通过检测被不同浓度淋球菌感染的单个核细胞中IL-1β、NLRP3的表达,发现淋球菌感染单核细胞后均可导致IL-1β、NLRP3 mRNA表达增高,且在菌液OD450值分别为0.6、1.0刺激单个核细胞6小时后IL-1β、NLRP3基因相对表达量较高。表明本研究感染实验成功,为日后淋球菌体外感染单个核细胞提供了重要的实验参考数据。
虽然我们研究表明淋球菌感染可明显上调NLRP3并促进单核细胞产生IL-1β,但NLRP3是否是单核细胞抵抗淋球菌主要受体?Toll样受体与NOD样受体在淋球菌感染中何种受体起的作用大?上述问题仍有待进一步研究。

