基于密码子优化策略的斑马鱼FOXP3A分子的原核表达及多克隆抗血清制备
陈芳,王兰,张左兵
山西大学 生命科学学院,山西 太原030006
叉头框(forkhead box,FOX)家族是一个由具有保守的叉头状螺旋(forkhead,FKH)DNA结合域蛋白组成的转录因子家族[1]。FOXP3是目前在免疫调控领域研究最为热门的FOX家族成员。在哺乳动物中,调节性T细胞(regulatory T cells,Treg细胞)的发育和功能由编码FOXP3蛋白的基因控制,大量研究表明,foxp3是Treg细胞发生、发育及发挥生物学活性的关键分子,在诱导和维持免疫耐受及免疫抑制功能中具有决定性作用[2-4]。foxp3缺陷型小鼠模型发展为一种致死性自身免疫综合征,其特征在于外周T细胞增殖增加,大量炎症细胞浸润在多个器官中,并引起炎症细胞因子的大量增加,导致在出生后1个月内死亡[5-6]。其中一种Scurfy小鼠模型,因在foxp3基因中自发产生的移码突变,导致编码的蛋白质缺乏C端叉头结构域[5]。这些发现表明了FOXP3在免疫抑制功能中的关键作用。人类罕见的自身免疫性疾病免疫调节异常、多发性内分泌疾病和肠病、X-联(IPEX)综合征[5]患者中foxp3基因发生突变,可见FOXP3在预防自身免疫性疾病中的重要作用,但FOXP3在非哺乳动物脊椎动物免疫耐受性的控制中的研究尚不够深入。近年来,已相继从不同硬骨鱼类分离克隆了foxp3的cDNA序列[7-11],其中包括斑马鱼foxp3的cDNA序列[12-13]。由于斑马鱼在演化过程中出现了染色体加倍事件,因此斑马鱼基因组数据显示其有2个foxp3同源基因,即foxp3a和foxp3b[12-13]。Jia等制备了尼罗罗非鱼FOXP3蛋白,并研究发现尼罗罗非鱼FOXP3蛋白细胞表达模式相对保守,且主要定位于淋巴样细胞,如外周血单个核细胞(PBMC)、胸腺、脾、头肾、肾、肠、鳃等,在PBMC中主要定位于一些(不是所有)淋巴细胞的细胞核[14]。斑马鱼foxp3a基因在斑马鱼胸腺和肾脏中高表达,但FOXP3A蛋白表达模式及其功能有待于进一步研究。本研究中,我们选择在胸腺和肾脏中富集程度较高的FOXP3A制备多克隆抗体[12]。在早期克隆得到的斑马鱼foxp3a基因cDNA序列基础上,构建pET-32a-s-foxp3a原核表达系统,对斑马鱼foxp3a密码子进行优化,融合表达重组蛋白,并制备了兔源多克隆抗体,为斑马鱼FOXP3蛋白生物学功能的研究提供了手段,为深入研究斑马鱼免疫耐受性的控制机制奠定了基础。
1 材料与方法
1.1 材料
健康家兔购自太原科鑫畜牧养殖场。斑马鱼成鱼(AB系)饲养于本实验室斑马鱼养殖水循环系统中,每日喂食2次,养殖系统为上海海圣斑马鱼养殖系统,水循环系统温度维持在(28±0.5)℃,按14 h/10 h昼夜节律条件饲养。
克隆宿主大肠杆菌DH5α、表达宿主大肠杆菌Trans BL21(DE3)购于北京全式金生物技术有限公司;pET-32a为本实验室保存;pMD19-T(Sim⁃ple)载体和T4DNA连接酶购于TaKaRa公司;2×Easy-TaqDNA聚合酶购于康为世纪生物科技有限公司;限制性内切酶BamHⅠ和XhoⅠ购于NEB有限公司(北京);Ni-NTA His-Bind Resin购于Novagen公司;彩色预染蛋白分子量标准、质粒抽提试剂盒、胶回收试剂盒、96孔板及EL-TMB显色试剂盒购于生工生物工程股份有限公司(上海);SDS-PAGE组 分Tris-HCl(pH8.8、pH6.8)、30%丙烯酰胺购于北京索莱宝科技有限公司;弗氏完全佐剂和弗氏不完全佐剂购于Sigma公司;羊抗兔IgG-HRP购于碧云天生物技术有限公司。
1.2 foxp3a表达序列扩增
以本实验室RACE扩增得到的斑马鱼foxp3a基因序列为模板,用Primer 5.0软件设计特异性引物(表1),并扩增foxp3a基因序列,引物的5'端和3'端分别加入BamHⅠ和XhoⅠ酶切位点(下划线标出)。PCR反应条件:94℃预变性4 min;94℃30 s,64℃30 s,72℃1 min,共35个循环;72℃终延伸7 min;琼脂糖凝胶电泳检测。将目的片段与pMD19-T载体连接,转化大肠杆菌DH5α,挑取单克隆进行菌液PCR,琼脂糖凝胶电泳检测,将含目的条带的菌液送生工公司测序。
1.3 foxp3a表达序列优化
根据大肠杆菌稀有密码子选择需要进行优化的位点3个,分别记为1、2、3号突变位点。这3个突变位点将目的基因片段分成4个区域,即1~4号区域,并且设计突变引物。将测序正确的菌液扩大培养,提取质粒。以所提质粒为模板,通过桥连PCR技术,先分别用对应的引物扩增1~4号区域。第1轮PCR反应体系(50μL)包括2×EsTaqMasterMix 25μL,ddH2O 22μL,正、反向引物各1μL,模板1μL。反应程序:94℃预热2 min;5个循环[94℃30 s,68℃(退火做touch⁃down-1℃/循环)30 s,72℃30 s];30个循环(94℃30 s,66℃30 s,72℃30 s);72℃延伸7 min;16℃保温。反应结束后,用2%琼脂糖凝胶电泳检测,胶回收目的条带。再以第1轮扩增后得到的1号、2号区域混合物为模板,以1号区域的正向引物及2号区域的反向引物进行第2轮扩增;同时以第1轮扩增后得到的3号、4号区域混合物为模板,以3号区域的正向引物及4号区域的反向引物进行第2轮扩增。
第2轮PCR反应体系(50μL)包括2×EsTaqMasterMix 25μL,ddH2O 21μL,正、反向引物各1μL,模板[1(3)号区域]1μL,模板[2(4)号区域]1μL。反应 程序:94℃2 min;5个循环[94℃30 s,68℃(退火做touchdown-1℃/循环)30 s,72℃40 s];30个循环(94℃30 s,66℃30 s,72℃40 s);72℃延伸7 min;16℃保温。反应结束后,用1.5%琼脂糖凝胶电泳检测,胶回收目的条带;最后用带有酶切位点的特异性引物扩增目的基因。
第3轮PCR反应体系(50μL)包括2×EsTaqMasterMix 25μL,ddH2O 21μL,正、反向引物各1μL,模板(1~2号区域)1μL,模板(3~4号区域)1μL。反应 程序:94℃2 min;5个循环[94℃30 s,68℃(退火做touchdown-1℃/循环)30 s,72℃1 min];30个循环(94℃30 s,66℃30 s,72℃1 min);72℃延伸7 min;16℃保温。反应结束后,用1%琼脂糖凝胶电泳检测,胶回收目的条带。
1.4 foxp3a原核表达载体的构建
回收PCR产物,将目的基因片段与pET-32a载体分别用BamHⅠ和XhoⅠ双酶切(37℃,过夜),琼脂糖凝胶电泳检测并切胶回收目的片段,用T4DNA连接酶于4℃过夜连接后转化大肠杆菌DH5α,挑选阳性克隆,送生工公司测序验证。构建成斑马鱼foxp3a原核表达载体pET32a-sfoxp3a。
1.5 诱导pET-32a-foxp3a的原核表达
将重组载体pET-32a-s-foxp3a转入大肠杆菌BL21(DE3),涂于含氨苄青霉素(1 mg/mL)的平板,挑取单克隆于5 mL LB培养液中,200 r/min、37℃振荡培养至D600nm为1.0时,加入IPTG至终浓度为0.5 mmol/L,150 r/min、16℃诱导表达10 h,离心收集菌体,1×PBS缓冲溶液重悬菌体,在冰浴条件下超声波破碎(超声时间2 s,间歇时间3 s,总时间2 h),10 000 r/min离心收集上清和沉淀,同时以诱导前菌液以及空载体菌液超声波破碎离心所得上清和沉淀作为对照,行10% SDSPAGE,经考马斯亮蓝R250染色90 min,常温过夜脱色,鉴定蛋白的表达。
1.6 包涵体融合蛋白的纯化、多克隆抗体的制备及效价测定
超声波破碎离心后的沉淀即为包涵体。每次用20 mL包涵体洗涤液(1% Triton X-100,5 mmol/L DTT,50 mmol/L NaCl,50 mmol/L Tris-HCl)将包涵体清洗3次,4℃离心,弃上清,用20 mL包涵体溶解液(20 mmol/L Tris-HCl,100 mmol/L NaCl,8 mol/L尿素,5%甘油)重悬沉淀,4℃静置过夜溶解包涵体蛋白,12 000 r/min、4℃离心,取上清过0.45μm滤膜,用Ni-NTA His-Bind亲和层析柱纯化斑马鱼FOXP3A融合蛋白,选用10、20、50、100、250 mmol/L咪唑浓度洗脱,收集蛋白,SDS-PAGE检测。将纯化的蛋白按500μg(1 mL)与1 mL弗氏完全佐剂混合乳化,乳化液对2只健康家兔(雌、雄各1只)于背部皮下多点注射进行基础免疫,14 d后用上述蛋白500μg(1 mL)与1 mL弗氏不完全佐剂乳化,对雌、雄2只家兔进行首次加强免疫,加强免疫共3次,间隔为7 d,最后一次加强免疫3 d后心脏取血并分离抗血清,分装,-80℃保存。

表1 表达序列扩增及基因优化PCR引物列表
1.7抗斑马鱼S-FOXP3A-His多克隆抗血清效价测定
用间接ELISA法测定抗斑马鱼S-FOXP3AHis融合蛋白效价。将S-FOXP3A-His融合蛋白用包被液(2.94 g NaHCO3和1.59 g Na2CO3用双蒸水定容至500μL,调节pH9.6,高压蒸汽灭菌)稀释至1μg/mL,100μL/孔包被酶标板,4℃过夜,弃去包被液,经PBST洗涤、封闭缓冲液(10%小牛血清/PBS)封闭,再次洗涤后加入待检物(斑马鱼FOXP3A-His多克隆抗体以及用PBS稀释至不同浓度的免疫前血清),100μL/孔,孵育1 h后再次洗涤,加入HRP标记的羊抗兔IgG,100μL/孔,孵育1 h,1%小牛血清/PBS稀释抗体,显色后终止,用酶标仪检测D450nm值。S/N值>2.1时判为阳性(S为测定血清的D450nm值,N为阴性对照血清的D450nm值)。
2 结果
2.1 foxp3a基因优化及原核表达载体的构建
以成年斑马鱼肾脏、脾脏、肝脏、鳃、肠、胸腺及周围组织混合cDNA为模板进行PCR扩增,在foxp3a预期大小894 bp附近有单一的目的条带。将得到的基因序列片段与pMD19-T载体连接,构建了重组克隆载体pMD19-T-simple-foxp3a。用含酶切位点的引物及突变引物进行定点突变,3轮PCR结束后获得与foxp3a预期大小909 bp一致的目的条带(图1A),将得到的基因序列片段与经BamHⅠ、XhoⅠ双酶切后的pET-32a载体连接,构建重组原核表达载体pET-32a-foxp3a。通过BamHⅠ、XhoⅠ双酶切验证,在909 bp附近有单一目的条带(图1B)。送生工公司测序验证,除靶位点有预期突变外,在第540位碱基处有一个同义突变(A突变为G),该突变后的密码子UCG也是大肠杆菌所偏好的丝氨酸对应的密码子。因此,成功构建了密码子优化后的重组原核表达载体pET-32a-s-foxp3a。
2.2 融合蛋白的表达与纯化
通过摸索不同的诱导条件,诱导了FOXP3A融合蛋白的表达。FOXP3A融合蛋白缺失了叉头结构 域FOXP3的N端(S-FOXP3)(图2),SDSPAGE结果显示(图3),重组菌经0.5 mmol/L IPTG诱导后,在包涵体中检测到与预期大小(相对分子质量51.7×103)一致的目的条带,即FOXP3A融合蛋白。在对照实验中,未诱导的重组菌包涵体中未检测到相应大小的FOXP3A。因此,可确定获得了包涵体FOXP3A融合蛋白。进一步用亲和纯化方法,通过梯度咪唑浓度洗脱,对FOXP3A融合蛋白进行分离、纯化。结果显示,250 mmol/mL咪唑浓度洗脱时检测到大量目的蛋白。电泳条带的灰度分析表明,250 mmol/mL咪唑浓度洗脱液洗脱收集的蛋白纯度在80%以上,达到了后续免疫实验的要求。
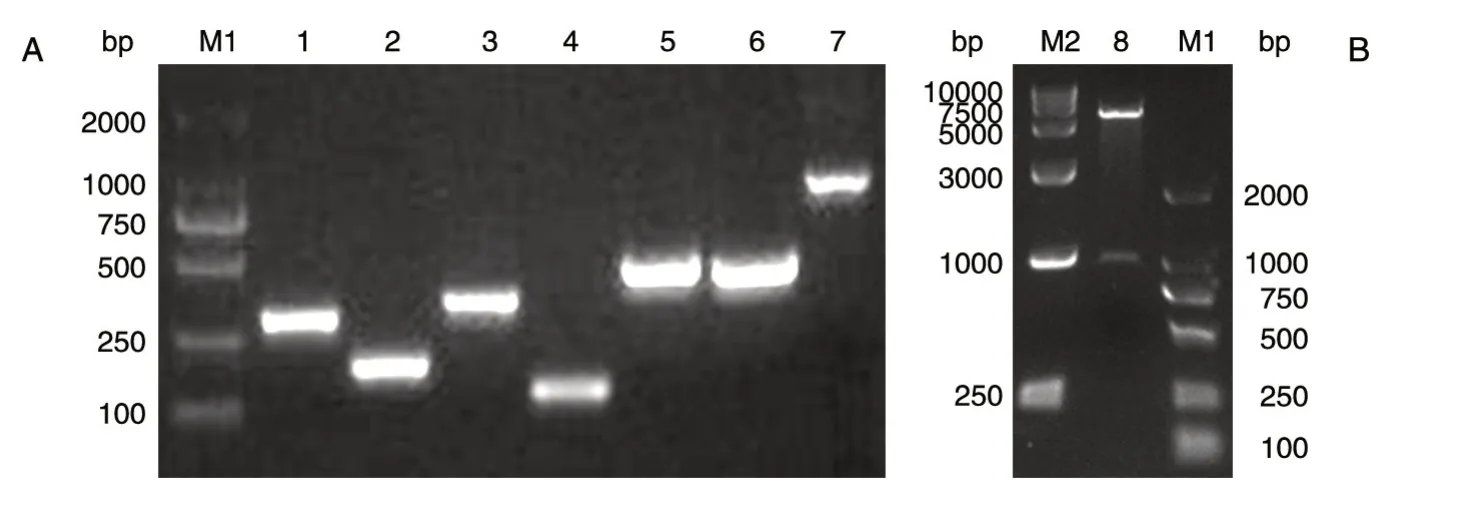
图1 foxp3a密码子优化定点突变PCR扩增及pET-32a-foxp3a重组载体的酶切鉴定
2.3 FOXP3A融合蛋白多克隆抗体的制备
用纯化的FOXP3A融合蛋白免疫家兔,收集血清,制备斑马鱼FOXP3A蛋白的多克隆抗血清,ELISA法测定结果显示雌兔和雄兔抗S-FOXP3AHis的效价均高于1.6×105(图4)。
3 讨论
Treg细胞是抑制自身反应性T细胞的T淋巴细胞的特化细胞亚群。体外功能研究已经证实Treg细胞存在多种抑制机制,而且人类[5]和小鼠Treg细胞缺陷型的研究已经清楚地表明了这些细胞在预防自身免疫中的重要作用。Hori等的研究表明,转录因子FOXP3特异性表达于Treg细胞上,并在该细胞的发育和功能维持中发挥重要作用[15],而且在其他一些鱼类,如河豚[10]、大马哈鱼[11]、尼罗罗非鱼[9]和两栖类[16]中也发现了编码FOXP3直系同源基因,这表明FOXP3也可能在非哺乳动物脊椎动物定义Treg样细胞。斑马鱼基因组数据显示其有2个foxp3同源基因foxp3a和foxp3b,对foxp3的研究大部分处于mRNA水平。本研究制备了斑马鱼FOXP3A多克隆抗体,为在蛋白水平更好地探讨FOXP3A的功能,深入研究转录因子FOXP3A在Treg细胞中的发育和功能提供了基础。
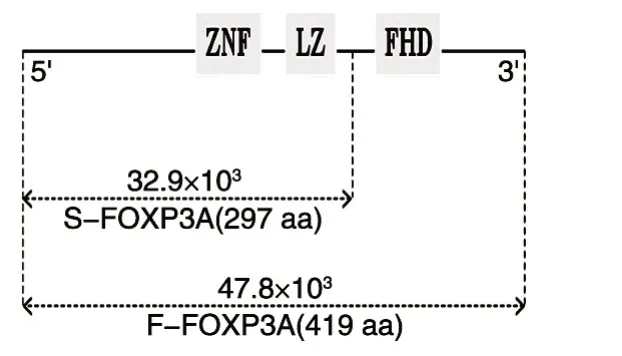
图2 FOXP3A功能结构域图解

图3 FOXP3A融合蛋白的表达及纯化
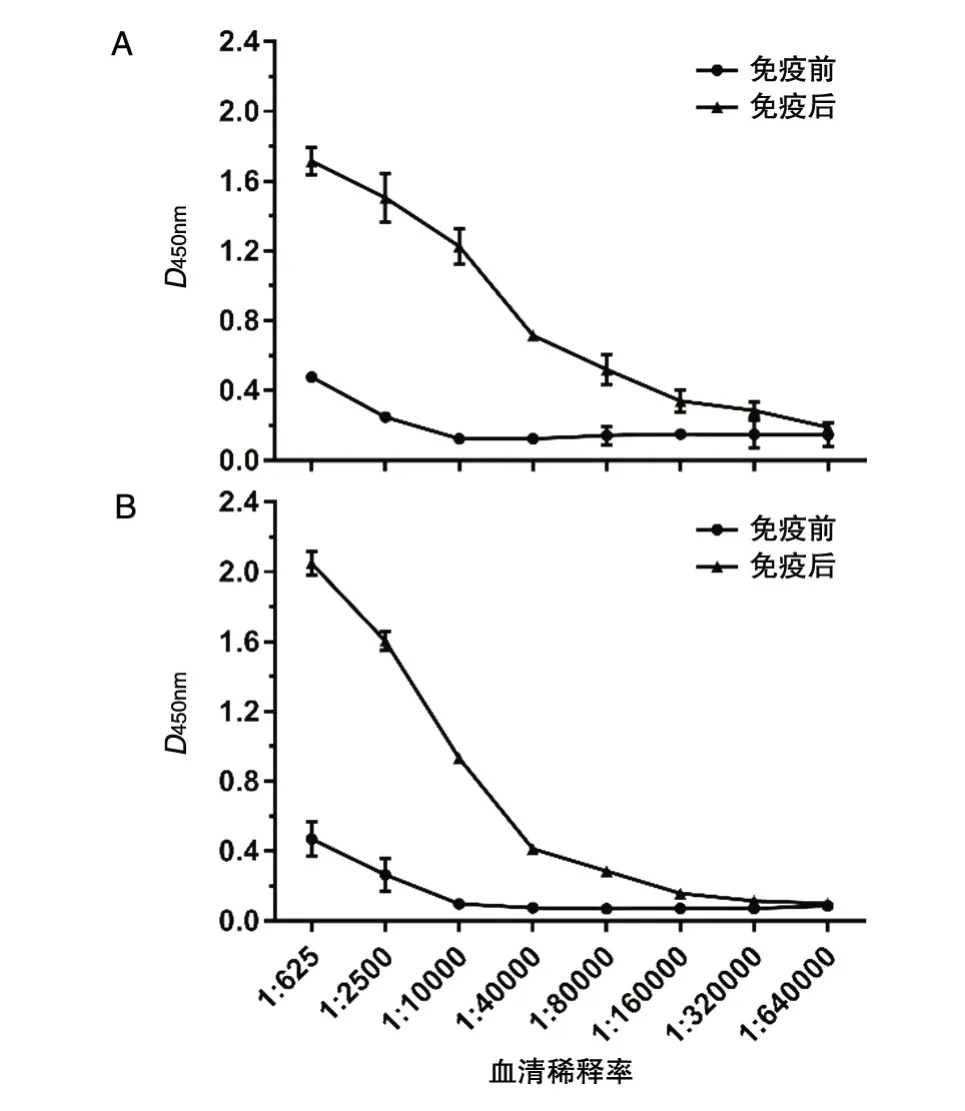
图4 间接ELISA检验抗S-FOXP3A-His血清效价
在斑马鱼FOXP3A蛋白多克隆抗体的制备过程中,首先扩增斑马鱼foxp3a基因开放读框片段,用软件翻译产生氨基酸序列,通过BLAST进行氨基酸多序列比对,比较来自斑马鱼的FOXP3A和FOXP1A、FOXP1B、FOXP2及FOXP4的氨基酸序列,FOXP3A的N端片段显示出对FOXP3A的高度特异性。FOXP家族的特征性叉头结构域C端显示出与其他FOXP家族成员超过80%的相似性。因此,将叉头结构域缺失的FOXP3A的N端片段用作抗原。同时,在分析所选择的这段基因序列时,发现其含有大肠杆菌稀有密码子,在前期预实验中,我们发现若直接采用斑马鱼foxp3a天然核苷酸序列在大肠杆菌中表达,其表达水平较低。故在本研究中,根据大肠杆菌密码子的偏好性,在不改变氨基酸组成的情况下,将斑马鱼foxp3a基因中稀有密码子更换为大肠杆菌宿主使用频率较高的密码子。采用重叠PCR的方式,设计了4对引物,通过3轮PCR,合成了909 bp的目的片段。其次,在表达载体选择上,pET系统是在大肠杆菌中克隆表达融合蛋白最强大的系统之一,本实验选择了其中的原核表达载体pET-32a,T7为启动子,可使目的基因得到高效转录与翻译,同时该载体含有6个连续的组氨酸标记,以蛋白酶缺陷型大肠杆菌BL21(DE3)作为宿主菌进行诱导表达,表达的重组蛋白可利用His标签进行亲和层析纯化。本研究制备的斑马鱼SFOXP3A-His融合蛋白以包涵体形式表达,虽然不具有生物活性,但包涵体的形成能够防止蛋白酶对表达的目的蛋白的降解作用,而且包涵体形式的目的蛋白有利于分离纯化。间接ELISA法检测其特异性多抗血清效价在1.6×105以上,说明表达的重组蛋白具有很好的免疫原性,能刺激家兔产生高滴度的特异性抗体,为下一步制备其单克隆抗体打下了良好的实验基础。

