灵芝三萜的研究与应用进展
刘 维,虎虓真,朱 莉,甘建红,2,卢 瑛,2,陶宁萍,2,王锡昌,2,许长华,2,*
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,农业部水产品贮藏保鲜质量安全风险评估实验室(上海),国家淡水水产品加工技术研发分中心(上海),上海 201306)
灵芝属(Ganoderma)真菌属于担子菌门(Basidiomycota)、伞菌纲(Agaricomycetes)、多孔菌目(Polyporales)、灵芝科(Ganodermataceae)。2015年版《中国药典》将能用作中药材的灵芝规定为真菌赤芝(G. lucidum Karst,GLK)和紫芝(G. japonicrn L.loyd)干燥子实体的总称。灵芝在我国常作为中药材使用,首载于最早的药物学专著《神农本草经》,并被归为上品。已知的灵芝品种约108 种[1],最常见的为GLK,其次为紫芝。灵芝含有多种生物活性成分,目前研究较多的有多糖类[2-4]、三萜类[5]、多肽核苷类[6-7]、无机微量元素(锗[8]、硒[9])等。
灵芝三萜(Ganoderma lucidum triterpenoids,GLTs)是从灵芝中分离得到的活性成分之一,具有较高的药用价值。与另一活性物质灵芝多糖相比,对其研究及应用并不广泛。为深入了解GLTs类化合物,本文对这一活性物质进行详细地综述,主要概述其基本理化性质,归纳近5 年其在体内外药理活性实验中的研究进展,探究其发酵工艺条件优化和分离纯化方法,整理发酵分离所得纯化产物的常用品质监控技术,总结其在功能性食品中的应用,并提出在实际应用中所存在的问题,展望未来发展趋势,以期日后能为灵芝功能性食品的生产和临床医学研究提供更多的理论参考。
1 理化性质
GLTs可从不同品种的灵芝中分离获得,其含量是鉴定灵芝品质优劣的重要指标之一[10]。1982年,自Takashi等[11]首次分离到灵芝酸(ganoderic acid,GA)A和GAB,迄今已鉴定的GLTs种类达300多种[12]。GLTs的化学结构较复杂,相对分子质量一般在400~600之间,脂溶性较高,难溶于水。多数GLTs具有苦味,苦味越强则GLTs含量越高[11]。从灵芝孢子粉、子实体、菌丝体及发酵液的提取物中分离出多种三萜类成分,大多是以GA为主的具有高度氧化性的羊毛甾烷衍生物,多为极性分子,挥发性弱。图1为典型的羊毛甾烷三萜骨架[13]。

图 1 典型的羊毛甾烷三萜骨架[13]Fig. 1 Backbone structure of typical lanostane triterpenoid[13]
根据分子结构不同,三萜类化合物可分为单环、双环、三环、四环、五环和链状三萜。根据异戊二烯定则,多数三萜被认为是由6 个异戊二烯(30 个碳)缩合而成的。依据碳原子数目的不同可分为C24、C27及C30 3 种。根据官能团和侧链将其命名为GA、GA甲酯、赤灵酸、灵赤酸、灵赤酸甲酯、灵芝孢子酸、GLK孢子内酯、灵芝醇、灵芝醛和灵芝内酯等[14]。其结构式中多含羟基,在红外光谱中有较强的羟基吸收峰;在紫外光谱250、237 nm和365 nm波长处有特征吸收峰;在质谱裂解过程中GLTs会失去侧链。
2 药理活性
GLTs结构和种类的多样性决定了其药理学和生物学活性的多样性,包括抗氧化、保肝护肝、增强免疫、抗肿瘤、降血脂血糖、防治心血管疾病、缓解哮喘、抗人类免疫缺陷1型病毒(human immunodeficiency virus-1,HIV-1)及HIV-1蛋白酶活性、抑制组胺释放、抑制血小板聚集和防治癫痫等作用。
2.1 抗氧化性
通过测定1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基与羟自由基(·OH)的清除率可知,树舌灵芝的总三萜与多糖均具有一定的抗氧化活性,且GLTs的抗氧化能力比多糖强,因此GLTs可作为天然防腐剂的新来源[15]。DPPH自由基清除效果显示,GLTs比茶多酚的清除率高、效果好[16]。Tel-Çayan等[17]对树舌环氧酸G、E、A和Δ22-豆甾烯醇进行了抗氧化活性和抗胆碱酯酶活性评估,结果表明乙酸乙酯提取物在所有测试中表现出最好的抗氧化活性,其中Δ22-豆甾烯醇在β-胡萝卜素亚油酸实验中显示出较高的脂质过氧化抑制活性,半抑制浓度(half maximal inhibitory concentration,IC50)为(160.39±2.16)μg/mL。松杉灵芝中的9 种GA混合物通过抑制异丙肾上腺素诱导的Fas/Fas配体表达、减轻氧化应激和防止细胞凋亡,达到保护小鼠心脏的功效[18]。
2.2 免疫调节活性
GLK中的三萜类化合物能通过增加白细胞介素-6和肿瘤坏死因子的表达来刺激免疫应答,经GLK三萜治疗后,小鼠的脾脏和胸腺的免疫器官指数明显增加,GLK三萜类化合物在体外和体内均具有抗肺癌免疫调节活性和诱导细胞凋亡的作用[19]。通过皮肤实验和抗原特异性血清中的免疫球蛋白E检测鉴定每名哮喘患者的特异性过敏情况,各项指标结果表明GAβ能有效恢复患者外周血单核细胞(peripheral blood mononuclear cell,PBMC)的辅助性T1细胞/调节性T细胞-辅助性T1细胞平衡,使白细胞介素-5、干扰素-γ、白细胞介素-10和白细胞介素-12水平上升[20],使哮喘症状得到有效缓解。Su Limin等[21]证明GA乙二酯(GA ethyl ganoderate C2,CBLZ-7)对体外胞囊的形成具有有效的抑制作用,其能够下调佛司可林诱导的癌蛋白/丝裂原活化蛋白激酶信号通路的活化,结果表明GLTs及其纯化单体CBLZ-7是治疗囊性肾病的潜在药物。Choi等[22]研究了12 种羊毛脂三萜烯在小鼠巨噬细胞RAW264.7中抗炎和对血红素加氧酶1(heme oxygenase 1,HO-1)的诱导作用,结果证实7 种二十碳三烯(GT-1、GT-2、GT-3、GT-4、GT-5、GT-7和GT-12)能诱导HO-1蛋白的表达,且HO-1表达与这些化合物在RAW264.7细胞中的抗炎反应显著相关。通过测定29 种羊毛烷三萜对由脂多糖激活的小胶质细胞BV-2中的一氧化氮产生的抑制作用来测试它们的抗炎活性,IC50介于(3.65±0.41)~(28.04±2.81)μmol/L之间[23]。GAC1可通过阻断核因子κB活化和抑制PBMCs产生肿瘤坏死因子、干扰素-γ和白细胞介素-17A等促炎性细胞因子,治疗胃肠道的慢性炎性疾病克罗恩病[24]。Chen等[25]从松山灵芝(G. tsugae)中提取的三萜类化合物可抑制T细胞组胺释放,具有抗过敏作用。GLTs和外源性神经节苷脂的协同作用可有效改善大鼠癫痫脑损伤,其可能是通过影响反映脑组织损伤及炎症反应的S蛋白-β、神经元特异性烯醇化酶、C反应蛋白和降钙素基因相关肽蛋白表达而起到保护脑神经元的作用[26]。
2.3 抗肿瘤活性
从灵芝中分离的GLTs具有广谱的抗癌特性,主要包括对癌细胞的抗转移、抗增殖和抗血管生成活性能力,但具体作用效果及其抗肿瘤机制还有待进一步研究,需得到体内实验及临床实验的进一步验证。目前的研究揭示了GLTs在诱导癌细胞凋亡和抑制端粒酶活性方面的作用,并且其对健康细胞的毒性低。Sillapapongwarakorn等[27]筛选了208 种GLTs,并通过对接软件AutoDock4选择性地稳定潜在G-四联体DNA(potential G-quadruplex DNA,pG4DNA)。结果表明,GAA和GADf表达出高度的结合亲和力,并选择性地结合到pG4DNA的侧沟上,抑制端粒酶活性,可作为抗癌剂。闫征等[28]探究了3 种三萜化合物与5 种肿瘤细胞的剂量-效应关系,结果表明GAY能抑制肺癌细胞H460的活性,IC50为22.4 μmol/L,其次是7-氧代-GAZ2(IC50为43.1 μmol/L)。Kohno等[29]发现5 种羊毛甾烷衍生化合物GAT-Q、GAT-F、GAT-S、GAT-TR和灵芝酮三醇具有刺激微管蛋白聚合的潜力,且比先前报道的能特异性结合微管蛋白的GADM活性更高,为微管蛋白靶向抗癌药物的设计提供指导。Zheng Dongshu等[30]分析了GAA、GAB、灵芝酚B、灵芝酮三醇和灵芝酮二醇的光谱,结果表明这5 种三萜类化合物可通过抑制端粒酶的活性预防鼻咽癌。GLTs通过调控细胞周期、减少凋亡蛋白,能显著抑制前列腺癌细胞增殖并促进细胞凋亡[31]。Li Peng等[32]提取的新型三萜化合物对人原髓细胞白血病细胞HL-60和淋巴瘤细胞CA46癌细胞株具有细胞毒性,IC50分别为25.98、20.42 μg/mL。灵芝诺酮A对慢性髓原白血病细胞K562、肝癌细胞BEL7402和胃腺癌细胞SGC79002细胞株具有中等细胞毒性,IC50分别为7.62、6.28、3.550 2 μmol/L[33]。
2.4 抗菌、抗病毒活性
真菌是天然抗生素最丰富的来源之一,从真菌中可提取重要的抗生素青霉素。而作为同是真菌属的灵芝,对其微生物活性化合物的研究大多以子实体和菌丝体的粗提取物为主体,关于GLTs抗菌活性的研究很少。Vazirian等[34]从氯仿提取物中分馏出的三萜类化合物和类固醇化合物混合物,能够抑制革兰氏阳性菌和酵母菌,最小抑制质量浓度为6.25 mg/mL,但在相同测试质量浓度下对革兰氏阴性菌无效。其中,乙酸麦角甾-7,22-二烯-3β-醇和乙酸等萜醇化物的混合物对大肠杆菌的抑制作用微弱(最小抑制质量浓度10 mg/mL)。王开金等[35]研究了灵芝水提取物GLTs对耻垢分枝杆菌(Mycobacterium smegmatis mc2155,M.S-155)的增殖曲线、GlmU基因表达和细胞壁结构的影响,结果表明GLTs对M.S-155抑制作用显著。从醋酸乙酯提取物中提取的新型三萜类化合物(12b-乙酰氧基-3b,7b-二羟基-11,15,23-三氧代戊酸-8-烯-26-酸丁酯)对革兰氏阳性菌表现出显著的抗微生物活性,对金黄色葡萄球菌(ATCC 6538)和枯草芽孢杆菌(ATCC 6633)的最低抑菌浓度分别为68.5 μmol/L和123.8 μmol/L[36]。
肠道病毒71(enterovirus 71,EV71)是儿童手足口病、神经系统和全身性并发症的主要致病因素。Zhang Wenjing等[37]评估了GLTA和GLTB抗EV71病毒感染的活性。结果表明,两种物质通过与病毒颗粒相互作用可阻止EV71感染,阻断病毒对细胞的吸附,其在人横纹肌肉瘤细胞中均有显著的抗EV71活性。GA-B对HIV-1蛋白酶的亲和力高于奈非那韦,灵芝二醇对恶性疟原虫I蛋白酶的亲和力优于恶性疟原虫I蛋白酶抑制剂(KNI-10006),可用作抗艾滋病毒和抗疟疾药物[38]。
2.5 保肝护肝活性
GLTs是保肝护肝的良药。刘乔等[39]优化了灵芝孢子粉中GA的提取工艺,并对其进行抗氧化活性实验,首次证明GA能显著提高亚急性衰老模型小鼠的肝脏抗氧化活性。Chiu等[40]通过人体实验表明三萜类化合物和多糖的协同作用可能会通过减少过度产生的自由基影响其抗氧化、抗衰老和保肝功效,保护肝脏细胞免受损害。Peng Xingrong等[41]的研究表明,灵芝菌素B、丹芝醇B和赤芝酮A均具有显著的肝脏保护作用,经H2O2诱导损伤的体外人肝癌细胞HepG2中,3 种物质对谷丙转氨酶和谷草转氨酶水平的升高均具有有效的抑制活性。刘莉莹等[42]首次从树灵芝(G. sessile)的苯乙醇提取物氯仿部位分离得到16 种三萜化合物,其中6 种对人肝HL-7702细胞的成活率高于护肝药物双环醇,为保护肝脏的临床研究提供依据。
2.6 其他
GLTs是醛糖还原酶和α-葡糖苷酶的活性抑制剂,可抑制餐后高血糖,在糖尿病治疗中发挥重要作用。Fatmawati等[43]从灵芝子实体中分离出灵芝醇和GA,对两种物质的结构-活性研究表明,其特定位置的—OH取代基和双键部分可增加α-葡萄糖苷酶抑制活性,此研究可用于改进新型α-葡萄糖苷酶抑制剂。GLTs具有良好的防辐射功效。Smina等[44]的研究表明灵芝子实体中的三萜在辐射导致的DNA和膜损伤方面具有显著的保护效果。对瑞士白化小鼠注射GLTs预处理14 d,将其全身暴露于γ射线中,结果表明GLTs可抑制小鼠体内受γ射线诱导的氧化应激[45]。
GLTs以中等抑制率抑制血管紧张素转换酶的活性[46],GAF对人脐静脉内皮细胞的毛细管样结构的形成具有最强的抑制作用[47]。此外,GLTs还可用于治疗冻伤[48]、阿尔茨海默病[49]和改善睡眠[50]等。
3 发酵、分离提取方法
3.1 发酵培养
由于野生灵芝的数量有限及其不合理的利用,限制了灵芝的开发。人工栽培灵芝具有生长周期过长、消耗营养资源大、活性物质含量低、对自然环境影响大等不利因素。因此,可通过灵芝发酵生产的工艺途径获得灵芝产物及其代谢物,包括固态发酵和液态发酵。
固定化灵芝细胞在耐酸、耐碱方面优于未固定细胞,长时间培养仍具有较高生产能力。董玉玮等[51]研究了包埋法固定灵芝细胞生产胞外三萜工艺,最佳条件为:海藻酸钠和CaCl2质量分数分别为4.5%和2.2%、自然pH值培养基内接种40 个固定化小球、温度为28 ℃,110 r/min下振荡培养12 d,最终所得胞外三萜类产量为(49.53±1.37)×10-2mg/mL,回收利用次数可达5 次。
双向发酵属于一种新型发酵技术,将灵芝与另一种或多种中药材按不同比例混合进行联合发酵,此技术具有低毒性、增强药效、提高活性成分吸收率等特点,例如以真菌灵芝为发酵菌种,添加一定量当归粉末的药性基质为发酵基质的双向发酵[52]和灵芝菌-玄七通痹胶囊药渣的双向发酵[53]等,当归质量浓度为60 g/L时,胞外总三萜产量可达964.63 mg/L[54]。
此外,采用中间补料的方式[55],以N-10酵母自溶粉作为氮源[56]、加入氧载体正十二烷[57]和加抗生素两性霉素[58]等进行的发酵效果均优于传统发酵。
3.2 分离纯化
根据三萜的物理化学性质和生化反应特性差异,可利用溶解度、吸附力、蒸汽压、中和、皂化和酶解等方式提取三萜化合物。通过控制温度和真空条件等导致的物理化学性质的改变除去非GA类物质。随着GLTs的研究开发,其提取方法也越来越多,主要包括传统热提取[59]、索氏提取(Soxhlet extraction,SE)[60-61]、微波辅助提取(microwave-assisted extraction,MAE)[62-63]、超临界萃取(supercritical fluid extraction,SFE)[64]和超声波辅助提取(ultrasonic-assisted extraction,UAE)[65-66]等,如表1所示。近年来,UAE和MAE技术作为新兴的提取方法,具有操作简便、节省时间、能耗低、破坏有效成分少和效率高等特点,在三萜成分提取方面具有广泛的工业化应用前景。
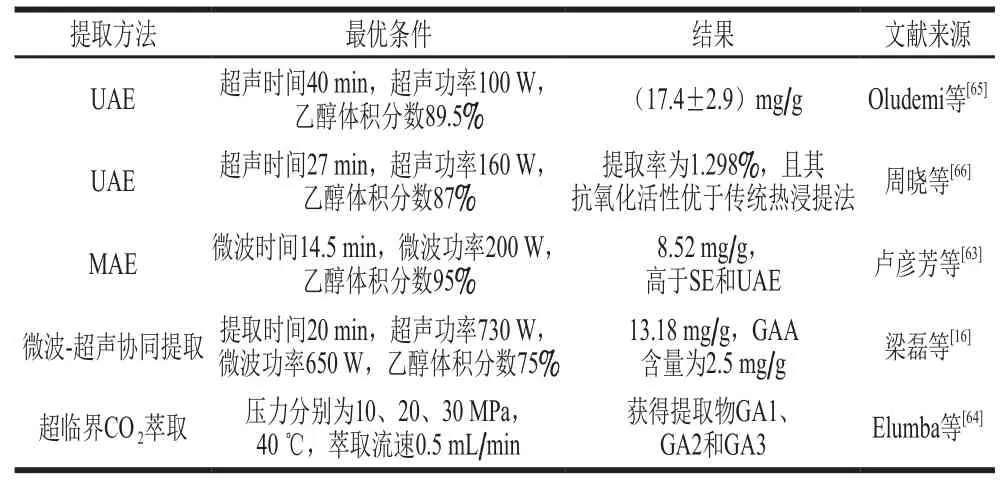
表 1 GLTs的常用提取技术Table 1 Summary of commonly used techniques for extraction of GLTs
4 质量控制方法
为保证GLTs的分离和提取过程中的质量要求,必须要对三萜类化合物进行分析,建立一个便捷、精确的分析方法以监控产品质量。对GLTs可进行定性和定量分析,定性分析可采用化学试剂特征显色法;定量分析可采用香草醛-浓硫酸试剂可见光比色法、紫外分光光度(ultraviolet spectrophotometry,UV)法、薄层层析(thin layer chromatography,TLC)法、高效液相色谱(high performance liquid chromatography,HPLC)法以及色谱-质谱联用技术。但在实验室研究和实际应用中,最常见的还是UV、TLC及HPLC 3 种方法,目前已建立了很多GLTs化合物TLC、HPLC的标准指纹图谱。
目前HPLC法已广泛用于GLTs的定性测定中,具有分离效果好、操作简单、重现性好、仪器精密度好、灵敏度高等优点。此方法的主要缺陷在于GLTs标准品的分离纯化困难,制备出的GLTs纯品价格昂贵。在测定三萜酸的相关文献中,所建立的方法仅用于测定一种或几种GLTs,而GLTs种类有上百种,检测数量受限。贾红岩等[67]建立了能同时测定12 种三萜酸的方法,用于测定不同产地及品种GLTs成分的含量,结果显示吉林长白山上的野生灵芝GLTs含量远低于人工栽培的灵芝,且总GLTs含量仅为人工栽培灵芝的1/10。Liu Wei等[68]使用HPLC通过一测多评法同时检测其他16 种GA及GLTs的含量。于华峥等[69]探讨了灵芝子实体、菌丝体和孢子粉3 个部位中GLTs成分的差异,并对其HPLC指纹图谱进行相似度分析。结果表明,灵芝子实体内总三萜含量高、种类多;菌丝体中的三萜含量低、种类少;未经破壁的孢子粉中GLTs含量基本为零。
还有一些新方法可对灵芝总三萜进行快速检测和品质鉴定。例如,Chen Yi等[70]建立了基于近红外反射光谱法的不同来源灵芝、灵芝总多糖和三萜类化合物的定量方法;Sakamoto等[71]开发了胶体金免疫层析试纸条(immunochromatographic strip assay,ICA)快速检测GAA的方法,该系统可以通过酶联免疫吸附测定进行灵芝中GAA的半定量分析。新开发的ICA可用于以GAA为指标的灵芝的标准化。
5 功能性食品
GLTs类化合物在制药领域已有一定的应用,例如生产各类抗癌[27,30-31]、护肝[40,42]、抗氧化[16-17]、提高免疫力[19,22]和降血糖血脂[43,72]类药物。而其在食品中的实际应用远不如灵芝多糖广泛,由于GLTs的提取率低且价格高,一般不会在食品中添加纯化的GLTs。添加了GA和灵芝多糖的酸奶相比于空白对照酸奶,风味物质种类增加,乳酸菌活菌数增加3.1 倍,功能性品质提高[73]。将发酵GLTs的残渣添加于功能性动物饲料中,可促进猪的生长发育,增强其免疫力,使其肉品品质更好[74]。通过优化椰肉、椰汁配比和过滤时间提高椰奶灵芝酒中GLTs含量可增强酒的功能性[75]。含三萜提取物的灵芝咖啡可促进小鼠免疫功能的提高[76]。
6 结 语
灵芝提取物GLTs化合物在癌症治疗、抗氧化、保肝护肝、抗病毒、降血糖血脂和防辐射等方面具有优异的药用潜力,是良好的药食同源物质,在充满发展潜力的消费条件和国际环境驱动下,应发挥三萜的优势,开发具有高质量的功能性产品。
GLTs具有蓬勃的发展趋势,但同时也要注意发展中不可忽视的客观问题:1)应用性:灵芝及其活性提取物在食药产品及保健品中的应用广泛,但GLTs类化合物的相关产品仍较少;2)安全性:在食品安全问题严重的大环境下,灵芝受环境污染的影响,利用子实体及孢子粉提取的GLTs中不可避免的会含有一些重金属离子,其细胞毒性和安全性需得到保障;3)单体纯化:一方面,灵芝多糖和GLTs均是灵芝的主要活性物质,三萜类化合物在保肝护肝等某些药理方面比灵芝多糖具有独特优势,因此可制备纯化的GLTs以达到高效治疗或预防特定疾病的目的;另一方面,GLTs的种类繁多,但并非所有三萜都具有有效活性,而分离提取有效纯化单体的技术不发达;目前,纯化的GLTs价格昂贵、制备量小,不适用于工厂化生产,只能用于实验室研究;4)规范化:GLTs检测技术落后,产品质量缺乏统一规范标准,良莠不齐;GLTs的精深加工具有高经济效益,故必定存在优劣混杂、掺假和仿冒等问题。
因此,GLTs的未来发展应立足于以下4 个方面:1)提高GLTs的应用潜力,致力于功能性食品及药品,尤其是保健品的开发;强调GLTs的功能性,从人体细胞学、代谢组学和预防医学的角度入手,致力于研发出为糖尿病、肝病和艾滋病等特殊人群以及癌症人群服务的高性价比产品;2)深度纯化三萜化合物,提高GLTs的分离纯化和发酵技术,增加产量;3)深入研究三萜的药理活性机制,制备运用于食品药品的精深加工纯化单体;4)规范产品质量的统一标准,完善GLTs指纹图谱,寻求三萜化合物有效成分的快速检测方法,为GLTs规模化生产提供质量保障。

