SOX2在卵巢癌中的表达变化及其对细胞增殖与侵袭的影响
杨慧芝,谭志琴,文玉华,林燕蕊,余晓珊,万兰
(南部战区空军医院,广州 510000)
SOX2基因,是SOX家族成员之一,于1994年在人类中被发现与鉴定[1]。SOX2是一个关键的转录因子,在维持干细胞多能性方面起着重要作用[2,3]。作为一种重要的癌症干细胞标志物,SOX2也参与肿瘤细胞的增殖、分化、侵袭、转移、耐药以及复发等过程[4,5]。研究表明,SOX2在多种恶性肿瘤中异常表达。然而,SOX2在卵巢癌中的表达及生物学功能尚未完全清楚。因此,本研究观察了SOX2在卵巢癌中的表达变化及其下调对卵巢癌细胞增殖与侵袭的影响。
1 材料与方法
1.1 标本来源、细胞及主要试剂 收集我院2015年12月~2017年11月经手术切除的卵巢癌组织及其癌旁正常卵巢组织58例。58例卵巢癌患者年龄36~64岁、中位年龄53.6岁,≤50岁20例,>50岁38例;FIGO分期为Ⅰ期18例,Ⅱ期26例,Ⅲ期14例;病理分级为G1期16例,G2期24例,G3期18例;有淋巴结转移37例,无淋巴结转移21例;组织学类型为浆液性癌35例,其他类型23例。本研究获我院伦理委员会批准。人卵巢癌细胞株SKOV3细胞以及人正常卵巢上皮细胞株IOSE80细胞购于中国科学院细胞库。RNeasy Mini Kit、Reverse Transcription Kit与SYBR Green染料购于Qiagen公司;RNA抽提试剂盒购自美国Invitrogen公司;si-SOX2、si-control、Lipofectamine2000、Transwell小室购于美国Invitrogen公司;MTT购于美国Sigma公司。
1.2 卵巢癌组织与细胞中的SOX2 mRNA表达检测 采用real-time PCR。培养人卵巢癌细胞株SKOV3细胞以及人正常卵巢上皮细胞株IOSE80细胞,用RNA抽提试剂盒抽提两种细胞中的总RNA,再经逆转录试剂盒合成cDNA存于-70 ℃。采用TRIzol法抽提卵巢癌组织与正常卵巢组织标本中总RNA,再经逆转录试剂盒合成cDNA存于-70 ℃。SOX2:正向引物序列为5′-TAATTAGAATTCATGTACAACATGATGGAGACG-3′;反向引物序列为5′-TAATTAGGTACCTCACATGTGTGAGAGGGGCAGTGTGC-3′。PCR扩增反应体系包括2×QuantiTect SYBR Green PCR Master Mix 10 μL,10×miScript Universal Primer 2 μL,10×miScript Primer Assay 2 μL,Template cDNA 1 μg,RNase-free water加至共20 μL。循环体系:37 ℃ 15 min,3个循环;94 ℃ 5 s,55 ℃ 5 s,70 ℃ 5 s,40个循环;4 ℃ 5 s;在CFX96实时荧光PCR系统上检测。以β-actin为内参,采用2-ΔΔCT法分析SOX2 mRNA的相对表达量。
1.3 细胞分组及转染si-SOX2方法 培养卵巢癌SKOV3细胞,将SKOV3细胞分为观察组与对照组,按2 mL/孔接种于6孔板中,培养至细胞汇合度达50%。用灭菌的无酶水稀释各种转染质粒干粉,按说明配制成20 μmol/L的溶液备用。用不含血清的Opti-MEM培养液分别稀释100 pmol转染质粒与5 μL的Lipofectamine2000,混匀,室温孵育5 min。观察组转染si-SOX2,对照组转染si-control。转染后细胞继续培养48 h后收获细胞。采用免疫印迹试验检测两组细胞中SOX2蛋白。提取观察组与对照组细胞总蛋白,用BCA法测定细胞的蛋白浓度,每组取等量样本进行SDS-PAGE凝胶电泳,电泳后转膜,封闭1 h,加入SOX2抗体或β-actin抗体,4 ℃过夜,TBST洗膜,加二抗孵育1 h,洗膜,ECL发光,X片曝光、显影、定影,扫描图片,并计算结果。观察组、对照组SOX2蛋白相对表达量分别为0.359±0.046、1.022±0.067,两组比较P<0.01,观察组SOX2蛋白表达下调提示si-SOX2转染成功。
1.4 两组细胞增殖能力观察 采用MTT实验。取观察组与对照组细胞接种于96孔板中,每组设5个复孔,培养至临近饱和,每孔加灭菌MTT液(5 mg/mL)20 μL,孵育4 h后取出,每孔加入DMSO 150 μL,低速振荡10 min,选择570 nm波长在酶标仪上测定各孔光密度值(OD值),OD值越大提示细胞增殖能力越强。实验重复3次,取平均值。
1.5 两组细胞侵袭能力观察 采用Transwell侵袭实验。细胞分组及处理同1.3。在Transwell小室中铺加8 μL稀释好的基质胶,过夜形成基质膜。取100 μL即含1×105个细胞/mL的细胞稀释液,接种于Transwell小室上层,下腔加500 μL含20% FBS的培养液后,置于37 ℃温箱中孵育36 h,取出,用棉签擦弃小室上层未迁移的细胞,PBS液轻洗,4%多聚甲醛固定、结晶祡染色下层穿出细胞,PBS液洗,倒置,晾干。光学显微镜下观察并摄相,随机选取4个高倍视野进行细胞计数,细胞计数越多,提示侵袭能力越强。实验重复3次,取平均值。

2 结果
2.1 SOX2在卵巢癌组织、细胞中的表达情况 SOX2 mRNA在卵巢癌组织、癌旁正常卵巢组织中的相对表达量分别为2.489±0.162、1.075±0.109,两者比较P<0.01。SOX2 mRNA在卵巢癌SKOV3细胞、正常卵巢上皮细胞株IOSE80细胞中的相对表达量分别为1.925±0.162、0.946±0.127,两者比较P<0.01。
2.2 SOX2在卵巢癌组织中的表达与临床病理参数的关系 见表1。
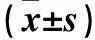
表1 SOX2在卵巢癌组织中的表达与临床病理参数的关系
2.3 两组细胞增殖能力比较 观察组、对照组细胞OD值分别为0.492±0.047、0.749±0.062,两组比较P<0.05。
2.4 两组细胞侵袭能力比较 观察组、对照组穿膜细胞数分别为(136.7±8.4)、(206±12.2)个,两组比较P<0.01。
3 讨论
SOX2基因位于染色体3q26.3-q27,属于SOXB1组,是由317个氨基酸编码组成的蛋白质[1,2]。SOX2主要由N-末端、HM和反式激活域三个结构域组成。SOX2在癌症中的表达往往增高,并且与癌症患者的不良结局相关,可通过诱导上皮—间质转化促进转移[10]。SOX2表达增高与口腔鳞状细胞癌、肝细胞癌、结肠直肠癌以及胶质母细胞瘤的肿瘤进展密切相关[6~9]。SOX2的表达与非小细胞肺癌患者的吸烟状况和组织学类型相关,并与非小细胞肺癌患者的预后相关[11]。SOX2的表达与原发性头颈部鳞状细胞癌中较差的临床结局相关,并可用于预测患者的预后[12]。SOX2与胃癌的病理分期和临床结局相关,也是胃癌的独立预后标志物[13]。SOX2的表达水平对于预测鼻咽癌的远处转移与预后亦具有重要价值[14]。本研究发现,SOX2在卵巢癌细胞与组织中表达明显增高,SOX2的表达与卵巢癌患者组织学分级、FIGO分期及淋巴结转移密切相关,结果与上述研究相符,表明SOX2参与卵巢癌发生与进展。
研究显示,SOX2在一些肿瘤中可调节细胞增殖。在胰腺癌中,SOX2敲低后通过对p21Cip1和p27Kip1的转录诱导可导致胰腺癌细胞周期阻滞,从而抑制细胞生长[15]。过表达SOX2通过对cyclinD3转录诱导促进胰腺癌细胞增殖[15]。在肺鳞状细胞癌中沉默SOX2通过上调BMP4抑制细胞增殖[16]。在黑色素瘤A2058细胞中,SOX2敲低后通过上调基质金属蛋白酶3可抑制肿瘤细胞的侵袭[17]。同样在结肠直肠癌细胞中,SOX2通过介导MMP-2参与体外细胞迁移和侵袭[18]。在恶性胶质瘤中也证实,下调SOX2后细胞迁移和侵袭能力亦显著降低[19]。Yang等[20]表明,SOX2通过诱导MMP-2和PI3K/AKT/mTOR通路参与促进喉癌细胞的侵袭和迁移。为明确SOX2在卵巢癌中的生物学功能,本研究将卵巢癌SKOV3细胞转染si-SOX2使其SOX2表达下调,进一步通过MTT实验与Transwell侵袭实验研究发现,下调卵巢癌细胞中SOX2的表达能明显抑制卵巢癌细胞的增殖和侵袭,表明SOX2在卵巢癌中发挥癌基因样作用。
综上所述,SOX2在卵巢癌细胞与组织中表达增高,且SOX2在卵巢癌组织中的高表达与卵巢癌患者的高级别FIGO分期、组织学分级以及淋巴结转移有关,下调卵巢癌细胞中SOX2能促进细胞增殖和侵袭。由此推测SOX2在卵巢癌组织中的高表达可能与卵巢癌的发生发展密切相关,这为卵巢癌发生发展的可能分子机制提供了一个新的思路,为SOX2成为卵巢癌临床预后生物学标志物以及可能的治疗靶点提供了实验证据。

