术前18F-FDG PET/CT纵隔淋巴结SUVmax在ⅢA(N2)期非小细胞肺癌手术患者预后评估中的价值
韩飞,戴天阳,曾培元,蒲江涛,何开明,宋琦,胡智,吴云飞,李渊,徐涛
(西南医科大学附属医院,四川泸州 646000)
肺癌发病率及病死率位居恶性肿瘤之首[1],其中约80%为非小细胞肺癌(NSCLC)[2],而在NSCLC中N2约占20%[3]。准确的术前分期是制定个体化治疗方案和精准评估预后的基础,尤其是对ⅢA(N2)期NSCLC患者,术前纵隔淋巴结的准确分期显得格外重要。正电子发射计算机断层显像(PET/CT)对纵隔淋巴结的双定量分析,明显提高了对NSCLC术前N分期的准确性,已广泛应用于肺恶性肿瘤的术前TNM分期[4,5]。PET/CT主要是运用示踪剂18F-FDG注入机体内,以标准化摄取值(SUV)来反映原发病灶及纵隔淋巴结糖代谢状态。影响NSCLC术后预后的因素有很多,有年龄、性别、病理类型、TNM分期、辅助治疗等,但都缺乏特异性;另外,有研究显示,NSCLC原发病灶SUVmax与患者术后预后呈正相关[6,7]。但是,对于ⅢA(N2)期NSCLC患者,纵隔淋巴结SUVmax与患者术后预后关系的研究甚少。鉴于此,本研究对术后病理证实为ⅢA(N2)期NSCLC患者的术前PET/CT纵隔淋巴结SUVmax与预后进行分析,探究两者的关系,以便为ⅢA(N2)期NSCLC患者制定肿瘤个体化治疗方案及更准确地评估术后预后。
1 资料与方法
1.1 临床资料 回顾性分析2010年1月~2015年12月西南医科大学附属医院手术治疗的1 626例NSCLC患者。纳入标准:①PET/CT检查后1周内行手术治疗,且有FDG摄取;②手术方式为肺叶或叶以上切除+系统性纵隔淋巴结清扫;③按国际肺癌研究协会(IASLC)第七版TNM分期标准,术后病理分期为ⅢA(N2)期NSCLC患者;④R0切除;⑤患者一般情况良好,无手术禁忌证;⑥病例资料完整,且能提供术后随访资料。排除标准:①术前接受新辅助治疗;②围术期发生严重并发症;③既往恶性肿瘤史。按上述标准,本研究共纳入104例患者。其中男56例、女48例;年龄39~70岁,中位年龄55岁;吸烟指数≥400者63例,吸烟指数<400者41例;原发病灶位于右肺上叶27例,右肺中叶2例,右肺下叶32例,左肺上叶40例,左肺下叶3例;肺腺癌48例,肺鳞癌56例;T1有36例,T2有64例,T3有4例;开放手术28例,胸腔镜中转开胸手术12例,胸腔镜手术64;肺叶切除患者92例,联合肺叶切除患者8例,全肺切除患者4例。右侧纵隔淋巴结常规清扫2R、3A、4R、7、8R、9R、10R、11R、12-13R(与病灶肺叶一同送检);左侧纵隔淋巴结常规清扫4L、5、6、7、8L、9L、10L、11L、12-13L(与病灶肺叶一同送检)。术后行辅助治疗80例[75例化疗(含铂类)、4例放化疗、1例靶向治疗],未行辅助治疗24例。所有患者电话随访至2018年1月1日。
1.218F-FDG PET/CT纵隔淋巴结SUVmax计算方法 显像仪器为荷兰Philips公司Gemini TF 16PET/CT仪;18F-FDG由德国Siemens公司EclipseRD回旋加速器和北京派特生物技术有限公司的正电子药物化学合成模块生产,放化纯>95%。受检者禁食4~6 h,空腹血糖控制在3.9~6.8 mmoL/L。安静、避光、平卧休息15 min 后,按3.7 MBq/kg手臂静脉注射18F-FDG;注射后静卧休息40~60 min,排尽尿液后行PET/CT显像。患者仰卧位,双手抱头,平静呼吸;扫描范围从颅顶到大腿上1/3;先行CT扫描:电压120 kV,电流100 mA,螺距0.813,矩阵512×512,层厚2.5 mm。PET采集:1.5 min/床位,共10~11个床位。数据经迭代重建后分别获得冠状面、矢状面、横断面PET、CT及PET/CT融合图像。所有患者PET/CT图像由两名经验丰富的核医学科医生共同阅片,由同一位操作者在CT纵隔窗测量淋巴结大小、视觉分析淋巴结密度,在PET图像上测量相应淋巴结的SUV,比较得出在清扫范围内纵隔淋巴结SUVmax。以本组患者纵隔淋巴结SUVmax的均数作为分界点,分为<均数者与≥均数者。

2 结果
18F-FDG PET/CT纵隔淋巴结单站阳性36例,多站阳性68例;肺原发病灶SUVmax为11.21±5.39,纵隔淋巴结SUVmax为4.73±2.08,肺原发病灶与纵隔淋巴结SUVmax差值为7.33±5.30。其中,纵隔淋巴结SUVmax<4.73者60例,≥4.73者44例。18F-FDG PET/CT纵隔淋巴结SUVmax与与ⅢA(N2)期NSCLC患者预后的关系单因素生存分析结果见表1。将单因素生存分析结果中P<0.1的变量进行多因素Cox回归分析,结果表明纵隔淋巴结SUVmax、肺原病发灶SUVmax、纵隔淋巴结阳性站数、T分期、术后是否行辅助治疗是影响本组ⅢA期(N2)NSCLC患者术后远期生存的独立因素(表2)。

表1 ⅢA期(N2)NSCLC手术患者预后影响因素的单因素分析结果
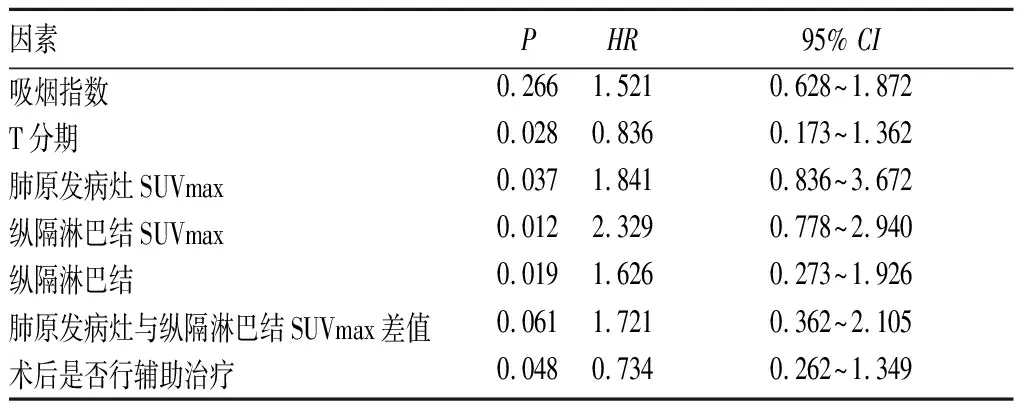
表2 ⅢA期(N2)NSCLC手术患者预后影响因素的多因素Cox回归分析结果
3 讨论
ⅢA(N2)期NSCLC主要特点是异质性[8],其最佳治疗方案目前仍存在争议。有研究将ⅢA(N2)期NSCLC分为4类[9]:①术前或术中未发现,术后病理偶然发现的N2;②术中发现的单站N2;③术前分期(PET/CT或淋巴结活检)发现的单站或多站N2;④巨块或固定的多站N2。N2分类的不同,不仅影响患者治疗方案的选择,同时也影响患者的预后。对于巨块或多站N2,虽然有研究报道巨块单站N2(短径>2 cm)行手术治疗的5年生存率获益[10],但大部分学者认为此类N2的治疗方式应同N3,以同步放化疗为主[11];Lee等[12]回顾性分析358例术后病理分期为ⅢA(N2)或ⅢB期的NSCLC患者,单站N2的5年生存率为33.8%,多站N2的5年生存率为20.4%,单站N2与多站N2的中位生存期为26.4月比18.2月(P=0.016);多站N2的5年生存率(20.4%)与ⅢB期5年生存率(15.5%)的差异无统计学意义(P=0.585)。Thomas等[13]发现3 271例ⅢA(N2)期NSCLC患者术后偶然N2的5年生存率(33.5%)与术前N2的5年生存率(31.4%)无统计学差异(P=0.173),在偶然N2组中,术后辅助化疗或放化疗的5年生存率(39.2%、41.5%)高于单独行手术治疗的5年生存率(20.2%)(P<0.001)。Funakoshi等[14]发现141例术后病理分期为ⅢA(N2)期NSCLC(103例腺癌、38例鳞癌),术后病理N2、术前发现N2(P=0.003)、非完全性切除(P=0.02)、多站N2(P=0.03)是影响腺癌预后的不利因素,非完全性切除(P=0.002)是影响鳞癌预后的不利因素;腺癌中术前未发现N2的5年生存率为43.2%,术前发现N2的5年生存率为15%,单站N2与多站N2的5年生存率分别为62.8%、14.7%。Garrido等[15]研究发现完全性切除是NSCLC术后预后的关键因素,62例完全性切除的患者中位生存期为48.5月,13例非完全性切除患者中位生存期为12.9月,15例未切除患者中位生存期为16.8月(P=0.005);3年和5年生存率三组分别为60.1%、40.4%,23.1%、11.5%,31.1%、0。Van Meerbeeck等[16]发现579例ⅢA(N2)期NSCLC总中位生存期为15.4月,诱导化疗+手术治疗组的中位生存期及5年生存率分别为16.4月、15.7%,诱导化疗+放疗组的中位生存期及5年生存率分别为17.5月、14%(HR=1.06,95%CI=0.84~1.35);然而,亚组分析可以发现行完全手术切除组、非完全切除组的5年生存率分别为27%、7%(P<0.001)。Counago等[17]研究选择247例可手术切除的ⅢA(N2)期NSCLC,发现新辅助化疗或放化疗+手术治疗(R0切除)组中行肺叶切除的中位生存期及3年无病生存率要优于行同步放化疗组,然而行全肺切除的中位生存期及3年无病生存率与同步放化疗组比较无明显统计学差异。因此,术前进行精准的纵隔分期,筛选出手术获益群体(完全切除、非全肺切除者),能在一定程度上提高ⅢA(N2)期NSCLC术后生存率。对于NSCLC,虽然纵隔镜、纤维支气管镜超声引导下经支气管针吸活检(EBUS-TBNA)等纵隔淋巴结活检术是术前纵隔分期的金标准[18],但由于纵隔镜、EBUS-TBNA潜在的并发症和较高费用以及技术要求高等原因,限制了其在我国的普及。由此,本研究回顾性分析104例术后病理证实为ⅢA(N2)期NSCLC患者术前PET/CT纵隔淋巴结SUVmax与术后预后的关系,探讨用纵隔淋巴结SUVmax评估ⅢA(N2)期NSCLC术后预后的价值,将其更好的用于术前分期,帮助临床医生为患者制定个体化的治疗方案。
影响ⅢA(N2)期NSCLC术后预后的因素有很多。Oskarsdottir等[19]研究发现,高龄(>75岁)是影响NSCLC术后预后的不良因素(HR=1.03,95%CI:1.02~1.04,P<0.000 1)。Urvay等[20]认为,年龄是影响Ⅲ期NSCLC预后的独立因素。Jeremic等[21]Meta分析显示,年龄、性别、病理类型等变量常用来评估ⅢA(N2)期NSCLC术后预后。Pinto等[22]Meta分析表明,性别、吸烟状况、病理类型等是影响NSCLC术后预后的变量。但本研究生存分析显示,年龄、性别、病理类型、吸烟指数等变量并非是影响术后预后的独立因素,分析原因一方面可能是样本量较少,另一方面本组研究对象是ⅢA(N2)期NSCLC,组间无分期差异,且以手术切除+系统性纵隔淋巴结清扫为一线治疗。关于肿瘤部位与术后预后的关系,Kamel等[23]分析诱导治疗后行手术的203例临床分期为ⅢA(N2)期NSCLC的患者,单因素及多因素生存分析表明位于上叶或中叶的肿瘤是出现持续性N2的独立预测因素,与患者的低生存率相关。由于病例数有限且本组患者术前均未行诱导治疗,并未发现肿瘤部位的不同对术后预后有影响。Kim等[24]研究发现,T分期、术后辅助化疗是ⅢA(N2)期NSCLC术后长期生存的独立预后因素。本组研究生存分析表明,T分期、术后辅助治疗(以化疗为主)等变量对术后预后的影响有统计学差异。研究表明,多站N2的预后较单站N2差,本组研究得到同样的结果(P=0.008)。目前较多研究表明,肺原发病灶SUVmax是NSCLC术后预后的独立预测因素[25,26],但大部分研究对象是Ⅰ、Ⅱ期NSCLC,对于Ⅲ期NSCLC的研究较少。Yilmaz等[27]研究79例同步放化疗治疗的Ⅲ期NSCLC,发现原发灶SUVmax≤15与SUVmax>15者的中位生存期分别为11、13月(P=0.826),认为肺原发灶SUVmax对Ⅲ期NSCLC预后无预测作用。本组研究单因素和多因素生存分析显示肺原发病灶SUVmax(<11.21,≥11.21)是影响术后预后的独立因素(P=0.006),分析原因可能是主要治疗方法不同,本组选择的是行根治性手术(R0切除)+术后辅助治疗。
与之前研究不同的是,本组研究选取术后病理分期为ⅢA(N2)期NSCLC患者,探讨术前PET/CT纵隔淋巴结SUVmax与术后预后的关系;结果显示,纵隔淋巴结SUVmax是影响本组NSCLC术后预后的独立因素。对于NSCLC,纵隔淋巴结SUVmax与术后预后关系的研究已较多。An等[28]认为,在有炎症性肺病与肺癌共存时,纵隔淋巴结SUVmax是惟一具有预测NSCLC患者术后预后的变量。Mallorie等[29]研究61例NSCLC患者的221个纵隔淋巴结,ROC曲线分析显示纵隔淋巴结SUVmax>6.4特异性高达95.5%,然而敏感性只有48%;当SUVmax>3.3时,其特异性为79.1%,敏感性为80%;纵隔淋巴结是否转移在淋巴结活性大于纵隔血池时最敏感(92.9%),SUVmax大于原发病灶SUVmax/2最有特异性(88.9%)。因此将纵隔淋巴结SUVmax与原发病灶SUVmax/2以及纵隔血池SUVmax结合起来预测NSCLC术后预后,敏感性更高,特异性更强。本研究选取在纵隔血池中活性最高的淋巴结,测出其SUVmax。由于本组病例纵隔淋巴结SUVmax分布不均,若以中位数为临界点,会将大部分数值相近的分到同组,可能对结果产生影响;再者原发病灶均数SUVmax/2=5.6,因此选择均数4.73为临界点既得到更准确的结果,又保证了PET/CT的敏感性及特异性。Sharma等[30]前瞻性评估各种PET/CT参数在预测接受化疗(含铂类)的60例NSCLC患者总生存期中的价值,发现SUVmax、平均SUV等全身PET/CT参数对这部分患者预后无预测价值。Cremonesi等[31]系统评价结果表明,18F-FDG PET/CT在预测接受化疗或放疗的NSCLC患者预后缺乏统一标准,但仍是一种最具潜力的预测因素。Tachi等[32]对92例术后病理分期为ⅢA(N2)期的NSCLC分析发现,无FDG摄取且术前未被怀疑N2的5年生存率高于被怀疑N2的5年生存率(P=0.005 1),有FDG摄取但未被怀疑N2与被怀疑N2的5年生存率的差异无统计学意义。本组患者以手术切除(R0切除)+纵隔淋巴结清扫为一线治疗,术后80例患者接受辅助治疗,以手术为基础的综合治疗方式,体现出纵隔淋巴结SUVmax在ⅢA(N2)期NSCLC术后预后评估中的价值。另外,本组探讨了肺原发病灶与纵隔淋巴结SUVmax差值与预后的关系,进一步分析SUVmax差值各组数据,发现大部分肺原发病灶SUVmax-纵隔淋巴结SUVmax所得值仍处于肺原发灶SUVmax原组范围,实际上反映了肺原发病灶与预后的关系,因此在多因素Cox回归分析时不是影响预后的独立因素。
本研究得出纵隔淋巴结SUVmax、肺原发病灶SUVmax、纵隔淋巴结阳性站数、T分期、术后是否行辅助治疗是影响ⅢA(N2)期NSCLC患者术后远期生存的独立因素,将五者结合起来,将有助于临床医生作出更准确的术前分期,为患者制定出个体化的治疗方案,从而获得较理想的远期生存。由于本组研究未纳入术前PET/CT无FDG摄取但术后病理为N2的这部分患者,如何将PET/CT对术后预后预测的优势运用于这部分N2,还有待后续的研究;本组未纳入术前行新辅助治疗的患者,研究结果是否对这部分患者也适用还有待多中心、大样本、前瞻性的研究来进一步证实。

