miRNA-145对结肠癌细胞体外增殖、侵袭、凋亡的影响
祝 磊 李炳强 陈 晨
(新疆石河子大学医学院第一附属医院,石河子 832000)
结肠癌发病率和死亡率分别占全身恶性肿瘤的第3位和第4位,全球每年有120万新发病例,超过60万死亡病例,严重威胁患者的生命安全和生活质量[1]。结肠癌的临床治疗方案主要为手术切除为主联合放疗、化疗的综合疗法,因结肠癌早期缺乏特异性表现,多数患者诊断时已处于中晚期,化疗是主要治疗方式,5年生存率不足40%,复发和转移是影响疗效的主要因素[2]。寻找新的治疗方法和策略,改善结肠癌治疗效果成为临床研究的热点,基因治疗是癌症治疗的新理念,明确影响结肠癌发病和进展的生物学、基因学特点可为基因学治疗和预后改善提供新证据[3]。miRNA-145是位于人染色体5q32-33的小分子RNA,卵巢癌、前列腺癌、食管癌等癌旁组织均可见miRNA-145表达,它具有阻止细胞癌变和抑制癌细胞生长等作用,miRNA-145表达的变化对肿瘤的发生、增殖、侵袭、凋亡等均有一定影响,但在结肠癌中的研究较少[4-5]。本研究将人工化学合成的miRNA-145拟似物和阻遏物转染结肠癌HCT116细胞,探讨miRNA-145对结肠癌HCT116细胞增殖、侵袭、凋亡的影响,现将结果报告如下。
1 材料与方法
1.1材料
1.1.1细胞株 结肠癌细胞株HCT116购自中国科学院细胞库。
1.1.2主要试剂及仪器 胎牛血清、0.25%胰蛋白酶购自武汉普诺赛生命科技有限公司;Lipofectamine 2000转染试剂、Trizol和反转录试剂盒购自武汉科昊佳生物科技有限公司;RT-PCR试剂盒购自日本Takara公司;MTT、Transwell小室购自北京优尼康生物科技有限公司。
细胞培养箱购自长沙华曦电子科技有限公司;分光光度计、酶标仪、PCR仪购自美国HACH公司;化学法合成miRNA-145拟似物、阻遏物和阴性对照物、miRNA拟似物、阻遏物、阴性对照物合成、测序均由大连宝公司进行。
1.2方法
1.2.1细胞培养 细胞株复苏后,用含10%胎牛血清的RMPI1640培养液将细胞以1×106ml-1的密度培养于37℃、5%CO2细胞培养箱中,隔天更换培养液。
1.2.2细胞转染 取对数生长期的HCT116细胞,胰酶消化后1 000×g离心2min,收集细胞,调整细胞密度至1×105ml-1,接种至6孔细胞培养板,每孔添加2 ml细胞悬液,37℃和5%CO2条件下培养24 h,共分为4组,即空白对照组(Blank control group,BC组)只转染试剂,阴性对照组(Negative control group,NC组)转染miRNA145阴性对照物,miRNA145拟似物转染组(Mimetic transfection group,MT组)转染miRNA145拟似物,miRNA145阻遏物转染组(Repressor transfection group,RT组)转染miRNA145阻遏物,转染过程按照Lipofectamine 2000说明进行。
1.2.3HCT116增殖活性检测 转染后48 h,胰酶消化法制备HCT116细胞悬液转移至96孔板中,调整细胞密度1×105ml-1,每孔含1×104个,每组设6个复孔,接种后24 h、48 h、72 h每孔加入20 μl MTT,继续培养4 h后,弃上清液,加入100 μl DMSO溶解沉淀,震动混匀沉淀15 min,酶标仪比色,记录490 nm处吸光度值。
1.2.4转染后细胞内miRNA-145表达检测 与MTT检测同时间点取细胞样本,采用6孔板接种密度2×105个/孔,酚氟仿法抽取RNA,取2 μg总RNA,反转录制备cDNA,取2 μl反转录产物作为PCR反应模板,荧光定量法检测miRNA-145含量,反应条件:95℃变性10 s,58℃退火10 s ,72℃延伸10 s,循环数设置为40。引物序列:miRNA-145:上游:5′-GCCGGCGCCCGAGCTCTGGCTC-3′,下游:5′-GTCCAGTTTTCCCAGGAATCCCT-3′;内参(RTU6):上游:5′-GTGCTCGCTTCGGCAGCACAT-3′,下游:5′-TACCTTGCGAAGTGCTTAAAC-3′。2-ΔΔCt法分析定量结果。
1.2.5Transwell小室法检测HCT116细胞侵袭 取转染后HCT116细胞1×105ml-1,接种于Transwell板上室,每孔160 μl,加入20%ASPS血清40 μl,800 μl RMPI1640培养基加入下室,培养24 h,计数基底膜下室细胞数,采用在400×显微镜下随机选取中央和上下左右5个视野的穿越基底膜细胞数,取均值。
1.2.6Annexin V-FITC/PI双染法检测转染后HCT116细胞凋亡情况 转染72 h后HCT116细胞以0.25%胰蛋白酶(不含EDTA)消化收集,用PBS洗涤细胞2次,加入500 μl Binding Buffer悬浮,再加入5 μl Annexin V-FITC混匀,最后加入5 μl PI混匀,室温避光反应10 min后,采用流式细胞仪检测各组的细胞凋亡情况。

2 结果
2.1HCT116增殖活性比较 细胞活性检测结果显示,转染后24 h、48 h、72 h时拟似物转染组细胞增殖活性显著低于空白对照组、阴性对照组和阻遏物转染组(P<0.05),空白对照组和阴性对照组细胞增殖活性差异无统计学意义(P>0.05),阻遏物转染组细胞增殖活性显著高于空白对照组、阴性对照组和拟似物转染组(P<0.05)。见图1。
2.2HCT116细胞内miRNA-145表达 RT-PCR结果显示,转染24 h、48 h、72 h时拟似物转染组miRNA-145表达显著高于空白对照组、阴性对照组和阻遏物转染组,阻遏物转染组miRNA-145表达显著低于拟似物转染组、空白对照组和阴性对照组,差异均有统计学意义(P<0.05);空白对照组和阴性对照组miRNA-145表达水平差异均无统计学意义(P>0.05)。见图2。

图1 HCT116增殖活性比较Fig.1 Comparison of HCT116 proliferation activity

图2 HCT116细胞内miRNA-145表达Fig.2 Expression of miRNA-145 in HCT116 cells
2.3HCT116细胞侵袭能力比较 Transwell小室法检测结果显示,拟似物转染组穿膜细胞数显著少于空白对照组、阴性对照组和阻遏物转染组,阻遏物转染组穿膜细胞数显著多于空白对照组、阴性对照组和拟似物转染组,差异均有统计学意义(P<0.05);空白对照组和阴性对照组穿膜细胞数相比较差异均无统计学意义(P>0.05)。见图3。
2.4HCT116细胞凋亡水平相比较 Annexin V-FITC/PI双染法检测结果显示,拟似物转染组细胞凋亡率显著高于空白对照组、阴性对照组和阻遏物转染组,阻遏物转染组细胞凋亡率显著低于空白对照组、阴性对照组和拟似物转染组,差异均有统计学意义(P<0.05);空白对照组和阴性对照组细胞凋亡率相比较差异无统计学意义(P>0.05)。见图4。

图3 HCT116细胞侵袭能力比较Fig.3 Comparison of the invasiveness of HCT116 cells
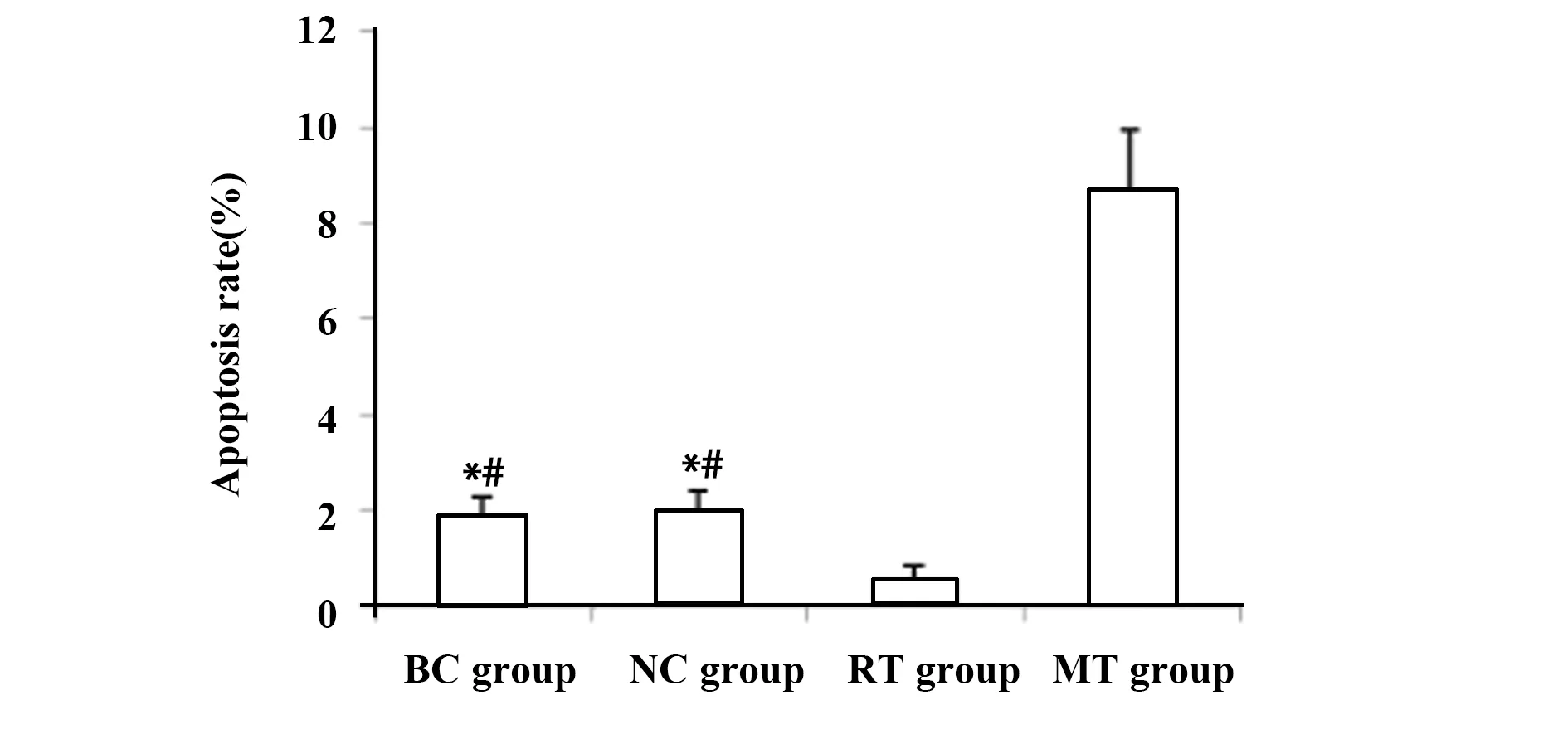
图4 HCT116细胞凋亡水平相比较Fig.4 Comparison of HCT116 cell apoptosis level
3 讨论
结肠癌的发生和发展是多步骤、多因素的进行性过程,详细机制尚未完全阐明,探讨其发病机制有助于对其有更深入的了解,并有助于指导临床治疗。miRNA为高保守、高组织特异性且无蛋白编码的小分子RNA,是转录后水平调控基因表达的关键因子,调节着人类三分之一的基因,参与诸多生理病理过程,在肿瘤的发生发展中发挥重要作用[6]。miRNA-145长度约4.08 kb,可通过调控IRS-1、IGF-IR、C-myc、RTKN、ERBB、BNIP3、YES、STAT1、EGFR、MUC-1等靶基因影响肿瘤细胞的生长、分化、侵袭、凋亡等过程[7]。
近年来的研究显示,miRNA-145在前列腺癌、胃癌、喉癌、肾癌、宫颈癌、非小细胞肺癌等肿瘤中均表现为水平下调,提示正常机体中miRNA-145可能抑制原癌基因激活,miRNA-145功能受到抑制可能是原癌基因激活的重要原因[8-13]。王丹等[14]研究显示,miR-145与Sp1在肺腺癌A549细胞中表达呈显著相关性,miR-145异常表达可能是Sp1基因表达的关键原因,miR-145可能通过对Sp1表达的调控影响A549细胞生物学行为。赵一奇等[15]研究认为,miR-145可下调肿瘤转移基因Mucl,沉默Mucl表达,调控肿瘤生长和抑制肿瘤转移,可能是临床肿瘤治疗的潜在手段。
本研究通过脂质体转染法转染miRNA-145拟似物和阻遏物至HCT116细胞,RT-PCR检测显示拟似物转染组HCT116细胞miRNA-145表达较空白对照组和阴性对照组显著升高,而阻遏物转染组HCT116细胞miRNA-145表达较空白对照组和阴性对照组显著降低。抑制miRNA-145表达则增强HCT116细胞增殖、侵袭活性、降低肿瘤细胞凋亡,增强miRNA-145表达则可降低HCT116细胞增殖、侵袭活性和增加肿瘤细胞凋亡。这些实验结果和数据提示,miRNA-145表达异常是影响HCT116细胞增殖、侵袭、凋亡重要因素,这为新的基因靶点的药物开发提供了思路。

