楮实子对APP/PS1双转基因小鼠海马神经发生的影响
张二飞, 殷 紫, 闫宇辉, 钱 俊, 韩永红
(1.江苏食品药品职业技术学院,江苏淮安223003;2.江苏护理职业学院,江苏淮安223003)
阿尔茨海默病是一种神经退行性病变,为老年痴呆最常见的类型,临床表现为认知功能丧失、记忆功能障碍等[1-3],主要病理特征为β-淀粉样蛋白过度沉积形成的细胞外老年斑、Tau蛋白过度磷酸化形成的神经元纤维缠结及神经元丢失[4],发病机制假说主要包括β淀粉样蛋白假说、Tau蛋白假说、炎症假说、氧化应激假说等[5-7]。
楮实子功效补肾清肝、明目、利尿,用于肝肾不足、腰膝酸软、虚劳骨蒸、头晕目昏、目生翳膜、水肿胀满,具有一定神经保护作用,能提高大鼠慢性脑供血不足后认知功能障碍,其水煎剂能通过调控MAPK通路改善D-半乳糖所致PC12细胞凋亡[8-12],但尚无对阿尔茨海默病模型的神经保护作用及机制尚未见报道。因此,本实验探讨楮实子对APP/PS1双转基因小鼠海马神经发生的影响。
1 材料
1.1 动物 SPF级8月龄C57BL/6雄性小鼠,购于辽宁长生生物有限公司,实验动物生产许可证号SCXK (辽) 2013-0001;8月龄 APP/PS1双转基因小鼠,购于北京中科泽晟生物技术有限公司,实验动物生产许可证号SCXK(京)2013-0002,体质量 (30±3)g,分笼饲养,自由摄食饮水,室温20~25℃,相对湿度40%~60%,每天光照12 h,采用PCR法鉴定,选取阳性小鼠用于实验。
1.2 试药 楮实子购自安徽亳州药材市场,经江苏食品药品职业技术学院祝冬青副教授鉴定为正品。多奈哌齐 (批号664081,美国Sigma公司)。TUNEL试剂盒 (南京凯基生物科技发展有限公司);BrdU (美国 Sigma公司);小鼠抗 BrdU、GSK-3β, 兔抗 NeuN、 β-catenin、 β-actin抗体 (北京博奥森生物技术有限公司);羊抗小鼠FITC、驴抗兔Cy3标记二抗 (美国Jackson公司);辣根过氧化物酶 (HRP)、标记羊抗小鼠IgG、HRP标记驴抗兔IgG(北京鼎国生物技术有限公司);全蛋白提取、BCA蛋白定量试剂盒 (上海碧云天生物技术有限公司)。其他试剂均为国产分析纯。
1.3 仪器 CM1850冰冻切片机、DMLS2显微镜、DFC500照相系统 (德国徕卡公司);MS-1水迷宫仪 (成都仪器厂);水平核酸电泳仪、半干式蛋白转膜仪 (美国Bio-Rad公司)。
2 方法
2.1 分组 将40只APP/PS1双转基因小鼠随机分为模型组、阳性药组 (10 mg/kg多奈哌齐)及楮实子低、 高剂量组 (1.8、 3.6 g/kg), C57BL/6小鼠作为对照组,每组10只。
2.2 给药 50 g楮实子用蒸馏水浸泡1 h后煎煮2次,每次2 h,合并药液,浓缩至100 mL,终质量浓度为0.5 g/mL(生药量),小鼠灌胃给药,同时阳性药组小鼠灌胃给予10 mg/kg多奈哌齐,对照组小鼠灌胃给予同体积的蒸馏水,连续6周。
2.3 Morris水迷宫实验 经过6周给药后,采用Morris水迷宫实验检测小鼠学习记忆能力。检测仪器由1个圆桶 (直径120 cm、高60 cm)、摄像及自动图像采集分析系统组成,桶内分成4个象限,逃生平台 (直径10 cm)置于其中1个象限内,加水 (水温25℃)至水面高于平台2 cm,观察小鼠寻找台面所需时间及穿越平台次数。
2.4 原位末端标记 (TUNEL)法 小鼠给药后处死取脑,制备冰冻切片,根据TUNEL试剂盒说明书操作步骤检测海马区神经细胞凋亡。
2.5 免疫荧光染色 将5 μm脑冰冻冠状切片于室温下晾干,固定、透化、封闭后兔抗NeuN、鼠抗BrdU抗体(1∶150)4℃下孵育过夜,次日滴加羊抗小鼠 Cy3标记、驴抗兔 FITC标记二抗(1∶200)室温孵育1 h,DAPI染核,盖玻片封片,置于荧光显微镜下观察NeuN/BrdU阳性细胞表达。
2.6 Western Blot法 小鼠麻醉后进行心脏灌流,取海马区脑组织,研磨,经蛋白提取、定量、电泳、转膜及显色后凝胶成像分析系统扫描,测定光密度,其中GSK-3β、β-catenin、β-actin抗体稀释浓度分别为1∶800、1∶600、1∶1 000,HRP标记二抗稀释浓度为1∶800。然后,以目的条带、内参蛋白条带光密度比值为指标进行分析。
2.7 统计学分析 SPSS 17.0软件进行处理,数据以 (±s)表示,组间比较采用单因素方差分析。以P<0.05为具有显著性差异。
3 结果
3.1 楮实子对小鼠学习记忆能力的影响 图1A显示,与对照组比较,模型组小鼠潜伏期显著延长(P<0.01);与模型组比较,楮实子高剂量组其潜伏期显著缩短 (P<0.05)。图1B显示,与对照组比较,模型组小鼠穿越平台次数显著降低 (P<0.01);与模型组比较,楮实子高剂量组其次数显著增加 (P<0.05)。
3.2 楮实子对小鼠海马区神经细胞凋亡的影响 图2显示,与对照组比较,模型组小鼠海马区凋亡细胞数显著增加 (P<0.01);与模型组比较,楮实子高剂量组其数量显著降低 (P<0.01)。
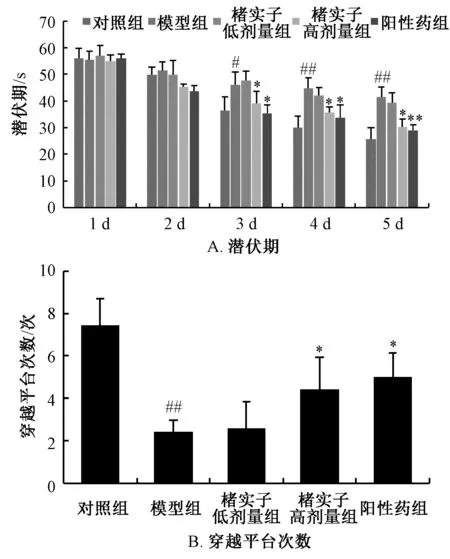
图1 楮实子对小鼠学习与记忆能力的影响Fig.1 Effects of Broussonetiae Fructus on mouse learning and memory activities

图2 楮实子对小鼠海马区神经细胞凋亡的影响Fig.2 Effect of Broussonetiae Fructus on nerve cell apoptosis in mouse hippocampal area
3.3 楮实子对小鼠海马区神经发生的影响 图3显示,与对照组比较,模型组小鼠海马新生神经元数显著降低 (P<0.01);与模型组比较,楮实子高剂量组其数量显著增加 (P<0.01)。
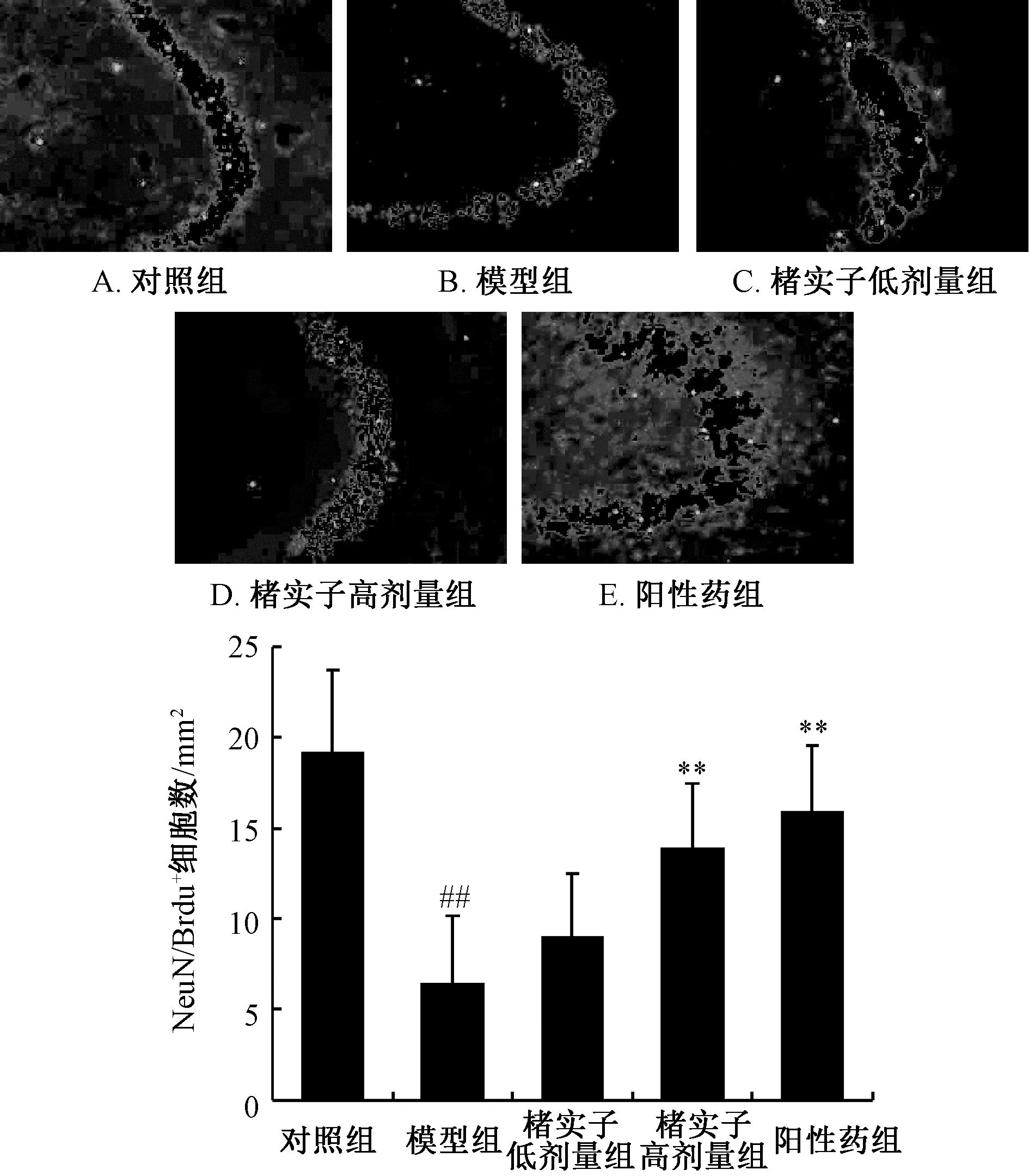
图3 楮实子对小鼠海马区神经发生的影响Fig.3 Effect of Broussonetiae Fructus on neurogenesis in mouse hippocampal area
3.4 楮实子对GSK-3β、β-catenin蛋白表达的影响
图4显示,与对照组比较,模型组GSK-3β蛋白表达显著升高,β-catenin蛋白表达显著降低 (P<0.01);与模型组比较,楮实子高剂量组GSK-3β蛋白表达显著降低,β-catenin蛋白表达显著升高(P<0.05)。
4 讨论
阿尔茨海默病是一种中枢神经系统退行性疾病,临床表现为患者生活能力下降、记忆力减退,并出现神经行为异常、认知功能障碍,甚至生活不能自理,随着老龄化加剧,患病人数将保持快速增长,预计到2030年全世界患者将达到6 500万左右,将会对全社会造成严重负担[13]。
神经干细胞在一定条件下可分化为神经元及胶质细胞,参与神经功能维持、修复等过程,称为神经发生[14-15]。成年哺乳动物海马区仍然具有神经发生的能力,打破了中枢神经系统神经元不能再生的观点,也是阿尔茨海默病患者最易受损的区域之一,它主要负责学习记忆功能,故患者在早期均会出现学习记忆障碍[16-17]。
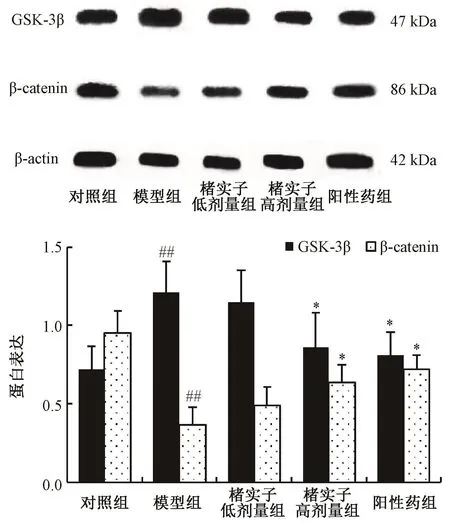
图4 楮实子对GSK-3β、β-catenin蛋白表达的影响Fig.4 Effects of Broussonetiae Fructus on GSK-3β,β-catenin protein expressions
APP/PS1双转基因小鼠是公认的阿尔茨海默病动物模型之一[18],可表达突变的人类早老素(DeltaE9)和人鼠淀粉样前体蛋白 (APPswe)融合体,人类早老素基因的第9个外显子突变缺失会导致早发性老年痴呆症[19]。本实验发现,高剂量(3.6 g/kg) 楮实子能显著改善APP/PS1小鼠学习记忆能力。研究表明,在阿尔茨海默病发生时,Aβ大量沉积,导致海马神经元大量凋亡和丢失,从而引起海马神经发生障碍。利用TUNEL法和NeuN/BrdU免疫荧光染色检测小鼠海马CA3区神经细胞凋亡及神经元新生情况,发现模型组神经细胞凋亡数显著增多,新生神经元数显著降低 (P<0.01),而给予高剂量 (3.6 g/kg) 楮实子后海马区神经细胞凋亡显著减少 (P<0.01),新生神经元数也显著增加 (P<0.01),表明它能促进 APP/PS1小鼠海马神经发生。
Wnt/β-catenin信号通路是影响神经干细胞增殖、分化和神经元凋亡最重要的通路之一,当通路激活时可引起GSK-3β表达下降,β-catenin水平升高[20]。 研究表明, 激活 Wnt/β-catenin 信号通路能促进神经干细胞增殖,刺激其分化为神经元,并能减少神经元的凋亡,在哺乳动物中枢神经系统神经元再生中起重要作用[21-23]。本实验发现,模型组小鼠海马区GSK-3β蛋白表达显著升高,β-catenin蛋白表达显著降低 (P<0.01),而给予高剂量(3.6 g/kg)楮实子后 β-catenin蛋白表达显著升高,GSK-3β蛋白表达显著降低 (P<0.05),表明它能减少神经元凋亡、促进神经发生,在一定程度上与激活可Wnt/β-catenin信号通路。
综上所述,楮实子可减少阿尔茨海默病小鼠海马神经细胞凋亡,促进神经发生,改善学习记忆能力,其机制可能与激活 Wnt/β-catenin信号通路有关。

